1 . 某兴趣小组通过下列实验探究 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
(1)探究 与
与 的氧化性强弱
的氧化性强弱
【实验 】将
】将 溶液和
溶液和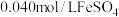 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
_____  (填“>”“<”)。
(填“>”“<”)。
(2)验证反应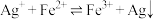 是可逆反应
是可逆反应
【实验Ⅱ】
①取实验 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。
②根据实验数据,证明该反应为可逆反应,不需要完成表格中编号_____ 的实验。
(3)测定反应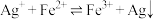 的平衡常数
的平衡常数
测定方案:通过氧化还原滴定法可测定平衡时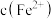 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和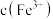 ,进而求算出平衡常数
,进而求算出平衡常数 。
。
【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取 上层清液,用
上层清液,用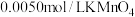 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为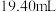 。
。
①用于盛装 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为_____ 。
②平衡时
_____  ,平衡常数
,平衡常数
_____ 。
③若取实验 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值_____ 。
A.偏大 B.偏小 C.无影响 D.无法判断
 与
与 的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。
的氧化性强弱,并对实验原理所涉及的反应进行定性、定量研究。(1)探究
 与
与 的氧化性强弱
的氧化性强弱【实验
 】将
】将 溶液和
溶液和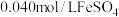 溶液(
溶液( )等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
)等体积混合,产生灰黑色沉淀,溶液呈黄色。该条件下,根据实验现象可以判断出氧化性:
 (填“>”“<”)。
(填“>”“<”)。(2)验证反应
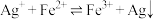 是可逆反应
是可逆反应【实验Ⅱ】
①取实验
 反应后的上层清液或沉淀进行实验,将表格补充完整。
反应后的上层清液或沉淀进行实验,将表格补充完整。| 实验编号 | 操作及现象 | 结论 |
| 1 | 取上层黄色清液,滴加 | 存在 |
| 2 | 取少量灰黑色沉淀,滴加浓硝酸,沉淀溶解,出现红棕色气体 | 存在 |
| 3 | 操作及现象是: | 存在 |
| 4 | 取上层清液,滴加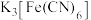 溶液,产生蓝色沉淀 溶液,产生蓝色沉淀 |
(3)测定反应
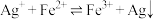 的平衡常数
的平衡常数测定方案:通过氧化还原滴定法可测定平衡时
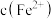 ,再根据实验
,再根据实验 反应物浓度数据计算得出
反应物浓度数据计算得出 和
和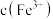 ,进而求算出平衡常数
,进而求算出平衡常数 。
。【实验Ⅲ】室温下,待实验Ⅰ中反应达到平衡状态时,取
 上层清液,用
上层清液,用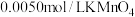 标准溶液滴定
标准溶液滴定 ,达到滴定终点记录消耗
,达到滴定终点记录消耗 标准溶液的体积。重复实验3次,平均消耗
标准溶液的体积。重复实验3次,平均消耗 标准溶液的体积为
标准溶液的体积为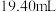 。
。①用于盛装
 标准溶液进行滴定的玻璃仪器名称为
标准溶液进行滴定的玻璃仪器名称为②平衡时

 ,平衡常数
,平衡常数
③若取实验
 反应后的含
反应后的含 浊液进行实验Ⅱ,会使测得的平衡常数
浊液进行实验Ⅱ,会使测得的平衡常数 值
值A.偏大 B.偏小 C.无影响 D.无法判断
您最近一年使用:0次
解题方法
2 . 气体中微量的H2S,对工业生产和环境都有危害。通过以下实验装置利用20%脱硫剂三嗪(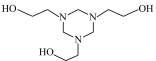 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。

回答下列问题:
(1)仪器1的名称是_______ 。装置甲制取CO2,实验室制取CO2的离子方程式为_______ 。
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是_______ 。
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是_______ ;
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是_______ 。
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为_______ mol·L-1。
(5)三嗪( )水溶液吸收H2S,生成
)水溶液吸收H2S,生成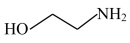 和
和 化学方程式为
化学方程式为_______ 。CuSO4溶液没有出现_______ (填现象), 证明三嗪吸收H2S的化学反应具有_______ 、_______ 等特征,20%三嗪水溶液是很好的脱硫剂。
 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
回答下列问题:
(1)仪器1的名称是
(2)仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是
(3)操作步骤:
①打开开关A、C,放入酸溶液产生CO2,目的是
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是
(4)通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3,则该混合气体中c(H2S)计算式为
(5)三嗪(
 )水溶液吸收H2S,生成
)水溶液吸收H2S,生成 和
和 化学方程式为
化学方程式为
您最近一年使用:0次
2022-06-14更新
|
277次组卷
|
2卷引用:江西省抚州市2022届高三下学期4月教学质量监测理综化学试题
3 . 为实现相关实验目的,选用的试剂、装置和操作均合理的是
| 实验目的 | 实验内容 | |
| A | 证明氨水中存在一水合氨的电离平衡 | 向含有酚酞的氨水中加入少量NaOH固体 |
| B | 配制100mL1.0 mol • L-1 NaOH 溶液 | 向100 mL容量瓶中加入4. 0 g NaOH固体,加水到刻度线 |
| C | 模拟利用牺牲阳极的阴极保护法保护铁 | 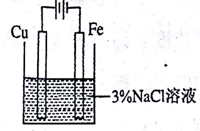 |
| D | 比较Cl-和I-的还原性 | 将少量Cl2通入滴有淀粉溶液的KI溶液中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:
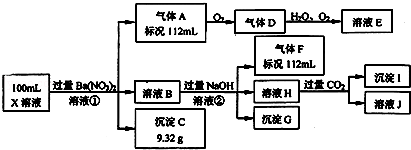
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是____________ ,能证明该阴离子是否存在的简单实验操作为_________________ 。
(2)用离子方程表达下列反应:
①中生成气体A:_________________________ ,②中生成溶液H:_____________________________ 。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为_______ mol/L、c(Fe3+)为______ mol/L、c(Cl﹣)为________ mol/L.(若有些离子不存在,请填0mol/L)

根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是
(2)用离子方程表达下列反应:
①中生成气体A:
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0ml时开始产生沉淀,55ml时沉淀的量达到最大值0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe2+)为
您最近一年使用:0次
2016-12-09更新
|
394次组卷
|
2卷引用:2017届辽宁省沈阳东北育才学校高三上模拟二化学试卷
5 . 一种电池的总反应为4Li+2SOCl2=SO2↑+4LiCl+S,设NA为阿伏加德罗常数的值。下列说法错误的是
| A.1molSOCl2中所含的共价键数目为4NA |
| B.每生成1molS,转移2NA个电子 |
| C.标准状况下,22.4LSO2中电子的数目为32NA |
| D.1.0L1.0mol•L-1LiCl溶液中Cl-数目为1.0NA |
您最近一年使用:0次
6 . CO与H2S反应可以制得COS,其化学方程式为 。NA为阿伏加德罗常数的值,下列有关说法正确的是
。NA为阿伏加德罗常数的值,下列有关说法正确的是
 。NA为阿伏加德罗常数的值,下列有关说法正确的是
。NA为阿伏加德罗常数的值,下列有关说法正确的是A.2.8g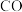 中含有的中子数为1.4NA 中含有的中子数为1.4NA |
B.pH=3的H2S溶液中 的数目为0.001NA 的数目为0.001NA |
C.0.1molCOS中 键数目为0.4NA 键数目为0.4NA |
| D.生成2.24LH2(标准状况),转移电子数目为0.4NA |
您最近一年使用:0次
名校
7 . 硫酸是重要的化工原料,我国工业上一般以黄铁矿为原料来制备硫酸。工业制硫酸涉及下列反应:① ;②
;② ;③
;③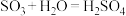 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为
),将焦硫酸稀释后可制得密度为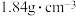 、质量分数为98%的浓硫酸。下列说法不正确的是
、质量分数为98%的浓硫酸。下列说法不正确的是
 ;②
;② ;③
;③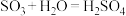 。生产中用浓硫酸代替水吸收
。生产中用浓硫酸代替水吸收 ,制得焦硫酸(
,制得焦硫酸( ,也可以表示为
,也可以表示为 ),将焦硫酸稀释后可制得密度为
),将焦硫酸稀释后可制得密度为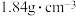 、质量分数为98%的浓硫酸。下列说法不正确的是
、质量分数为98%的浓硫酸。下列说法不正确的是A.每生成1mol 时,转移5.5mol电子 时,转移5.5mol电子 |
B.焦硫酸钠( )的水溶液呈酸性 )的水溶液呈酸性 |
C.质量分数为98%的浓 ,物质的量浓度为18.4mol/L ,物质的量浓度为18.4mol/L |
D.浓硫酸吸收 生成焦硫酸的变化是物理变化 生成焦硫酸的变化是物理变化 |
您最近一年使用:0次
名校
8 . NA表示阿伏加德罗常数的值。下列有关说法正确的是
| A.1 L0.1 mol/LNaOH溶液中含有的氧原子数目为0.1NA |
| B.常温常压下,2.24 L丙烷中含有的共价键数目为NA |
| C.1 L0.5 mol/L FeCl3溶液中含有的阳离子数目大于0.5NA |
D.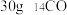 中含有的质子数为16NA 中含有的质子数为16NA |
您最近一年使用:0次
2021-10-28更新
|
182次组卷
|
3卷引用:湖北省名校教研联盟2022届高三上学期10月联考化学试题
名校
解题方法
9 . 微观探析是认识物质的一种途径。设 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是
 为阿伏加德罗常数,下列有关说法正确的是
为阿伏加德罗常数,下列有关说法正确的是A.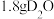 中含有的中子数目为 中含有的中子数目为 |
B.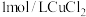 溶液中含有 溶液中含有 的数目小于 的数目小于 |
C.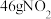 与 与 的混合物中含有的分子数为 的混合物中含有的分子数为 |
D.25℃,101kPa, 与NaOH溶液完全反应,转移电子数目为 与NaOH溶液完全反应,转移电子数目为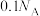 |
您最近一年使用:0次
2024-03-06更新
|
863次组卷
|
4卷引用:2024届广东省汕头市高三下学期一模化学试题
10 .  是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为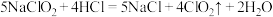 。
。 表示阿伏加德罗常数的值,下列说法中正确的是
表示阿伏加德罗常数的值,下列说法中正确的是
 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备,反应为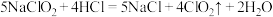 。
。 表示阿伏加德罗常数的值,下列说法中正确的是
表示阿伏加德罗常数的值,下列说法中正确的是A.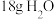 中含有的电子数为 中含有的电子数为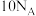 |
B. 固体中含有 固体中含有 个 个 分子 分子 |
C.每生成 ,转移的电子数为 ,转移的电子数为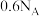 |
D.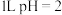 的稀盐酸中含有的 的稀盐酸中含有的 数目为 数目为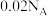 |
您最近一年使用:0次
2023-04-29更新
|
557次组卷
|
3卷引用:辽宁省阜新市2023届高三4月联考化学试题



