1 . 用NA表示阿伏加 德罗常数的值。下列有关说法正确的是( )
| A.1mol氮气与3mol氢气反应,生成的氨分子数目为2NA |
| B.1.0mol•L-1Na2SO3水溶液中含有的硫原子数目为NA |
| C.电解饱和食盐水,当阳极产生11.2LH2时,转移的电子数为NA |
| D.常温下,3L0.1mol•L-1FeCl3溶液所含Fe3+数目小于0.3NA |
您最近一年使用:0次
2019·安徽·一模
2 . 下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法不正确的是
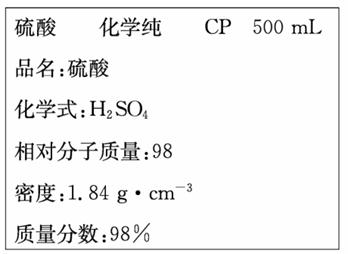

| A.该硫酸的物质的量浓度为18.4mol/L |
| B.1 mol Zn与足量的该硫酸反应,标准状况下产生22.4L气体时,转移的电子数为2NA |
| C.配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL |
| D.该硫酸与等体积的水混合后所得溶液的物质的量浓度等于9.2mol/L |
您最近一年使用:0次
13-14高三·甘肃·阶段练习
名校
3 . 1.76g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2气体1792mL(标准状况),向反应后的溶液中加入适量的1.0 mol/LNaOH溶液,恰好使溶液中的金属离子全部沉淀。下列说法不正确的是
| A.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| B.浓硝酸在反应中表现了氧化性和酸性,且表现氧化性的硝酸的物质的量为0.08 mol |
| C.得到沉淀的质量为3.12g |
| D.加入NaOH溶液的体积是50 mL |
您最近一年使用:0次
2019-02-13更新
|
487次组卷
|
24卷引用:2016届江西万载高三第二次能力模拟冲刺理科综合化学试卷
2016届江西万载高三第二次能力模拟冲刺理科综合化学试卷河南省林州市第一中学2018届高三7月调研考试化学试题河北省衡水中学2018届高三上学期二调考试化学试题陕西安康市紫阳县紫阳中学2019届高三上学期入学调研考试化学试题福建省泉州第五中学2019届高三入学调研考试化学试题(已下线)2014届甘肃河西五市部分普通高中高三第一次联合考试化学试卷(已下线)2013-2014北京101中学高三第三次月考理综化学试卷(已下线)2014湖南长沙市长郡中学高三上学期第四次月考化学试卷2015届宁夏银川九中高三上学期期中化学试卷(已下线)2014届北京101中学高三年级第三次月考理综化学试卷2016届河北省衡水中学高三上学期二调化学试卷2016届甘肃省张掖、嘉峪关、山丹部分高中高三上学期期中联考化学试卷2016届甘肃省河西五市部分普通高中高三上第一次联考化学试卷河北省邯郸市(大名县、永年区、磁县、邯山区)四县2016-2017学年高二下学期期中联考化学试题江西省南昌市第三中学2016-2017学年高一下学期5月月考化学试题江西省上高县第二中学2018届高三第一次月考化学试题云南省临沧市第一中学2018届高三上学期第七次月考化学试题江西省樟树中学2017-2018学年高一下学期第三次月考化学试题【校级联考】安徽省江南片2019届高三上学期入学摸底考试化学试题甘肃省武威第一中学2019届高三上学期期末考试化学试题(已下线)专题1.2 物质的量浓度(练)-《2020年高考一轮复习讲练测》安徽省肥东县高级中学2021届高三上学期第二次月考化学试题安徽省滁州市定远县重点中学2021届高三上学期11月质量检测化学试题宁夏银川一中2021-2022学年高一上学期期末考试化学试题
名校
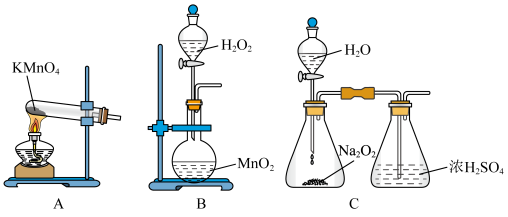
4 . 氯化亚铜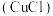 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
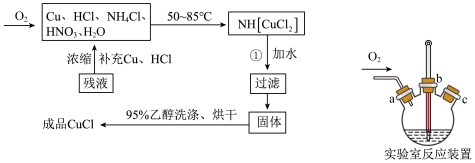
实验药品:铜丝 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。
(1)质量分数为20%的盐酸密度为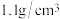 ,物质的量浓度为
,物质的量浓度为______ ;用浓盐酸配制20%盐酸需要的玻璃仪器有:______ 、烧杯、玻璃棒、胶头滴管。
(2)实验室制备 过程如下:
过程如下:
①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是______ ;
②加热至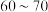 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为______ ;
三颈瓶中生成 的总的离子方程为
的总的离子方程为______ ;
将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用______ (填字母)。
(4)下列说法不正确的是______
A.步骤Ⅰ中 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化
C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是______ 、______ (答出两条)。
(6)氯化亚铜的定量分析:
①称取样品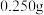 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;
②用 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:
已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
则样品中 的纯度为
的纯度为______ (结果保留3位有效数字)。
误差分析:下列操作会使滴定结果偏高的是______ 。
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
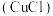 是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成
是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸;可溶于氯离子浓度较大的体系,形成 。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
。在潮湿空气中迅速被氧化,见光则分解。右下图是实验室仿 工业制备氯化亚铜的流程进行的实验装置图。
实验药品:铜丝
 、氯化铵
、氯化铵 、65%硝酸
、65%硝酸 、20%盐酸
、20%盐酸 、水。
、水。(1)质量分数为20%的盐酸密度为
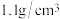 ,物质的量浓度为
,物质的量浓度为(2)实验室制备
 过程如下:
过程如下:①检查装置气密性,向三颈瓶中加入铜丝、氢化铵、硝酸、盐酸,关闭
 。实验开始时,温度计显示反应液温度低于室温,主要原因是
。实验开始时,温度计显示反应液温度低于室温,主要原因是②加热至
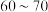 ℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开
℃,铜丝表面产生无色气泡,烧瓶上方气体颜色逐渐由无色为红棕色,气囊鼓起。打开 ,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭
,通入氧气一段时间,将气囊变瘪,红棕色消失后关闭 ,冷却至室温,制得
,冷却至室温,制得 。通入氧气的目的为
。通入氧气的目的为三颈瓶中生成
 的总的离子方程为
的总的离子方程为将液体转移至烧杯中用足量蒸馏水稀释,产生白色沉淀,过滤得氧化亚铜粗品和滤液。
③粗品用95%乙醇洗涤、烘干得氧化亚铜。
(3)便于观察和控制产生
 的速率,制备氧气的装置最好运用
的速率,制备氧气的装置最好运用
(4)下列说法不正确的是
A.步骤Ⅰ中
 可以省去,因为已经加入了
可以省去,因为已经加入了
B.步骤Ⅱ用去氧水稀释,目的是使
 转化为
转化为 ,同时防止
,同时防止 被氧化
被氧化C.当三颈烧瓶上方不出现红棕色气体时,可停止通入氧气
D.流程中可循环利用的物质只有氯化铵
(5)步骤Ⅲ用95%乙醇代替蒸馏水洗涤的主要目的是
(6)氯化亚铜的定量分析:
①称取样品
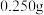 和
和 过量的
过量的 溶液于
溶液于 锥形瓶中,充分溶解;
锥形瓶中,充分溶解;②用
 硫酸[Ce(SO4)2]标准溶液测定。已知:
硫酸[Ce(SO4)2]标准溶液测定。已知:已知:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
三次平衡实验结果如下表(平衡实验结果相差不能超过1%):
| 平衡实验次数 | 1 | 2 | 3 |
 样品消耗硫酸锑标准溶液的体积 样品消耗硫酸锑标准溶液的体积 | 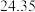 | 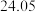 2 2 | 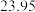 |
则样品中
 的纯度为
的纯度为误差分析:下列操作会使滴定结果偏高的是
A.锥形瓶中有少量蒸馏水 B.滴定终点读数时仰视滴定管刻度线
C.所取
 溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
溶液体积偏大 D.滴定前滴定管尖端有气泡,滴定后气泡消失
您最近一年使用:0次
名校
解题方法
5 . 20℃时,饱和NaCl溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则下列说法中错误的是
| A.温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L |
B.20℃时,饱和NaCl溶液的质量分数为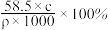 |
| C.20℃时,密度小于ρ g/cm3的NaCl溶液是不饱和溶液 |
D.20℃时,饱和NaCl溶液的溶解度 |
您最近一年使用:0次
2020-03-24更新
|
213次组卷
|
18卷引用:辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题
辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题2017届江西省上高二中高三上第一次月考(开学考试)化学2017届河北省衡水中学高三上期中化学卷湖北省孝感高级中学2018届高三9月摸底考试化学试题湖北省襄阳市第四中学2017-2018学年高一10月月考化学试题【全国百强校】福建省泉州第五中学2017届高三上学期期中检测化学试题(已下线)学科网2019年高考化学一轮复习讲练测1.2 物质的量浓度 测【全国百强校】重庆市巴蜀中学2019届高三上学期期中复习化学试题【市级联考】吉林省东辽市2019届高三上学期期中考试化学试题【百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期末考试化学试题河南省南阳市第一中学2020届高三上学期第一次月考化学试题辽宁省大连海湾高级中学2019-2020学年高三上学期期中考试化学试题(已下线)上海市青浦区2014届高三上学期期末考试(即一模)化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考福建省永安市第三中学2021届高三9月月考化学试题河南省南阳市第一中学2021届高三上学期第一次月考(8月)化学试题(已下线)【南昌新东方】13. 新建二中 梁莎.黑龙江省鹤岗市第一中学2020-2021学年高二下学期期末考试化学试题
6 . 化学中存在许多“守恒或相等”。下列说法错误的是
| A.用水稀释浓溶液时,稀释前溶质质量与稀释后溶质质量相等 |
| B.化学反应中,反应物的物质的量之和与生成物的物质的量之和相等 |
| C.氧化还原反应中,氧化剂得电子总数与还原剂失电子总数相等 |
| D.化学反应中,消耗的反应物总质量与所生成产物的总质量相等 |
您最近一年使用:0次
2018-03-09更新
|
203次组卷
|
2卷引用:上海市静安区七一中学2018届高考一模化学试题
7 . 用NA表示阿伏伽德罗常数,下列说法错误的是
| A.标准状况下,11.2L CCl4所含C-Cl键数目不是2NA |
| B.常温下,78g Na2S与Na2O2混合物中含有NA阴离子 |
| C.1mol乙醇和足量的CH3CO18OH发生酯化反应得到的H218O数目为NA |
| D.室温下,2L0.05 mol/L的NH4NO3溶液中所含的氮原子数目为0.2 NA |
您最近一年使用:0次
2018-05-20更新
|
439次组卷
|
2卷引用:【全国省级联考】安徽省A10联盟2018届高三最后一卷理综化学试题
名校
8 . 化学与生产、生活和科技进步紧密相关,下列说法不正确的是
| A.同素异形体之间的变化是物理变化.而同分异构体之间的变化是化学变化 |
| B.配制一定物质的量浓度的溶液一定需要一定体积的容量瓶,而配制一定质量分数的溶液则不需要一定体积的容量瓶 |
| C.2016年中国部分城市的“雾霾”与城市汽车排放的尾气有关 |
| D.过程的自发性只能用于判断过程的方向,不能确定过程是否一定发生和过程发生的速率 |
您最近一年使用:0次
名校
9 . 1.76g铜镁合金完全溶解于50mL、密度为1.40g·cm-3、质量分数为63%的浓硝酸中,得到1792mLNO2和224mN2O4 (标准状况)混合气体,向反应后的溶液中加入适量的10.0 mol·L-1 NaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
| A.该浓硝酸中HNO3的物质的量浓度是14.0 mol·L-1 |
| B.加入NaOH溶液的体积是60mL |
| C.反应中被还原的硝酸的物质的量为0.08mol |
| D.得到的金属氢氧化物的沉淀为3.46g |
您最近一年使用:0次
2017-09-25更新
|
668次组卷
|
3卷引用:湖南省永州市2018届高三上学期第一次模拟考试化学试题
10 . 20℃时,饱和NaCl溶液密度为1.1g.cm-3,物质的量浓度为5.0 mol·L-1,下列说法不正确的是
| A.25℃时,饱和NaCl溶液的物质的量浓度大于5.0mol/L |
| B.20℃时,饱和NaCl溶液的质量分数约为26.6% |
| C.20℃时,密度小于1.1g/cm3的NaCl溶液是不饱和溶液 |
| D.将此饱和NaCl溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.1g/cm3 |
您最近一年使用:0次
2017-12-13更新
|
89次组卷
|
3卷引用:安徽省蒙城县第一中学、淮南第一中学等2018届高三上学期“五校”联考化学试题
安徽省蒙城县第一中学、淮南第一中学等2018届高三上学期“五校”联考化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.1 化学常用计量及其应用河南省淮阳县陈州高级中学2019-2020学年高一上学期期中考试化学试题



