2024高三下·全国·专题练习
解题方法
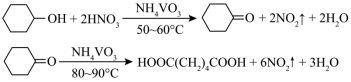
1 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
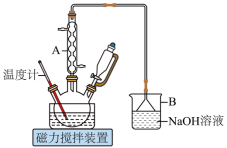
(1)将步骤Ⅲ补充完整:_______ 。步骤Ⅳ提纯方法的名称为_______ 。如图为1,6己二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为ρg·mL-1;该溶液的物质的量浓度为_______ 。
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:

| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近一年使用:0次
2 .  为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.100g46%的乙醇溶液中含有O-H键的数目为 |
B.标准状况下,11.2LHF中电子的数目为 |
C.pH=1的 溶液中 溶液中 的数目为 的数目为 |
D.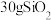 中含有的Si-O键数目为 中含有的Si-O键数目为 |
您最近一年使用:0次
名校
解题方法
3 . 相对分子质量为Mr的气态化合物V L(标准状况)溶于m g水中,得到溶液的质量分数为w%,物质的量浓度为c mol·L-1,密度为ρ g·cm-3,则下列说法正确的是
A.溶液密度ρ可表示为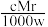 | B.物质的量浓度c可表示为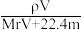 |
C.溶液的质量分数w%可表示为 | D.相对分子质量Mr可表示为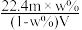 |
您最近一年使用:0次
2023-10-29更新
|
1123次组卷
|
42卷引用:辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题
辽宁省抚顺市第一中学2020届高三上学期期中考试化学试题(已下线)考点02 物质的量与阿伏加德罗常数-2020年高考化学命题预测与模拟试题分类精编(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)陕西省周至县第四中学2021-2022学年高三上学期10月月考化学试题(已下线)考点02 化学用语和常用化学计量-备战2022年高考化学学霸纠错(全国通用)(已下线)第2讲 物质的浓度及溶液配制黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题黑龙江省哈尔滨师范大学附属中学2024届高三上学期开学考试化学试题山西省晋城市第一中学校2023-2024学年高三上学期第四次调研化学试题(已下线)2018年9月16日《每日一题》人教必修1- 每周一测湖南省长沙市周南梅溪湖中学2018-2019学年高一下学期一模检测化学试题【全国百强校】四川省成都市石室中学2018-2019学年高一上学期10月月考化学试题人教版高一化学必修1第一章—第三章综合测试题江西省南昌市新建区第一中学2019—2020学年高一上学期第一次月考化学试题鲁科版高中化学必修1第一章《认识化学科学》测试卷河北省沧州市第一中学2019-2020学年高二4月月考化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考江西省南昌市八一中学2019-2020学年高一下学期开学考试(5月)化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题(已下线)【南昌新东方】4.进贤一中 田荣达江西省南昌新建一中2020-2021学年高一上学期第一次月考化学试题江西省南昌市进贤县第一中学2020-2021学年高一上学期第一次月考化学试题河南省郑州市第一中学2020-2021学年高一上学期第一次月考化学试题陕西省西安市第一中学2021-2022学年高一上学期10月月考化学试题湖北省荆州中学2021-2022学年高一上学期期末考试化学试题黑龙江省哈尔滨市第九中学校2022-2023学年高一上学期11月月考化学试题内蒙古鄂尔多斯市第一中学2022-2023 学年高一上学期期末考试化学试题(已下线)第12讲 物质的量浓度的相关计算-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)湖南省部分学校2023-2024学年高三上学期第二次联考化学试题辽宁省东北育才学校科学高中部2023-2024学年高一上学期第一次月考化学试题河北省石家庄二中实验学校2023-2024学年高一上学期12月月考化学试题天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷广东省揭阳市惠来县第一中学2018-2019学年高一上学期期中考试化学试题云南省丽江市华坪县第一中学2019—2020学年高一上学期期末考试化学试题云南省昭通市绥江县二中2019-2020学年高一上学期期末考试化学试题浙江省诸暨中学2019-2020学年高二下学期期中考试化学试题黑龙江省齐齐哈尔市讷河市拉哈一中2020-2021学年高一上学期12月月考化学试题湖北省部分重点中学2022-2023年高一上学期期末联合考试化学试题山东省新泰市第一中学(实验部)2023-2024学年高一上学期第二次月考化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题
2023高三·全国·专题练习
4 . 下列有关的叙述正确的是_______ 。
A.1 L 0.6 mol·L-1的食盐水中含氯化钠0.6mol
B.0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液物质的量浓度为0.5 mol·L-1
C.标况下,44.8L氯化氢气体溶于1L水中,所得溶液物质的量浓度为2mol·L-1
D.20g氢氧化钠溶于水配成物质的量浓度为1mol·L-1的溶液,可得溶液1L
E.0.2mol·L-1的CaCl2溶液中含有的Cl-的数目为0.4NA
F.0.1mol·L-1NH4Cl溶液中含有 的浓度为0.1mol·L-1
的浓度为0.1mol·L-1
G.1L 0.1mol·L-1的H2SO3溶液中含0.1 个SO
个SO
A.1 L 0.6 mol·L-1的食盐水中含氯化钠0.6mol
B.0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液物质的量浓度为0.5 mol·L-1
C.标况下,44.8L氯化氢气体溶于1L水中,所得溶液物质的量浓度为2mol·L-1
D.20g氢氧化钠溶于水配成物质的量浓度为1mol·L-1的溶液,可得溶液1L
E.0.2mol·L-1的CaCl2溶液中含有的Cl-的数目为0.4NA
F.0.1mol·L-1NH4Cl溶液中含有
 的浓度为0.1mol·L-1
的浓度为0.1mol·L-1G.1L 0.1mol·L-1的H2SO3溶液中含0.1
 个SO
个SO
您最近一年使用:0次
2021高三·全国·专题练习
名校
5 . 实验中需用1.0mol·L-1的CuSO4溶液950mL,配制时选用容量瓶的规格和称取药品的质量分别为
| 选项 | A | B | C | D |
| 容量瓶规格 | 1000 mL | 950 mL | 1000 mL | 500 mL |
| CuSO4 | 152.0 g | 152.0 g | 160.0 g | 80.0 g |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-07-21更新
|
275次组卷
|
5卷引用:课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)
(已下线)课时12 物质的量浓度与溶液的配制-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第2讲 物质的浓度及溶液配制(已下线)考点03 物质的量浓度及溶液配制(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)福建省宁德第一中学2024届高三上学期第一次检测化学试题(已下线)实验01 配制一定物质的量浓度的溶液-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第一册)
2023高三·全国·专题练习
6 . 现有VL0.5mol·L-1的盐酸,欲将其浓度扩大一倍,以下方法中最宜采用的是
| A.加热浓缩到原来体积的一半 |
| B.加入5mol·L-1的盐酸0.125VL |
| C.加入10mol·L-1的盐酸0.1VL,再稀释至1.5VL |
| D.标准状况下通入11.2VL氯化氢气体 |
您最近一年使用:0次
2023高三·全国·专题练习
7 . 一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应)生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
| A.该盐酸的物质的量浓度为8.0mol·L-1 |
| B.该磁黄铁矿FexS中Fe2+与Fe3+的物质的量之比为2∶1 |
| C.生成的H2S气体在标准状况下的体积为4.48L |
| D.该磁黄铁矿中FexS的x=0.85 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
8 . 1.电离度的测定有三种方法:半中和法,pH法和电导率法,其中电导率法最为精确与常用。由于电导率大小同时受三个物理量的制约,为了统一起见,引入概念“摩尔电导率”,记为∧m。其物理意义为在两个距离单位间距的极板之间填充含有1mol该物质的溶液时的电导。
∧m与k的关系是_______ (用含k的代数式表达,可引入其他物理量,例如体积V,体积的物质的量浓度c等)
∧m与k的关系是
您最近一年使用:0次
9 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.浓度均为 的 的 和 和 两种溶液中所含 两种溶液中所含 的数目之比为 的数目之比为 |
B.标准状况下, 的甲醛分子中含有的 的甲醛分子中含有的 键数目为 键数目为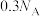 |
C.标准状况下, 氟化氢中含有的分子数目为 氟化氢中含有的分子数目为 |
D. 超重水( 超重水(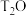 )分子中含有的中子数目为 )分子中含有的中子数目为 |
您最近一年使用:0次
2023高三·全国·专题练习
解题方法
10 . 为测定CuSO4溶液的浓度,甲、乙两同学设计了两个方案。
I.甲方案
实验原理: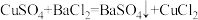
实验步骤:

Ⅱ.乙方案
实验原理: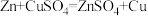 ,
,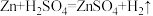

实验步骤:
①按图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E……中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
回答下列问题:
Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下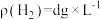 ,则c(CuSO4)
,则c(CuSO4)___________ mol‧L-1(列出计算表达式)。
I.甲方案
实验原理:
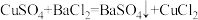
实验步骤:

Ⅱ.乙方案
实验原理:
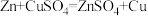 ,
,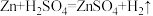

实验步骤:
①按图安装装置(夹持仪器略去)
②……
③在仪器A、B、C、D、E……中加入图示的试剂
④调整D、E中两液面相平,使D中液面保持在0或略低于0刻度位置,读数并记录。
⑤将CuSO4溶液滴入A中搅拌,反应完成后,再滴加稀硫酸至体系不再有气体产生
⑥待体系恢复到室温,移动E管,保持D、E中两液面相平,读数并记录
⑦处理数据
回答下列问题:
Zn粉质量为ag,若测得H2体积为bmL,已知实验条件下
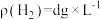 ,则c(CuSO4)
,则c(CuSO4)
您最近一年使用:0次



