2024高三下·全国·专题练习
解题方法
1 . 1,6己二酸是常用的化工原料,在高分子材料、医药、润滑剂的制造等方面都有重要作用。实验室利用图中的装置(夹持装置已省略),以环己醇和硝酸为反应物制备1,6己二酸。反应原理为:
实验步骤如下:
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:_______ 。步骤Ⅳ提纯方法的名称为_______ 。如图为1,6己二酸在水中的溶解度曲线,80℃时1,6-己二酸水溶液的密度为ρg·mL-1;该溶液的物质的量浓度为_______ 。
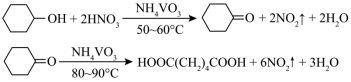
| 试剂 | 相对分子质量 | 密度/(g·mL-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.962 | 25.9 | 161.8 | 可溶于水、乙醇、乙醚 |
| 1,6-己二酸 | 146 | 1.360 | 152 | 330.5 | 微溶于冷水,易溶于乙醇 |
| NH4VO3 | 117 | 2.326 | 210(分解) | — | 微溶于冷水,易溶于热水 |
Ⅰ.向三颈烧瓶中加入0.03gNH4VO3固体和18mL浓HNO3(略过量),向恒压滴液漏斗中加入6mL环己醇
Ⅱ.将三颈烧瓶放入水浴中,电磁搅拌并加热至50℃。移去水浴,打开恒压滴液漏斗活塞滴加5~6滴环己醇,观察到三颈烧瓶中产生红棕色气体时,开始慢慢加入余下的环己醇。调节滴加环己醇的速度,使三颈烧瓶内温度维持在50~60℃之间,直至环己醇全部滴加完毕
Ⅲ.将三颈烧瓶放入80~90℃水浴中加热10min,至几乎无红棕色气体导出为止。然后迅速将三颈烧瓶中混合液倒入100mL烧杯中,冷却至室温后,有白色晶体析出,减压过滤,___________,干燥,得到粗产品
Ⅳ.1,6-己二酸粗产品的提纯
(1)将步骤Ⅲ补充完整:

| A.46.07% | B.57.08% | C.63.03% | D.74.61% |
您最近半年使用:0次
名校
解题方法
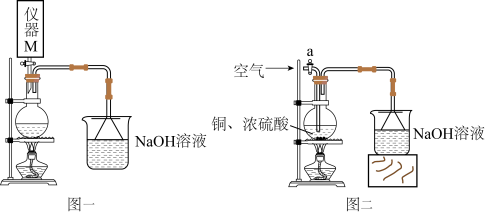
2 . 某校化学社团对铜与浓硫酸的反应进行相关研究。请回答下列问题:
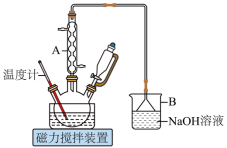
(1)研究铜和浓硫酸反应的产物,实验装置如图所示。__________ 。
②铜与浓硫酸反应的化学方程式为__________ ,反应后试管中的溶液并未呈现蓝色而是几乎无色,请解释溶液不显蓝色的原因__________ 。
③若把氯气通入试管A、B、C、D中,其实验现象与上述现象不同的是__________ (选填A、B、C、D序号,气体颜色除外)。
(2)研究铜与浓硫酸反应时硫酸的最低浓度。甲组同学设计了方案一(实验装置如图一所示),乙组同学设计了方案二(实验装置如图二所示)。 能与
能与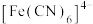 结合生成红棕色沉淀,可用于检验溶液中微量的
结合生成红棕色沉淀,可用于检验溶液中微量的 。
。
①甲组同学的方案是:在图一圆底烧瓶中放入少量的铜片和 溶液,通过仪器M缓慢、逐滴地加入
溶液,通过仪器M缓慢、逐滴地加入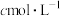 浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为
浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为__________  (
(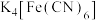 不发生副反应,假设混合溶液体积为两溶液的体积之和)。
不发生副反应,假设混合溶液体积为两溶液的体积之和)。
②乙组同学在图二的圆底烧瓶中放入足量铜粉和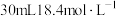 的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的
的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的 气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑
气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑 气体的逸出),再加入足量的
气体的逸出),再加入足量的 溶液,过滤、洗涤、干燥后称量沉淀的质量为
溶液,过滤、洗涤、干燥后称量沉淀的质量为 ,计算可得出该实验条件下能反应的硫酸浓度
,计算可得出该实验条件下能反应的硫酸浓度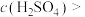
__________  (忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是
(忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是__________ (用离子方程式表示)。
(1)研究铜和浓硫酸反应的产物,实验装置如图所示。

②铜与浓硫酸反应的化学方程式为
③若把氯气通入试管A、B、C、D中,其实验现象与上述现象不同的是
(2)研究铜与浓硫酸反应时硫酸的最低浓度。甲组同学设计了方案一(实验装置如图一所示),乙组同学设计了方案二(实验装置如图二所示)。
 能与
能与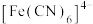 结合生成红棕色沉淀,可用于检验溶液中微量的
结合生成红棕色沉淀,可用于检验溶液中微量的 。
。①甲组同学的方案是:在图一圆底烧瓶中放入少量的铜片和
 溶液,通过仪器M缓慢、逐滴地加入
溶液,通过仪器M缓慢、逐滴地加入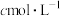 浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为
浓硫酸(记录滴加前后的读数,以确定所滴加浓硫酸的体积),至刚好出现红棕色沉淀时停止滴加浓硫酸,此时滴加浓硫酸的体积为b mL。计算反应所需硫酸的最低浓度为 (
(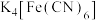 不发生副反应,假设混合溶液体积为两溶液的体积之和)。
不发生副反应,假设混合溶液体积为两溶液的体积之和)。②乙组同学在图二的圆底烧瓶中放入足量铜粉和
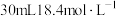 的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的
的浓硫酸,待反应结束,撤去酒精灯。打开a处的活塞,通入足量的空气,以确保生成的 气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑
气体全部进入烧杯中完全被吸收。将烧杯取下,向其中加入足量盐酸酸化的双氧水(不考虑 气体的逸出),再加入足量的
气体的逸出),再加入足量的 溶液,过滤、洗涤、干燥后称量沉淀的质量为
溶液,过滤、洗涤、干燥后称量沉淀的质量为 ,计算可得出该实验条件下能反应的硫酸浓度
,计算可得出该实验条件下能反应的硫酸浓度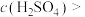
 (忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是
(忽略反应中溶液的体积变化,保留1位小数),加入盐酸酸化的双氧水的目的是
您最近半年使用:0次
2024-05-03更新
|
80次组卷
|
3卷引用:河南省南阳市社旗县第一高级中学2023-2024学年高一下学期4月期中考试化学试题
3 .  为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是
 为阿伏加德罗常数的值。下列叙述正确的是
为阿伏加德罗常数的值。下列叙述正确的是A.100g46%的乙醇溶液中含有O-H键的数目为 |
B.标准状况下,11.2LHF中电子的数目为 |
C.pH=1的 溶液中 溶液中 的数目为 的数目为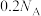 |
D.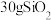 中含有的Si-O键数目为 中含有的Si-O键数目为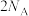 |
您最近半年使用:0次
名校
4 . 标况下,将某气体X充满一个干燥烧瓶,将烧瓶倒立于水槽中,瓶内液面上升(假设烧瓶内液体未扩散水槽)最后烧瓶中溶质的物质的量浓度最小的是
| A.X为NH3 | B.X为NO2 |
| C.X为NO2和O2(体积比为4:1) | D.X为NO和O2(体积比为4:3) |
您最近半年使用:0次
2024-04-15更新
|
84次组卷
|
2卷引用:福建省福州市闽侯县第一中学2023-2024学年高一下学期3月月考化学试题
23-24高一上·江苏苏州·阶段练习
名校
5 . 下列溶液中物质的量浓度为 的是
的是
(1)将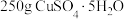 溶解在
溶解在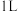 水中
水中
(2)将 气体溶于水配成
气体溶于水配成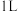 溶液
溶液
(3)将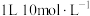 浓盐酸加入到
浓盐酸加入到 水中
水中
(4)将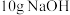 溶解在少量水中,再加蒸馏水直到溶液体积为
溶解在少量水中,再加蒸馏水直到溶液体积为
(5)将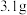 氧化钠溶于水并配成
氧化钠溶于水并配成 溶液
溶液
(6)将 质量分数为98%硫酸与
质量分数为98%硫酸与 水混合
水混合
 的是
的是(1)将
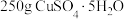 溶解在
溶解在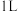 水中
水中(2)将
 气体溶于水配成
气体溶于水配成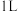 溶液
溶液(3)将
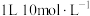 浓盐酸加入到
浓盐酸加入到 水中
水中(4)将
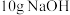 溶解在少量水中,再加蒸馏水直到溶液体积为
溶解在少量水中,再加蒸馏水直到溶液体积为
(5)将
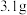 氧化钠溶于水并配成
氧化钠溶于水并配成 溶液
溶液(6)将
 质量分数为98%硫酸与
质量分数为98%硫酸与 水混合
水混合| A.(2)(4) | B.(1)(2)(4) | C.(4)(5) | D.(2)(4)(6) |
您最近半年使用:0次
23-24高一上·广东深圳·期中
名校
解题方法
6 . 在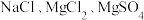 和
和 的混合溶液当中,已知
的混合溶液当中,已知 、
、 ,则
,则 的值
的值
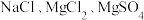 和
和 的混合溶液当中,已知
的混合溶液当中,已知 、
、 ,则
,则 的值
的值A.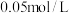 | B.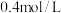 | C. | D. |
您最近半年使用:0次
23-24高一上·江苏南通·期中
7 . 对于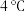 时
时 水中溶解了
水中溶解了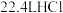 气体(标况下)后形成的溶液,下列说法中正确的是
气体(标况下)后形成的溶液,下列说法中正确的是
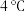 时
时 水中溶解了
水中溶解了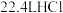 气体(标况下)后形成的溶液,下列说法中正确的是
气体(标况下)后形成的溶液,下列说法中正确的是A.所得溶液的体积为 |
B.所得溶液中溶质的物质的量浓度为 |
| C.根据题给数据,所得溶液中溶质的物质的量浓度可以求得 |
| D.根据题给数据,所得溶液中溶质的质量分数可以求得 |
您最近半年使用:0次
23-24高一上·浙江温州·期中
解题方法
8 . 取5.48g Na2CO3和NaHCO3的固体混合物,分成两等份。
(1)将其中一份固体混合物加水溶解配成100mL溶液。当向溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100 mol∙L-1 (混合溶液体积改变忽略不计)。则原混合物中n(Na2CO3):n(NaHCO3)=___________ 。
(2)将另一份固体混合物充分加热。写出加热时发生反应的化学方程式___________ 。充分加热后的固体溶于水配成100mL溶液,则c(Na+)=___________ mol∙L-1。
(1)将其中一份固体混合物加水溶解配成100mL溶液。当向溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100 mol∙L-1 (混合溶液体积改变忽略不计)。则原混合物中n(Na2CO3):n(NaHCO3)=
(2)将另一份固体混合物充分加热。写出加热时发生反应的化学方程式
您最近半年使用:0次
名校
9 . 利用所学知识进行填空(用NA表示阿伏加德罗常数的值)。
(1)0.4mol氨气中含有NH3分子数是___________ ,其质量是___________ g。
(2)标准状况下,44.8LCH4对应的物质的量是___________ ,其电子数为___________ 。
(3)现有物质:①NaOH溶液;②铜;③熔融KHSO4;④BaCO3固体;⑤液态HCl;⑥CO2,以上物质中属于混合物的是___________  填序号
填序号 ,以上物质中属于电解质的
,以上物质中属于电解质的___________  填序号
填序号 ;以上物质中能导电的是
;以上物质中能导电的是___________  填序号
填序号 。
。
(4)现有CO与O2两种气态物质,试回答下列问题:
①同温同压下,CO与O2的密度之比为___________ 。
②相同温度和压强下,等质量的CO和O2.二者体积比为___________ 。
(5)将4gNaOH溶于水配成1L溶液,然后取出10mL,这10mL溶液的物质的量浓度为___________ 。
(6)18.6gNa2X含有0.6molNa+,则Na2X的物质的量是___________ ,Na2X的摩尔质量是___________ 。
(7)已知O2和CO2的混合气体,在标准状况下体积为11.2L,质量为18g,则混合气体的平均相对分子质量是___________ ,混合气体中O2和CO2物质的量之比为___________ 。
(1)0.4mol氨气中含有NH3分子数是
(2)标准状况下,44.8LCH4对应的物质的量是
(3)现有物质:①NaOH溶液;②铜;③熔融KHSO4;④BaCO3固体;⑤液态HCl;⑥CO2,以上物质中属于混合物的是
 填序号
填序号 ,以上物质中属于电解质的
,以上物质中属于电解质的 填序号
填序号 ;以上物质中能导电的是
;以上物质中能导电的是 填序号
填序号 。
。(4)现有CO与O2两种气态物质,试回答下列问题:
①同温同压下,CO与O2的密度之比为
②相同温度和压强下,等质量的CO和O2.二者体积比为
(5)将4gNaOH溶于水配成1L溶液,然后取出10mL,这10mL溶液的物质的量浓度为
(6)18.6gNa2X含有0.6molNa+,则Na2X的物质的量是
(7)已知O2和CO2的混合气体,在标准状况下体积为11.2L,质量为18g,则混合气体的平均相对分子质量是
您最近半年使用:0次
名校
10 . 下列溶液中,氯离子浓度最大的是
| A.10mL1mol·L-1的AlCl3溶液 | B.150mL1mol·L-1的MgCl2溶液 |
| C.200mL1.5mol·L-1的HCl溶液 | D.100mL2mol·L-1的NaCl溶液 |
您最近半年使用:0次
2023-12-02更新
|
97次组卷
|
13卷引用:山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题
山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题贵州省息烽县一中2018-2019学年高一上学期11月考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高一(文)上学期期末考试化学试题广东省惠州市2019-2020学年高一上学期期末质量检测化学试题山西省运城市教育发展联盟2021-2022学年高一上学期12月月考化学试题(已下线)第12讲 物质的量浓度-【暑假自学课】2023年新高一暑假精品课(苏教版2019)四川省阆中东风中学校2023-2024学年高一上学期第一次段考化学试题陕西省西安市高陵区第三中学2023-2024学年高一上学期期末化学试卷(已下线)江苏省2011届高三化学一轮过关测试(8)(已下线)2011-2012学年福建省晋江市季延中学高一上学期期中考试化学试卷山东省曲阜市第一中学2017-2018学年高一上学期第一次月考化学试题云南省普洱市景东县第二中学2019—2020学年高一上学期期末考试化学试题甘肃省白银市靖远县第四中学2023-2024学年高一下学期开学化学试题



