1 . 在标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为
A. mol/L mol/L | B. mol/L mol/L |
C.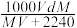 mol/L mol/L | D. mol/L mol/L |
您最近一年使用:0次
2024-01-19更新
|
97次组卷
|
2卷引用:湖北省沙市中学2023-2024学年高一上学期11月月考化学试题
2 . 常温下,1mol/L的 溶液的密度为
溶液的密度为 。下列配制常温下1mol/L的
。下列配制常温下1mol/L的 溶液的方法中正确的是
溶液的方法中正确的是
 溶液的密度为
溶液的密度为 。下列配制常温下1mol/L的
。下列配制常温下1mol/L的 溶液的方法中正确的是
溶液的方法中正确的是A.称取16.0g无水 放入200mL的烧杯中,准确量取98.0mL蒸馏水加入烧杯中,搅拌均匀 放入200mL的烧杯中,准确量取98.0mL蒸馏水加入烧杯中,搅拌均匀 |
B.称取16.0g无水 固体,转移至100mL容量瓶中,加入蒸馏水使固体溶解,再加蒸馏水至100mL刻度处 固体,转移至100mL容量瓶中,加入蒸馏水使固体溶解,再加蒸馏水至100mL刻度处 |
C.称取 晶体,用0.5mol/L的 晶体,用0.5mol/L的 溶液代替水,在100mL容量瓶中定容至刻度线(其它实验仪器选择和操作均正确) 溶液代替水,在100mL容量瓶中定容至刻度线(其它实验仪器选择和操作均正确) |
D.取20.0mL5mol/L的 溶液放入200mL的烧杯中,准确量取80.0mL蒸馏水加入烧杯中,搅拌均匀 溶液放入200mL的烧杯中,准确量取80.0mL蒸馏水加入烧杯中,搅拌均匀 |
您最近一年使用:0次
名校
3 . 化学与人类生活密切相关。请按要求,回答下列问题:
(1)日常使用的金属材料,大多数属于合金。合金有许多优良的物理、化学或机械性能。生活中比较常见的合金有___________ (填写一类即可,下同)。近年来,为满足某些尖端技术发展的需要,人们有设计和合成了许多新型合金,例如:___________ 。
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式: )的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
)的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:

①葡萄糖的摩尔质量为___________ 。
②该注射液中葡萄糖的物质的量浓度为___________ (保留两位小数)
(3)某饮用矿泉水中,测得含有 、
、 、
、 、
、 和
和 五种主要离子(不考虑溶液中少量的
五种主要离子(不考虑溶液中少量的 和
和 或其他离子),其中
或其他离子),其中 :
: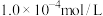 ,
, :
: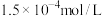 ,
, :
: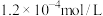 ,
, :
: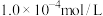 ,则溶液中
,则溶液中 的物质的量浓度是
的物质的量浓度是______  。
。
(4)水是万物之源,为探究高铁酸钾(化学式为: )在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
)在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:___________ 。
(1)日常使用的金属材料,大多数属于合金。合金有许多优良的物理、化学或机械性能。生活中比较常见的合金有
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式:
 )的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
)的水溶液,某同学获知其标签上的部分内容如图所示。利用标签所提供的信息,回答下列问题:
①葡萄糖的摩尔质量为
②该注射液中葡萄糖的物质的量浓度为
(3)某饮用矿泉水中,测得含有
 、
、 、
、 、
、 和
和 五种主要离子(不考虑溶液中少量的
五种主要离子(不考虑溶液中少量的 和
和 或其他离子),其中
或其他离子),其中 :
: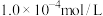 ,
, :
: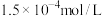 ,
, :
: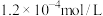 ,
, :
: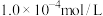 ,则溶液中
,则溶液中 的物质的量浓度是
的物质的量浓度是 。
。(4)水是万物之源,为探究高铁酸钾(化学式为:
 )在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
)在水质处理中发挥的作用,现查阅资料可知:干燥的高铁酸钾在常温下可以长期稳定存在,但溶于水中极易分解得到氧气和氢氧化铁胶体,写出该反应的化学方程式:
您最近一年使用:0次
2023-12-21更新
|
91次组卷
|
2卷引用:湖北省云学联盟2023-2024学年高一上学期12月月考化学试题
解题方法
4 . 有一瓶 无色透明溶液,只含等物质的量的
无色透明溶液,只含等物质的量的 中的某几种,分别取两份
中的某几种,分别取两份 该溶液于试管Ⅰ、Ⅱ中,做如下实验:
该溶液于试管Ⅰ、Ⅱ中,做如下实验:
①实验一:试管Ⅰ中,加入少量锌粒,有气泡产生;
②实验二:试管Ⅱ中,加入足量的 ,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体
,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体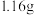 。
。
回答下列问题:
(1)仅通过观察就可以判断不存在的离子是_______ (用离子符号表示)。
(2)由实验一可知溶液中一定不含有的离子是_______ (用离子符号表示)。
(3)试管Ⅱ中生成白色沉淀的离子方程式为_______ 。
(4)根据上述实验,可以确定一定_______ (填“含有”或“不含”) ,理由是
,理由是_______ 。
(5)原溶液中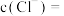
_______  。
。
 无色透明溶液,只含等物质的量的
无色透明溶液,只含等物质的量的 中的某几种,分别取两份
中的某几种,分别取两份 该溶液于试管Ⅰ、Ⅱ中,做如下实验:
该溶液于试管Ⅰ、Ⅱ中,做如下实验:①实验一:试管Ⅰ中,加入少量锌粒,有气泡产生;
②实验二:试管Ⅱ中,加入足量的
 ,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体
,产生白色沉淀,经过滤、洗涤、低温干燥,称量得固体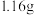 。
。回答下列问题:
(1)仅通过观察就可以判断不存在的离子是
(2)由实验一可知溶液中一定不含有的离子是
(3)试管Ⅱ中生成白色沉淀的离子方程式为
(4)根据上述实验,可以确定一定
 ,理由是
,理由是(5)原溶液中
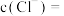
 。
。
您最近一年使用:0次
2023-11-30更新
|
77次组卷
|
2卷引用:湖北省咸丰春晖学校2023-2024学年高一上学期12月月考化学试题
5 . 设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1 mol NH 中氮的价层电子对数为0.4NA 中氮的价层电子对数为0.4NA |
| B.0.1mol/LHClO4溶液中H+的数目为0.1NA |
| C.标准状况下,2.24L氯仿中分子数为0.1NA |
| D.常温下,5.6gFe与足量浓硝酸反应转移的电子数为0.3NA |
您最近一年使用:0次
10-11高三上·新疆阿勒泰·阶段练习
名校
6 . 0.5 L 1 mol·L-1FeCl3溶液与0.2 L 1 mol·L-1 KCl溶液中的Cl-的物质的量浓度之比是
| A.5∶2 | B.15∶2 |
| C.3∶1 | D.1∶3 |
您最近一年使用:0次
2023-08-26更新
|
254次组卷
|
89卷引用:2016-2017学年湖北宜昌金东方中学、三峡高中高一11月月考化学卷
2016-2017学年湖北宜昌金东方中学、三峡高中高一11月月考化学卷湖北省黄冈市黄梅国际育才高级中学2019-2020学年高一上学期10月月考化学试题(已下线)2010年新疆哈巴河县高级中学高三上学期第一次月考化学试题(已下线)2010年吉林省东北师大附中高一上学期第一次月考化学试题(已下线)2010-2011学年河北省南宫中学高一9月份月考化学试卷(已下线)2011-2012学年内蒙古巴市一中高一上学期10月月考化学试卷(已下线)2011-2012学年陕西省富县高级中学高一上学期第二次周检测化学试卷(已下线)2011-2012学年河北省保定三中高二10月月考文科化学试卷(已下线)2010-2011学年云南省曲靖市茚旺高中高一10月月考化学试卷(已下线)2012-2013学年内蒙古巴彦淖尔市一中高一9月月考化学试卷(已下线)2012-2013学年江苏省南京学大教育专修学校高一9月月测化学试卷(已下线)2012-2013学年甘肃省天水市一中高一第一次月考化学试卷(已下线)2012-2013学年辽宁省盘锦二中高一第一次阶段考试化学试卷(已下线)2012-2013学年山西省大同市实验中学高一第一次月考化学试卷(已下线)2012-2013学年山东省冠县武训高中高一10月月考化学试卷(已下线)2012-2013学年吉林长春实验中学高一上学期第一次月考化学试卷(已下线)2014-2015学年甘肃省高台县第一中学高一9月月考化学试卷(已下线)2014-2015学年黑龙江省哈尔滨市第六中学高一10月月考化学试卷(已下线)2014-2015学年度河南省许昌市五校高一上期第一次联考化学试卷(已下线)2014-2015学年甘肃甘谷县第一中学高一上学期第一次月考化学试卷(已下线)2014-2015学年宁夏育才中学高一上学期第一次月考化学试卷(已下线)2014-2015学年甘肃省民乐县第一中学高一上学期第一次月考化学试卷2016届江西省金溪县第一中学高三上学期第一次月考化学试卷2015-2016学年河北省邢台一中高一上第一次月考化学试卷2015-2016学年宁夏银川唐徕回民中学高一上10月化学卷2016-2017学年江西省吉安一中高一上第一次段考化学卷2016-2017学年浙江省温州中学高一上10月月考化学试卷2016-2017学年辽宁省庄河中学高一上10月月考化学卷2016-2017学年青海省湟中县第一中学高一上月考一化学试卷福建省闽侯县第八中学2017-2018学年高一上学期第一次月考化学试题黑龙江省饶河县高级中学2017-2018学年高一上学期第一次月考化学试题黑龙江省哈尔滨市第三中学2017-2018学年高一上学期第一次验收考试化学试题江西省奉新县第一中学2017-2018学年高一上学期第一次月考化学试题江西省樟树中学2017-2018学年高一上学期第一次月考化学试题河南省鹤壁市淇滨高级中学2017-2018学年高一上学期第二次月考化学试题福建省华安县第一中学2017-2018学年高一年上学期第二次月考(12月)化学试题河北省高阳中学2017-2018学年高一1月月考化学试题安徽省定远重点中学2018-2019学年高一上学期第三次月考化学试题江苏省沭阳县修远中学2019-2020学年高一上学期第一次月考化学试题山西省运城市永济涑北中学2019-2020学年高一上学期9月月考化学试卷贵州省遵义航天高级中学2019-2020学年高一上学期第一次月考化学试题宁夏青铜峡市高级中学(吴忠中学分校)2019-2020学年高一上学期第一次月考化学试题湖南省株洲市茶陵县第三中学2019-2020学年高一上学期第一次月考化学试题广西南宁市第三中学2019-2020学年高一10月月考化学试题山东省烟台市第二中学2019-2020学年高一10月月考化学试题吉林省延边第二中学2019-2020学年高二上学期第一次月考化学试题新疆维吾尔自治区喀什第二中学2019-2020学年高一9月月考化学试题四川省攀枝花市第十五中学2019-2020学年高一上学期第一次月考化学试题四川省巴中市平昌县驷马中学 2020-2021学年高一上学期九月月考化学试题四川省/成都新津为明学校2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】在线化学17四川省内江市第六中学2020-2021学年高一上学期元月月考化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00137】四川省峨眉第二中学校2021-2022学年高一上学期10月月考化学试题四川省成都第三十七中学校2021-2022学年高一上学期第一次月考化学试题青海省海南州中学2021-2022学年高一上学期第一次月考化学试题四川省什邡中学2021-2022学年高一上学期第一次月考化学试题河南省新蔡县四校联考2021-2022学年高三上学期调研考试化学试题河南省信阳市息县第一高级中学2023-2024学年高一上学期第二次阶段性考试化学试卷(已下线)2011-2012学年浙江省杭州市高一上学期期中七校联考化学试卷(已下线)2011-2012学年浙江省杭州市萧山八中高一上学期期中联考化学试卷(已下线)2011-2012学年山西省忻州一中高一上学期期中考试化学试卷(已下线)2011-2012学年山西省临汾一中高一上学期期中考试化学试卷(已下线)2011-2012学年安徽省桐城十中高一上学期期中考试化学试卷(已下线)2011-2012学年云南省开远四中高一上学期期中考试化学试卷(已下线)2012-2013学年重庆市49中七校联盟高一上学期期中考试化学试卷(已下线)2012-2013学年甘肃永昌一中高二上学期期中考试文科化学试卷2014-2015湖南省边城高级中学高一上学期期中考试化学试卷2015-2016学年黑龙江省牡丹江中学高一上期末化学试卷2016-2017学年云南省昆明三中高一上期中化学试卷2016-2017学年辽宁省大连市高一上学期期末考试化学试卷吉林省长春外国语学校2017-2018学年高一上学期期中考试化学试题河南省周口中英文学校2017-2018学年高一上学期期中考试化学试题黑龙江省七台河中学2017-2018学年高一上学期期末化学试题吉林省延边州敦化县2017-2018学年高一上学期期末考试化学试题辽宁省普兰店市第一中学2018-2019学年高二(文)上学期期中考试化学试题甘肃省镇原县二中2018-2019学年高一上学期期中考试化学试题【全国百强校】四川省棠湖中学2018-2019学年高一上学期期末考试化学试题河南省周口中英文学校2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】2019新中心五地091高中化学广西壮族自治区南宁市第三十六中学2019-2020学年高一上学期期中考试化学试题浙江省杭州市学军中学2020-2021学年高一上学期期中测试化学试题北京市第一五六中学2020—2021学年高一上学期期中测试化学试题(已下线)【浙江新东方】【2020】【高一上】【期中】【HD-LP426】【化学】陕西省宝鸡市虢镇中学2020-2021学年度高一上学期期中考试化学试题河南省汤阴县五一中学2019-2020学年高一下学期期中考试化学试题甘肃省永昌县第一高级中学2021-2022学年高二上学期期中考试化学(文)试题浙江省宁波市效实中学2022-2023学年高一上学期期中考试化学试题作业(六) 物质的量浓度
7 . 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
(1)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
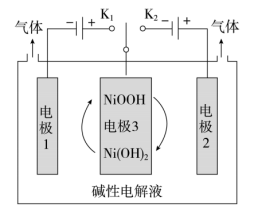
①制H2时,连接_______ 。产生H2的电极反应式是_______ 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:_______ 。
(2)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)
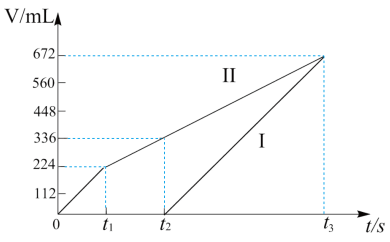
①原混合溶液中NaCl和CuSO4的物质的量浓度_______ 。
②电解至t3时,消耗水的质量_______ 。
(1)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。

①制H2时,连接
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用:
(2)常温下电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤)

①原混合溶液中NaCl和CuSO4的物质的量浓度
②电解至t3时,消耗水的质量
您最近一年使用:0次
8 . 用 NA 表示阿伏加德罗常数的数值。下列说法中正确的
| A.11.7g氯化钠晶体溶于水中 Na+ 的数目为 0.2 NA |
| B.9.6g硫酸中含有的氧原子数为 0.2 NA |
| C.标况下,1.12L水中含有的原子数为 0.15 NA |
| D.0.1mol•L-1的MgCl2溶液中,所含 Cl-的数目为 0.2 NA |
您最近一年使用:0次
名校
9 . 下列说法正确的是
| A.标准状况下,将22.4L的HCl溶于1L水,可配成1mol/L的稀盐酸 |
| B.把200mL3mol/L的MgCl2溶液跟100mL3mol/L的KCl溶液混合后,溶液中的Cl-的物质的量浓度仍然是3mol/L |
| C.常温下,10mL5.6mol/L的FeCl3溶液滴到100 mL 沸水中,生成胶粒数为0.056NA |
D.用等体积等物质的量浓度的BaCl2溶液可使用相同体积的Fe2(SO4)3、FeSO4、K2SO4三种溶液中的SO 离子恰好完全转化为沉淀,则三种溶液的物质的量浓度之比为1:3:3 离子恰好完全转化为沉淀,则三种溶液的物质的量浓度之比为1:3:3 |
您最近一年使用:0次
名校
10 . 质量、物质的量、物质的量浓度、气体体积等是用于化学计算的常见物理量。
(1)质量之比为16:7:6的三种气体 、
、 、
、 。分子个数之比为
。分子个数之比为___________ ;氧原子个数之比为___________ ;相同条件下的体积之比为___________ 。
(2)在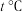 时将ag
时将ag ,完全溶于水得到VmL溶液,该溶液的密度为
,完全溶于水得到VmL溶液,该溶液的密度为 (
(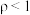 );质量分数为w,物质的量浓度为
);质量分数为w,物质的量浓度为 。下列计算结果正确的是___________。
。下列计算结果正确的是___________。
(3)将aL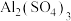 和
和 的混合溶液分成两等份,一份加入bmol
的混合溶液分成两等份,一份加入bmol 溶液使溶液中的
溶液使溶液中的 刚好完全沉淀,另一份加入足量
刚好完全沉淀,另一份加入足量 溶液并加热可得到cmol
溶液并加热可得到cmol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为___________ 。
(4)ag镁铝合金投入xmL2 mol∙L−1的盐酸中,一段时间后金属完全溶解,再加入ymL l mol∙L−1的 溶液,沉淀达到最大值,其质量为
溶液,沉淀达到最大值,其质量为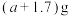 ,产生的
,产生的 在标准状况下体积为
在标准状况下体积为___________ L。
(5)汽车剧烈碰撞时,安全气囊中发生反应: 。该反应中氧化产物与还原产物的质量比为
。该反应中氧化产物与还原产物的质量比为___________ ;若氧化产物比还原产物多19.6g,则反应生成的 在标准状况下的体积为
在标准状况下的体积为___________ L。
(1)质量之比为16:7:6的三种气体
 、
、 、
、 。分子个数之比为
。分子个数之比为(2)在
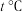 时将ag
时将ag ,完全溶于水得到VmL溶液,该溶液的密度为
,完全溶于水得到VmL溶液,该溶液的密度为 (
(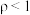 );质量分数为w,物质的量浓度为
);质量分数为w,物质的量浓度为 。下列计算结果正确的是___________。
。下列计算结果正确的是___________。A.溶质的质量分数 |
B.溶质的物质的量浓度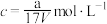 |
C.溶液密度 可表示为 可表示为 |
| D.上述溶液中再加入VmL水,所得溶液溶质的质量分数小于0.5w |
(3)将aL
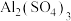 和
和 的混合溶液分成两等份,一份加入bmol
的混合溶液分成两等份,一份加入bmol 溶液使溶液中的
溶液使溶液中的 刚好完全沉淀,另一份加入足量
刚好完全沉淀,另一份加入足量 溶液并加热可得到cmol
溶液并加热可得到cmol ,则原溶液中
,则原溶液中 的物质的量浓度为
的物质的量浓度为(4)ag镁铝合金投入xmL2 mol∙L−1的盐酸中,一段时间后金属完全溶解,再加入ymL l mol∙L−1的
 溶液,沉淀达到最大值,其质量为
溶液,沉淀达到最大值,其质量为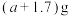 ,产生的
,产生的 在标准状况下体积为
在标准状况下体积为(5)汽车剧烈碰撞时,安全气囊中发生反应:
 。该反应中氧化产物与还原产物的质量比为
。该反应中氧化产物与还原产物的质量比为 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次



