名校
解题方法
1 . 某实验小姐同学为了测定工业纯碱的纯度,进行了一系列实验。
(1)工业纯碱中常含有少量 杂质,检验是否含有氯化钠杂质的方法为
杂质,检验是否含有氯化钠杂质的方法为___________ 。
(2)使用滴定法测定炖碱的纯度,称量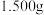 工业纯碱样品,溶解,用
工业纯碱样品,溶解,用 盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液
盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液 变化和生成
变化和生成 的量如图所示
的量如图所示 点前溶液中发生的反应
点前溶液中发生的反应___________ ,计算该工业纯碱样品的质量分数___________ 。(计算结果保留两位小数)
(1)工业纯碱中常含有少量
 杂质,检验是否含有氯化钠杂质的方法为
杂质,检验是否含有氯化钠杂质的方法为(2)使用滴定法测定炖碱的纯度,称量
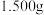 工业纯碱样品,溶解,用
工业纯碱样品,溶解,用 盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液
盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液 变化和生成
变化和生成 的量如图所示
的量如图所示 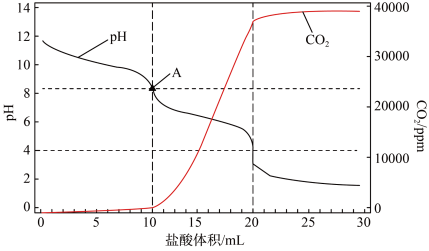
 点前溶液中发生的反应
点前溶液中发生的反应
您最近一年使用:0次
名校
2 . 将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为___________ L, 的体积为
的体积为___________ L。
(2)参加反应的硝酸的物质的量是___________ mol。
(3)待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________ mol/L。(结果不需化简)
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为 ,至少需要30%的双氧水
,至少需要30%的双氧水_________ g。
 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:(1)NO的体积为
 的体积为
的体积为(2)参加反应的硝酸的物质的量是
(3)待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的
 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为
 ,至少需要30%的双氧水
,至少需要30%的双氧水
您最近一年使用:0次
名校
解题方法
3 . 根据要求进行计算:
(1)amolHClO4中含b个氧原子,则阿伏加德罗常数NA=_______ mol-1(用含a、b的代数式表示)。
(2)某含氯化合物X在标准状况下为气体,7.3gX在标准状况下的体积为4.48L,则X的摩尔质量是_______ 。
(3)1774年瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合制氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。
MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。
①生成的氯气在标准状况下的体积是_______ 。
②稀释后溶液中MnCl2的物质的量浓度是_______ 。
(1)amolHClO4中含b个氧原子,则阿伏加德罗常数NA=
(2)某含氯化合物X在标准状况下为气体,7.3gX在标准状况下的体积为4.48L,则X的摩尔质量是
(3)1774年瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合制氯气:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。
MnCl2+Cl2↑+2H2O。现将92.8g含MnO2的质量分数为75%的软锰矿与足量10mol·L-1的浓盐酸完全反应(杂质不参加反应)。把反应后的溶液稀释成400mL(已知Mn的相对原子质量为55)。①生成的氯气在标准状况下的体积是
②稀释后溶液中MnCl2的物质的量浓度是
您最近一年使用:0次
名校
解题方法
4 . 已知:①H2O ②Cu ③NO ④SiO2 ⑤稀硫酸 ⑥氢氧化钡 ⑦饱和FeCl3溶液 ⑧氨水 ⑨稀硝酸 ⑩硫酸铝。
根据上述提供的物质,回答下列问题:
(1)属于纯净物的是___________ ,属于电解质的是___________ 。(填数字序号)
(2)发生中和反应的离子方程式为H++OH-=H2O,该离子反应对应的化学方程式有___________ 。
(3)实验室制备少量Fe(OH)3胶体发生反应的离子方程式为___________ 。
(4)实验室配制0.5 mol·L-1 245 mL ⑩的溶液,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管、___________ ,需要用托盘天平称取溶质的质量为___________ g,从配制好的溶液中取出100 mL,其中含有的SO 数目为
数目为___________ (设NA为阿伏加德罗常数的值)。
根据上述提供的物质,回答下列问题:
(1)属于纯净物的是
(2)发生中和反应的离子方程式为H++OH-=H2O,该离子反应对应的化学方程式有
(3)实验室制备少量Fe(OH)3胶体发生反应的离子方程式为
(4)实验室配制0.5 mol·L-1 245 mL ⑩的溶液,需要用到的玻璃仪器有玻璃棒、烧杯、胶头滴管、
 数目为
数目为
您最近一年使用:0次
解题方法
5 . 阅读下列材料,回答有关问题。
(1)汽车尾气中含有NO、CO等多种污染物,已成为城市空气的主要污染源。汽油和柴油中基本不含氮元素,汽车尾气中生成NO的化学方程式为_______ ;若在汽车的排气管上安装一个三元催化器,它能使CO与NO均转化为无毒气体,该反应的化学方程式为______________ 。
(2)工业上常采用石灰石对燃煤进行脱硫处理,其主要原理为 吸收
吸收 ,同时与空气作用生成石膏(
,同时与空气作用生成石膏( ),此过程中总反应的化学方程式为
),此过程中总反应的化学方程式为______________ 。
(3)工业生产中为了盛装大量浓硝酸,下列材料可选作罐体材料的是______(填序号)。
(4)通常市售浓硝酸的质量分数为63%,密度为1.42 ,则
,则
______________  。
。
(1)汽车尾气中含有NO、CO等多种污染物,已成为城市空气的主要污染源。汽油和柴油中基本不含氮元素,汽车尾气中生成NO的化学方程式为
(2)工业上常采用石灰石对燃煤进行脱硫处理,其主要原理为
 吸收
吸收 ,同时与空气作用生成石膏(
,同时与空气作用生成石膏( ),此过程中总反应的化学方程式为
),此过程中总反应的化学方程式为(3)工业生产中为了盛装大量浓硝酸,下列材料可选作罐体材料的是______(填序号)。
| A.镁 | B.铜 | C.铂 | D.铝 |
 ,则
,则
 。
。
您最近一年使用:0次
名校
解题方法
6 . 盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室必备的重要试剂
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有___________ 性;硝酸应保存在棕色瓶中,这是因为硝酸具有___________ 性。
(2)如图是硫酸试剂瓶标签上的部分内容,该硫酸的浓度是___________ ;实验人员操作时不必需穿戴的安全用具是___________ 。
A.防护手套 B.实验服 C.防毒面具 D.护目镜
(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式_________________ 。
(4)实验室中向烧杯内加入约20g蔗糖,向其中插入玻璃棒,滴加几滴蒸馏水,再加入适量浓硫酸。白色的蔗糖变为疏松多孔的黑色物质,放出大量的热使烧杯壁发烫。验证产生的气体有SO2的方法是___________________ ,验证该气体中还含有CO2的方法是_______________________ 。
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有
(2)如图是硫酸试剂瓶标签上的部分内容,该硫酸的浓度是
| 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数: 98.9% |
(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式
(4)实验室中向烧杯内加入约20g蔗糖,向其中插入玻璃棒,滴加几滴蒸馏水,再加入适量浓硫酸。白色的蔗糖变为疏松多孔的黑色物质,放出大量的热使烧杯壁发烫。验证产生的气体有SO2的方法是
您最近一年使用:0次
2023-04-23更新
|
73次组卷
|
2卷引用:广东省惠州市惠阳区部分学校2022-2023学年高一下学期期中联考化学试题
名校
7 . 硫的多种化合物在工业中有重要的应用。
(1)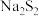 可以做制革工业中原皮的脱毛剂,写出
可以做制革工业中原皮的脱毛剂,写出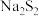 的电子式
的电子式___________ 。
(2)连二亚硫酸钠 又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
① 中S元素的化合价为
中S元素的化合价为___________ 。
②将甲酸(HCOOH)和NaOH溶液混合,再通入 气体,会得到保险粉,此时甲酸被氧化为
气体,会得到保险粉,此时甲酸被氧化为 。该反应的化学方程式为
。该反应的化学方程式为___________ 。
(3)铬会造成环境污染,某酸性废水中含有 ,处理时用焦亚硫酸钠
,处理时用焦亚硫酸钠 将
将 转化为毒性较低的
转化为毒性较低的 ,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中
,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中 浓度为
浓度为 ,达到排放标准。
,达到排放标准。
①写出 参加反应的离子方程式
参加反应的离子方程式___________ 。
②处理后的废水中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)
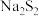 可以做制革工业中原皮的脱毛剂,写出
可以做制革工业中原皮的脱毛剂,写出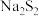 的电子式
的电子式(2)连二亚硫酸钠
 又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。①
 中S元素的化合价为
中S元素的化合价为②将甲酸(HCOOH)和NaOH溶液混合,再通入
 气体,会得到保险粉,此时甲酸被氧化为
气体,会得到保险粉,此时甲酸被氧化为 。该反应的化学方程式为
。该反应的化学方程式为(3)铬会造成环境污染,某酸性废水中含有
 ,处理时用焦亚硫酸钠
,处理时用焦亚硫酸钠 将
将 转化为毒性较低的
转化为毒性较低的 ,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中
,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中 浓度为
浓度为 ,达到排放标准。
,达到排放标准。①写出
 参加反应的离子方程式
参加反应的离子方程式②处理后的废水中
 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
名校
8 . 将3.36L NO2(折算为标况)溶于水得到200mL稀硝酸(密度为1.04g·cm-3)。此稀硝酸的物质的量浓度为___________ 。用浓盐酸配制稀盐酸时,下列操作会导致所配盐酸溶液的物质的量浓度偏大的是___________ 。
A. 转移后未洗涤烧杯和玻璃棒
B. 容量瓶使用前有少量水残留
C. 定容时俯视读数
D. 未冷却就立即转移到容量瓶中定容
E. 用量筒取浓盐酸时仰视读数
A. 转移后未洗涤烧杯和玻璃棒
B. 容量瓶使用前有少量水残留
C. 定容时俯视读数
D. 未冷却就立即转移到容量瓶中定容
E. 用量筒取浓盐酸时仰视读数
您最近一年使用:0次
名校
解题方法
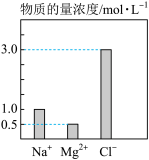
9 . 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有 、
、 、
、 、
、 、
、 。为了进一步确认,对该溶液进行实验检测:
。为了进一步确认,对该溶液进行实验检测:
步骤一:仔细观察,该溶液呈无色、透明、均一状态:
步骤二:加入足量 溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。
溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。
(1)原溶液中除图中的离子外,肯定还含有的离子是_______ ,肯定不含有的离子是_______ 。
(2)步骤二中称量沉淀前的实验操作步骤有:过滤、洗涤、干燥。检验沉淀已洗干净的方法是_______ 。
(3)原溶液中 物质的量浓度为
物质的量浓度为_______ mol/L。
(4)向原溶液中加入 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。
(5)若向100mL原溶液中加入1mol/L的 溶液,当生成的沉淀质量刚好最大时,加入的
溶液,当生成的沉淀质量刚好最大时,加入的 溶液体积为
溶液体积为_______ L。
 、
、 、
、 、
、 、
、 。为了进一步确认,对该溶液进行实验检测:
。为了进一步确认,对该溶液进行实验检测:
步骤一:仔细观察,该溶液呈无色、透明、均一状态:
步骤二:加入足量
 溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。
溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失。(1)原溶液中除图中的离子外,肯定还含有的离子是
(2)步骤二中称量沉淀前的实验操作步骤有:过滤、洗涤、干燥。检验沉淀已洗干净的方法是
(3)原溶液中
 物质的量浓度为
物质的量浓度为(4)向原溶液中加入
 溶液,反应的离子方程式为
溶液,反应的离子方程式为(5)若向100mL原溶液中加入1mol/L的
 溶液,当生成的沉淀质量刚好最大时,加入的
溶液,当生成的沉淀质量刚好最大时,加入的 溶液体积为
溶液体积为
您最近一年使用:0次
2022-12-28更新
|
252次组卷
|
4卷引用:河南省周口中英文学校2019届高三上学期第三次月考化学试题
河南省周口中英文学校2019届高三上学期第三次月考化学试题陕西省渭南市华阴市2021-2022学年高一上学期期末考试化学试题宁夏平罗中学2022-2023学年高二下学期期中考试化学试题(已下线)第11讲 物质的量浓度-【暑假自学课】2023年新高一化学暑假精品课(人教版2019必修第一册)
10 . 已知 R2+核内共有 12 个中子,R 的质量数为 24,则:
(1)该元素为______ 元素?
(2)4g R 的氧化物含有电子数为_____
(3)若2.4g的 R 单质溶于 200mL的盐酸溶液中,形成溶液溶质的物质的量浓度为______ ?(假设反应前后溶液体积无变化)
(1)该元素为
(2)4g R 的氧化物含有电子数为
(3)若2.4g的 R 单质溶于 200mL的盐酸溶液中,形成溶液溶质的物质的量浓度为
您最近一年使用:0次



