名校
解题方法
1 . 某实验小姐同学为了测定工业纯碱的纯度,进行了一系列实验。
(1)工业纯碱中常含有少量 杂质,检验是否含有氯化钠杂质的方法为
杂质,检验是否含有氯化钠杂质的方法为___________ 。
(2)使用滴定法测定炖碱的纯度,称量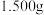 工业纯碱样品,溶解,用
工业纯碱样品,溶解,用 盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液
盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液 变化和生成
变化和生成 的量如图所示
的量如图所示 点前溶液中发生的反应
点前溶液中发生的反应___________ ,计算该工业纯碱样品的质量分数___________ 。(计算结果保留两位小数)
(1)工业纯碱中常含有少量
 杂质,检验是否含有氯化钠杂质的方法为
杂质,检验是否含有氯化钠杂质的方法为(2)使用滴定法测定炖碱的纯度,称量
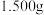 工业纯碱样品,溶解,用
工业纯碱样品,溶解,用 盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液
盐酸做标准液,逐滴滴入纯碱样品中,滴定过程中溶液 变化和生成
变化和生成 的量如图所示
的量如图所示 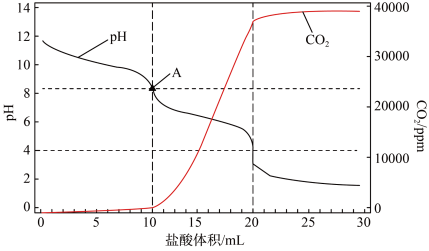
 点前溶液中发生的反应
点前溶液中发生的反应
您最近一年使用:0次
2 . 利用“化学计量在实验中的应用”的相关知识进行填空(设NA表示阿伏加德罗常数的值)。
(1)标准状况下,0.2mol氨气的体积是___________ ,其中含有的NH3分子数是___________ (用NA来表示),含氢原子数是___________ (用NA来表示)。
(2)H2SO4的摩尔质量是___________ ,49g的H2SO4中含有___________ mol氧原子。
(3)将0.5mol Na2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是___________ 。
(1)标准状况下,0.2mol氨气的体积是
(2)H2SO4的摩尔质量是
(3)将0.5mol Na2CO3溶解在水中,配成500mL溶液,所得溶液中溶质的物质的量浓度是
您最近一年使用:0次
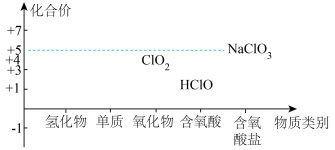
3 . 氯及其化合物的价类二维图如图,回答下列问题: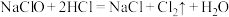 。写出反应①离子方程式
。写出反应①离子方程式___________ ;反应②中HCl体现的性质是___________ 。
(2)溶质质量分数为36.5%、密度为1.2g/cm3的浓盐酸中,盐酸的物质的量浓度为___________ mol/L,取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是___________ 。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)若用(2)中浓盐酸配制500 mL0.3mol/L稀盐酸。该学生需要用量筒量取___________ mL上述浓盐酸进行配制。完成此实验需用到的玻璃仪器除了量筒、烧杯、玻璃棒、胶头滴管外,还需要___________ 。
(4)现将200 mL0.3 mol/L盐酸与300 mL0.4 mol/LCuCl2溶液混合,溶液体积变化忽略不计,所得溶液中Cl-的物质的量浓度是___________ mol/L。
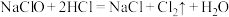 。写出反应①离子方程式
。写出反应①离子方程式(2)溶质质量分数为36.5%、密度为1.2g/cm3的浓盐酸中,盐酸的物质的量浓度为
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)若用(2)中浓盐酸配制500 mL0.3mol/L稀盐酸。该学生需要用量筒量取
(4)现将200 mL0.3 mol/L盐酸与300 mL0.4 mol/LCuCl2溶液混合,溶液体积变化忽略不计,所得溶液中Cl-的物质的量浓度是
您最近一年使用:0次
名校
4 . 将32g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为___________ L, 的体积为
的体积为___________ L。
(2)参加反应的硝酸的物质的量是___________ mol。
(3)待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为___________ mol/L。(结果不需化简)
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为 ,至少需要30%的双氧水
,至少需要30%的双氧水_________ g。
 混合气体在标准状况下的体积为11.2L。请回答:
混合气体在标准状况下的体积为11.2L。请回答:(1)NO的体积为
 的体积为
的体积为(2)参加反应的硝酸的物质的量是
(3)待产生的气体全部释放后,向溶液加入V mL a mol/L的NaOH溶液,恰好使溶液中的
 全部转化成沉淀,则原硝酸溶液的浓度为
全部转化成沉淀,则原硝酸溶液的浓度为(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为
 ,至少需要30%的双氧水
,至少需要30%的双氧水
您最近一年使用:0次
解题方法
5 . 已知二氧化锰与浓盐酸在加热条件下发生反应的化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,用8.7g二氧化锰与100g 36.5%的浓盐酸混合加热,充分反应,计算:
(1)消耗盐酸溶质的物质的量_____ 。
(2)产生的Cl2在标准状况下的体积_____ 。
(3)将反应后的溶液加水稀释至400mL,则此溶液中MnCl2的物质的量浓度是多少_____ ?
(4)32.5g的Zn与足量的稀盐酸完全反应,最多可收集到H2多少升_____ (标准状况);生成ZnCl2的物质的量是多少_____
(1)消耗盐酸溶质的物质的量
(2)产生的Cl2在标准状况下的体积
(3)将反应后的溶液加水稀释至400mL,则此溶液中MnCl2的物质的量浓度是多少
(4)32.5g的Zn与足量的稀盐酸完全反应,最多可收集到H2多少升
您最近一年使用:0次
6 . 请按要求填空:
(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为___________ 。
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍。则X的相对原子质量为___________ 。
(3)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mL A受热完全分解生成15mL O2和10mL F2,则A的化学式为___________ 。
(4)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为___________ 。
(5)质量分数为98%,密度为1.84g·cm-3的某浓硫酸,溶质的物质的量浓度为___________ 。
(6)a个X原子的总质量为b g,则X的相对原子质量可表示为___________ 。
(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍。则X的相对原子质量为
(3)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mL A受热完全分解生成15mL O2和10mL F2,则A的化学式为
(4)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为
(5)质量分数为98%,密度为1.84g·cm-3的某浓硫酸,溶质的物质的量浓度为
(6)a个X原子的总质量为b g,则X的相对原子质量可表示为
您最近一年使用:0次
7 . 抗击新冠病毒期间,各地大规模进行环境消毒,其中“84”消毒液试用比较广泛。如图是某“84”消毒液的标签,该“84”消毒液的物质的量浓度为_____  ?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为
?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为_____  ?
?
 ?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为
?某同学取100mL该“84”消毒液,稀释成1L用于消毒,稀释后的溶液中NaClO的物质的量浓度为 ?
?| “84”消毒液 [有效成分]NaClO [规格]1000mL [质量分数]37.25% [密度] 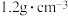 |
您最近一年使用:0次
8 . 试回答下列问题:
(1)0.5mol的 气体中:
气体中:
①质量为________ g,②约含________ 个氢原子,③标准状况下的体积为________ L;
(2)含 的
的 溶液100mL,取出10mL,
溶液100mL,取出10mL, 的物质的量浓度为
的物质的量浓度为________ mol/L。
(1)0.5mol的
 气体中:
气体中: ①质量为
(2)含
 的
的 溶液100mL,取出10mL,
溶液100mL,取出10mL, 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
9 . 以物质的量为中心的计算在高中化学学习中很重要。请完成下列题目。
(1)1gH2中含有_______ 个H。
(2)6.02×1023个CO2分子与16gO2,二者在标况下的体积之比_______ 。
(3)从2L0.5mol·L-1NaOH溶液中取出1L,则所取出的溶液中含NaOH的质量是_______ g。
(1)1gH2中含有
(2)6.02×1023个CO2分子与16gO2,二者在标况下的体积之比
(3)从2L0.5mol·L-1NaOH溶液中取出1L,则所取出的溶液中含NaOH的质量是
您最近一年使用:0次
10 . 按要求完成下列问题。
(1)现需配制0.1mol/LNaOH溶液450mL。
①该实验要用的玻璃仪器有:烧杯、玻璃棒、胶头滴管、_______ 。
②根据计算得知,所需NaOH的质量为_______ 。
③下列操作对溶液浓度的影响(填写“偏高”、“偏低”或“无影响”)
i.定容时,俯视容量瓶的刻度线,所配制的溶液浓度_______ ;
ii.溶液未冷却至室温就移液和定容,所配制的溶液浓度_______ 。
(2)①10.6g的Na2CO3含有_______ mol氧原子。
②标准状况下6.72LNH3分子中所含原子总数与_______ gH2O所含原子总数相等。
③14.2gNa2SO4溶于水,配制成500mL的溶液,该溶液中钠离子的物质的量浓度c=_______ mol/L。
(1)现需配制0.1mol/LNaOH溶液450mL。
①该实验要用的玻璃仪器有:烧杯、玻璃棒、胶头滴管、
②根据计算得知,所需NaOH的质量为
③下列操作对溶液浓度的影响(填写“偏高”、“偏低”或“无影响”)
i.定容时,俯视容量瓶的刻度线,所配制的溶液浓度
ii.溶液未冷却至室温就移液和定容,所配制的溶液浓度
(2)①10.6g的Na2CO3含有
②标准状况下6.72LNH3分子中所含原子总数与
③14.2gNa2SO4溶于水,配制成500mL的溶液,该溶液中钠离子的物质的量浓度c=
您最近一年使用:0次



