1 . 实验时需用约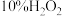 溶液
溶液 ,现用市售
,现用市售 (密度近似为
(密度近似为 )的
)的 来配制,简述其具体配制方法
来配制,简述其具体配制方法_______ 。
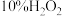 溶液
溶液 ,现用市售
,现用市售 (密度近似为
(密度近似为 )的
)的 来配制,简述其具体配制方法
来配制,简述其具体配制方法
您最近一年使用:0次
2023高三·全国·专题练习
2 . 酸度(每升溶液中含硫酸的质量),当酸度为196时,其物质的量浓度为_______ 。
您最近一年使用:0次
2023高三·全国·专题练习
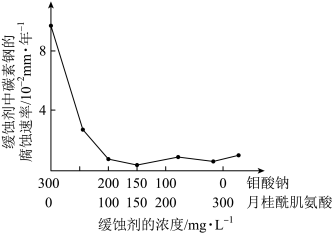
3 . 钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为_______ mol/L。

您最近一年使用:0次
名校
解题方法
4 . 计算
(1)将200mL3mol/L的Al2(SO4)3溶液稀释至500mL,求稀释后硫酸根的浓度为多少______ ?
(2)将K2SO4和Al2(SO4)3和KAl(SO4)2三种混合溶液加H2SO4酸化。测得c(SO )=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO
)=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO ),则c(K+)为多少
),则c(K+)为多少 ______ ?
(3)Fe、Al混合物共0.2mol,用盐酸将其完全溶解,放出标准状况下5.6L气体,然后再滴入4mol/L的NaOH溶液,请计算:
①求该混合物中Fe、Al的物质的量______ ?
②若该Fe、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Fe2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为多少______ mL?
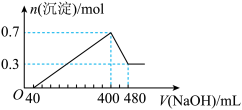
(4)将一定质量的Mg和Al混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示计算:
①酸的物质的量浓度为多少______ ?
②若将上述混合物中等物质的量的Mg和Al分别与稀硫酸充分反应,产生的气体通入相同条件下恒容的甲乙两密闭容器中,求甲乙两容器内的压强比为多少______ ?
(1)将200mL3mol/L的Al2(SO4)3溶液稀释至500mL,求稀释后硫酸根的浓度为多少
(2)将K2SO4和Al2(SO4)3和KAl(SO4)2三种混合溶液加H2SO4酸化。测得c(SO
 )=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO
)=1.05 mol/L, c(Al3+)=0.55 mol/L,c(H+)=0.10mol/L(假设H2SO4完全电离为H+和SO ),则c(K+)为多少
),则c(K+)为多少 (3)Fe、Al混合物共0.2mol,用盐酸将其完全溶解,放出标准状况下5.6L气体,然后再滴入4mol/L的NaOH溶液,请计算:
①求该混合物中Fe、Al的物质的量
②若该Fe、Al的混合物与盐酸恰好完全反应,在滴加NaOH溶液过程中,欲使Fe2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积为多少
(4)将一定质量的Mg和Al混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示计算:

①酸的物质的量浓度为多少
②若将上述混合物中等物质的量的Mg和Al分别与稀硫酸充分反应,产生的气体通入相同条件下恒容的甲乙两密闭容器中,求甲乙两容器内的压强比为多少
您最近一年使用:0次
名校
5 . 回答下列问题
(1)1mol/L的CaCl2溶液0.5L,Cl-离子的物质的量浓度___________ mol/L。
(2)标准状况下,33.6L的NH3所具有的物质的量为___________ mol,将其溶解于水配成1L的溶液,则溶液的物质的量浓度为___________ mol/L,在Cl2+2NaOH=NaCl+NaClO+H2O的反应中,写出反应的离子方程式___________ 。氧化产物是___________ ,还原产物是___________ ;氧化剂与还原剂的物质的量的比是___________ 。
(3)用双线桥表示出电子转移的方向和数目___________ 。
Cl2+2NaOH=NaCl+NaClO+H2O
(1)1mol/L的CaCl2溶液0.5L,Cl-离子的物质的量浓度
(2)标准状况下,33.6L的NH3所具有的物质的量为
(3)用双线桥表示出电子转移的方向和数目
Cl2+2NaOH=NaCl+NaClO+H2O
您最近一年使用:0次
名校
解题方法
6 . 铁是生活中常用的金属,利用铁的相关知识回答下列相关问题。
(1)生活中常使用铁锅炒菜,所利用的金属的物理性质是_______ 。
(2)在食品的包装袋中,经常放一小袋颗粒极细的铁粉,俗称“双吸粉”。铁粉能够吸收的物质是_______ (填写化学式)。
(3)铁的氧化物之一氧化铁的用途有_______ (写出一种),将少量的氧化铁固体加入到氢碘酸中,发生反应的离子方程式是_______ 。
(4)将一定量的 、
、 和
和 的混合物放入体积为
的混合物放入体积为 ,浓度为
,浓度为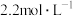 的
的 溶液中,充分反应后,生成气体
溶液中,充分反应后,生成气体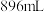 (标准状况),得到不溶固体
(标准状况),得到不溶固体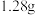 。过滤后,滤液中的金属离子只有
。过滤后,滤液中的金属离子只有 (假设滤液体积仍为
(假设滤液体积仍为 )。向滤液中加入
)。向滤液中加入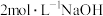 溶液至
溶液至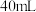 时开始出现沉淀。则未滴加
时开始出现沉淀。则未滴加 溶液前滤液中
溶液前滤液中 的物质的量浓度为
的物质的量浓度为_______ 。
(5)已知稀硝酸具有强氧化性,通常被还原成 ,向一定量的稀硝酸中加入足量的铁粉,发生氧化还原反应,写出对应的离子反应方程式
,向一定量的稀硝酸中加入足量的铁粉,发生氧化还原反应,写出对应的离子反应方程式_______ 。
(6)绿矾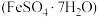 受热分解可以生成氧化铁、二氧化硫、三氧化硫、水。取少量绿矾固体加热一段时间后,某同学欲检验绿矾是否完全分解,取分解后的固体样品少许溶解在稀硫酸中,然后取样加入检验试剂,该同学需要用到的检验试剂是
受热分解可以生成氧化铁、二氧化硫、三氧化硫、水。取少量绿矾固体加热一段时间后,某同学欲检验绿矾是否完全分解,取分解后的固体样品少许溶解在稀硫酸中,然后取样加入检验试剂,该同学需要用到的检验试剂是_______ 。(写出检验试剂名称)
(1)生活中常使用铁锅炒菜,所利用的金属的物理性质是
(2)在食品的包装袋中,经常放一小袋颗粒极细的铁粉,俗称“双吸粉”。铁粉能够吸收的物质是
(3)铁的氧化物之一氧化铁的用途有
(4)将一定量的
 、
、 和
和 的混合物放入体积为
的混合物放入体积为 ,浓度为
,浓度为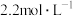 的
的 溶液中,充分反应后,生成气体
溶液中,充分反应后,生成气体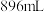 (标准状况),得到不溶固体
(标准状况),得到不溶固体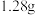 。过滤后,滤液中的金属离子只有
。过滤后,滤液中的金属离子只有 (假设滤液体积仍为
(假设滤液体积仍为 )。向滤液中加入
)。向滤液中加入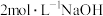 溶液至
溶液至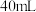 时开始出现沉淀。则未滴加
时开始出现沉淀。则未滴加 溶液前滤液中
溶液前滤液中 的物质的量浓度为
的物质的量浓度为(5)已知稀硝酸具有强氧化性,通常被还原成
 ,向一定量的稀硝酸中加入足量的铁粉,发生氧化还原反应,写出对应的离子反应方程式
,向一定量的稀硝酸中加入足量的铁粉,发生氧化还原反应,写出对应的离子反应方程式(6)绿矾
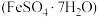 受热分解可以生成氧化铁、二氧化硫、三氧化硫、水。取少量绿矾固体加热一段时间后,某同学欲检验绿矾是否完全分解,取分解后的固体样品少许溶解在稀硫酸中,然后取样加入检验试剂,该同学需要用到的检验试剂是
受热分解可以生成氧化铁、二氧化硫、三氧化硫、水。取少量绿矾固体加热一段时间后,某同学欲检验绿矾是否完全分解,取分解后的固体样品少许溶解在稀硫酸中,然后取样加入检验试剂,该同学需要用到的检验试剂是
您最近一年使用:0次
2023-01-19更新
|
173次组卷
|
2卷引用:河南省信阳高级中学2022-2023学年高一上学期期末考试化学试题
名校
7 . 回答下列问题:
(1)高氯酸的化学式:_______ ,Fe3O4的俗名:_______ 。
(2)请写出Na2O2与水反应的化学方程式,并用双线桥法 标出电子转移方向和数目:_______ 。
(3)写出下列反应的离子方程式:
①向碳酸氢钠溶液中滴加少量澄清石灰水:_______ 。
②氯气与水反应的离子方程式:_______ 。
(4)标况下,将112L氯化氢通入500mL水中,所得溶液的密度约为ρg/cm3。求所得盐酸的物质的量浓度_______ mol/L(含ρ的表达式)。
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL0.05mol/L的Na2SO3溶液与20mL0.02mol/L的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。
(1)高氯酸的化学式:
(2)请写出Na2O2与水反应的化学方程式,并用
(3)写出下列反应的离子方程式:
①向碳酸氢钠溶液中滴加少量澄清石灰水:
②氯气与水反应的离子方程式:
(4)标况下,将112L氯化氢通入500mL水中,所得溶液的密度约为ρg/cm3。求所得盐酸的物质的量浓度
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24mL0.05mol/L的Na2SO3溶液与20mL0.02mol/L的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
8 . 利用相关知识填空。
(1)标准状况下,1.7gH2S的体积为___________ L,含有的氢原子数目为___________ 。
(2)等质量的CO和CO2物质的量之比是___________ 。
(3)4.8gCH4中所含的氢原子数与___________ g水中所含的氢原子数相等。
(4)已知M是一种金属,21.3g 中含有
中含有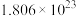 个硝酸根离子,则金属M的摩尔质量为
个硝酸根离子,则金属M的摩尔质量为___________  。
。
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为___________  。
。
(6)100mL0.1
 溶液中,
溶液中, 的物质的量浓度为
的物质的量浓度为___________  。
。
(1)标准状况下,1.7gH2S的体积为
(2)等质量的CO和CO2物质的量之比是
(3)4.8gCH4中所含的氢原子数与
(4)已知M是一种金属,21.3g
 中含有
中含有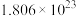 个硝酸根离子,则金属M的摩尔质量为
个硝酸根离子,则金属M的摩尔质量为 。
。(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为
 。
。(6)100mL0.1

 溶液中,
溶液中, 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
名校
9 . 实验室用氯化钠固体配制50g质量分数为6%的溶液,实验步骤为计算、_______ 、量取、溶解:水的密度近似看做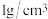 ,量取水时所选用量筒的规格应为
,量取水时所选用量筒的规格应为_______ (填“10mL”“50mL”或“100mL”)。
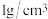 ,量取水时所选用量筒的规格应为
,量取水时所选用量筒的规格应为
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)实验室使用的浓硫酸的溶质质量分数为98%,密度为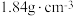 ,则该浓硫酸中
,则该浓硫酸中 的物质的量浓度是
的物质的量浓度是_________ 。
(2)4.6g钠与水反应,得到100mL溶液。(利用方程式计算)
①求生成的气体在标准状况下的体积_________ 。
②求反应后所得溶液中溶质的物质的量浓度_________ 。
(1)实验室使用的浓硫酸的溶质质量分数为98%,密度为
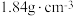 ,则该浓硫酸中
,则该浓硫酸中 的物质的量浓度是
的物质的量浓度是(2)4.6g钠与水反应,得到100mL溶液。(利用方程式计算)
①求生成的气体在标准状况下的体积
②求反应后所得溶液中溶质的物质的量浓度
您最近一年使用:0次



