1 . 现有下列物质:①铜丝②FeCl3溶液③氯化氢气体④NaHSO4固体⑤干冰⑥ 胶体⑦硫酸亚铁铵晶体
胶体⑦硫酸亚铁铵晶体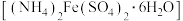 ⑧稀氨水
⑧稀氨水
(1)上述物质中属于电解质的是___________ (填序号,下同),能够导电的是___________ 。写出属于酸式盐的物质溶于水的电离方程式___________ 。
(2)②与⑧在溶液中反应的离子方程式为___________ 。
(3)硫酸亚铁铵晶体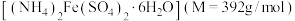 俗名为摩尔盐。某学校化学兴趣小组使用摩尔盐配制
俗名为摩尔盐。某学校化学兴趣小组使用摩尔盐配制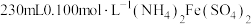 溶液,回答问题:
溶液,回答问题:
①配制溶液过程中需要的玻璃仪器除量筒、烧杯、玻璃棒外,还需___________ 。
②用电子天平(精确度为0.01g)称量硫酸亚铁铵晶体___________ g。
③下列操作将导致所配制的溶液浓度偏高的是___________ (填选项)。
A.摩尔盐放置过程中失去了部分结晶水
B.配制过程中没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线
D.定容后振荡容量瓶发现液面低于刻度线,继续加蒸馏水定容
(4)将VL标准状况下的物质③溶于100mL水中(水的密度近似为1g·mL-1),得到密度为ρg·mL-1的溶液,该溶液的物质的量浓度是___________ mol·L-1(列出计算式)。
 胶体⑦硫酸亚铁铵晶体
胶体⑦硫酸亚铁铵晶体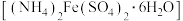 ⑧稀氨水
⑧稀氨水(1)上述物质中属于电解质的是
(2)②与⑧在溶液中反应的离子方程式为
(3)硫酸亚铁铵晶体
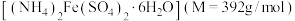 俗名为摩尔盐。某学校化学兴趣小组使用摩尔盐配制
俗名为摩尔盐。某学校化学兴趣小组使用摩尔盐配制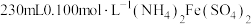 溶液,回答问题:
溶液,回答问题:①配制溶液过程中需要的玻璃仪器除量筒、烧杯、玻璃棒外,还需
②用电子天平(精确度为0.01g)称量硫酸亚铁铵晶体
③下列操作将导致所配制的溶液浓度偏高的是
A.摩尔盐放置过程中失去了部分结晶水
B.配制过程中没有洗涤烧杯和玻璃棒
C.定容时俯视刻度线
D.定容后振荡容量瓶发现液面低于刻度线,继续加蒸馏水定容
(4)将VL标准状况下的物质③溶于100mL水中(水的密度近似为1g·mL-1),得到密度为ρg·mL-1的溶液,该溶液的物质的量浓度是
您最近一年使用:0次
2 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
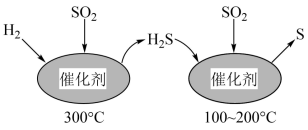
(1)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(2)工业上常用 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。
已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成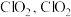 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
①实验室模拟脱硫过程:先加稀硫酸调节 吸收液的
吸收液的 为5,再向其中通入含
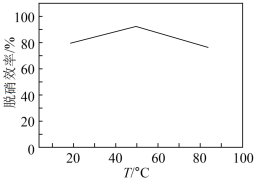
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是___________ 。
②煤燃烧排放的烟气含有 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
表中y=_______ 。若该溶液为 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为______ mol。(写出计算过程)。
(1)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(2)工业上常用
 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。已知
 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成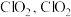 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是
②煤燃烧排放的烟气含有
 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):| 离子 |  |  |  |  |  |
浓度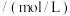 | 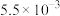 |  |  |  |  |
 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为
您最近一年使用:0次
名校
3 . 完成下列小题。
(1)写出实验室制备氯气的化学方程式___________ 。
(2)在标准状况下,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽中时,水充满烧瓶(假设烧瓶里溶液不扩散出水槽),烧瓶里盐酸的密度为 。该盐酸的物质的量浓度
。该盐酸的物质的量浓度___________ 、溶质的质量分数为___________ 。
(3)请用单线桥法 标出以下反应电子转移方向和数目:___________ 。
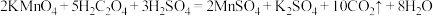
(4)高铁酸钠 是一种新型绿色消毒剂,工业上制备高铁酸钠有多种方法,其中一种是用
是一种新型绿色消毒剂,工业上制备高铁酸钠有多种方法,其中一种是用 在强碱性条件下氧化
在强碱性条件下氧化 ,写出该反应的
,写出该反应的离子方程式 ___________ 。
(1)写出实验室制备氯气的化学方程式
(2)在标准状况下,用干燥烧瓶收集一瓶氯化氢气体倒置于盛水的水槽中时,水充满烧瓶(假设烧瓶里溶液不扩散出水槽),烧瓶里盐酸的密度为
 。该盐酸的物质的量浓度
。该盐酸的物质的量浓度(3)请用
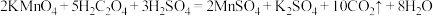
(4)高铁酸钠
 是一种新型绿色消毒剂,工业上制备高铁酸钠有多种方法,其中一种是用
是一种新型绿色消毒剂,工业上制备高铁酸钠有多种方法,其中一种是用 在强碱性条件下氧化
在强碱性条件下氧化 ,写出该反应的
,写出该反应的
您最近一年使用:0次
2024-01-30更新
|
74次组卷
|
2卷引用: 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
名校
4 . 请回答:
(1)小苏打的化学式是___________ ;漂白粉的主要成分是___________ (用化学式表示)。
(2)质量分数为36.5%的HCl溶液,密度为1.17g/cm3,求其物质的量浓度为___________ mol/L。
(3)实验室用软锰矿制备氯气的离子方程式___________ 。
(1)小苏打的化学式是
(2)质量分数为36.5%的HCl溶液,密度为1.17g/cm3,求其物质的量浓度为
(3)实验室用软锰矿制备氯气的离子方程式
您最近一年使用:0次
名校
5 .  为棕褐色固体,在化工生产中有许多应用。
为棕褐色固体,在化工生产中有许多应用。
(1)书写利用单质反应制备氯化铁的化学方程式,并标出电子转移的方向和数目 :___________ 。
(2)铁与硫单质反应生成黑色固体 ,由以上信息可知,氯气的氧化性
,由以上信息可知,氯气的氧化性___________ 硫单质。
A.强于 B.弱于
(3)氯化铁溶于水后,电离方程式为___________ 。
(4)对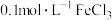 溶液说法正确的是___________。
溶液说法正确的是___________。
(5)将 氧化铁晶体(
氧化铁晶体( ,
, )与
)与 溶液恰好完全沉淀,则
溶液恰好完全沉淀,则 溶液的物质的量浓度约为___________。
溶液的物质的量浓度约为___________。
(6)若用氯化铁晶体( )配制
)配制 溶液,下列会造成所配溶液物质的量浓度偏高的是___________。
溶液,下列会造成所配溶液物质的量浓度偏高的是___________。
(7)配制 溶液过程中用到的玻璃仪器:玻璃棒、烧杯、
溶液过程中用到的玻璃仪器:玻璃棒、烧杯、___________ 。
(8)将饱和氯化铁溶液与小苏打溶液混合时,会产生红褐色沉淀和一种无色无味且能使石灰水变浑浊的气体,则该气体在标况下的密度为___________ (保留三位小数)。
 为棕褐色固体,在化工生产中有许多应用。
为棕褐色固体,在化工生产中有许多应用。(1)书写利用单质反应制备氯化铁的化学方程式,并标出
(2)铁与硫单质反应生成黑色固体
 ,由以上信息可知,氯气的氧化性
,由以上信息可知,氯气的氧化性A.强于 B.弱于
(3)氯化铁溶于水后,电离方程式为
(4)对
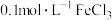 溶液说法正确的是___________。
溶液说法正确的是___________。A.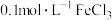 溶液中 溶液中 的物质的量为 的物质的量为 |
B.将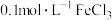 固体溶于 固体溶于 的水中得到 的水中得到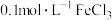 溶液 溶液 |
C.Fe与盐酸反应的离子方程式: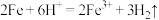 |
D.将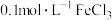 溶液加水稀释100倍,其浓度变为 溶液加水稀释100倍,其浓度变为 |
 氧化铁晶体(
氧化铁晶体( ,
, )与
)与 溶液恰好完全沉淀,则
溶液恰好完全沉淀,则 溶液的物质的量浓度约为___________。
溶液的物质的量浓度约为___________。A. | B.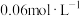 | C. | D. |
 )配制
)配制 溶液,下列会造成所配溶液物质的量浓度偏高的是___________。
溶液,下列会造成所配溶液物质的量浓度偏高的是___________。| A.定容时,仰视凹液面最低点 | B.转移时,有少量液体溅出 |
C. ,晶体已部分失水 ,晶体已部分失水 | D.烧杯、玻璃棒未洗涤 |
 溶液过程中用到的玻璃仪器:玻璃棒、烧杯、
溶液过程中用到的玻璃仪器:玻璃棒、烧杯、(8)将饱和氯化铁溶液与小苏打溶液混合时,会产生红褐色沉淀和一种无色无味且能使石灰水变浑浊的气体,则该气体在标况下的密度为
您最近一年使用:0次
名校
6 . 下列说法是否正确(正确的打“√”,不正确的打“×”)若不正确请说明理由。
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族。_________ ;
(2)FeCl3与Cu的反应为置换反应。_________ ;
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。_________ ;
(4)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。_________
(1)元素周期表中每一横行称为一周期,每一纵列称为一个族。
(2)FeCl3与Cu的反应为置换反应。
(3)1 mol Na2O溶于水中形成1 L溶液,所得溶液的物质的量浓度为1 mol/L。
(4)镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料。
您最近一年使用:0次
名校
7 . 现有八种物质: ①铁粉 ②NH3 ③稀盐酸 ④熔融FeCl3 ⑤CH4 ⑥CaCO3固体 ⑦CuSO4溶液 ⑧Fe3O4。
(1)①-⑥属于电解质的是_______ 。
(2)写出③与⑧反应的离子方程式_______ 。将③与⑧反应后的溶液和⑦混合,再加入过量的①,反应结束后,一定没有的阳离子为_________ 。
(3)标准状况下,4.8g⑤中所含氢原子数与______ molH2O所含氢原子数相等。
(4)标准状况下,将22.4L②溶于83mL水中形成溶液的密度为0.88g/cm3,该氨水溶质的物质的量浓度为______ mol/L ,溶质的质量分数为_______ 。
(1)①-⑥属于电解质的是
(2)写出③与⑧反应的离子方程式
(3)标准状况下,4.8g⑤中所含氢原子数与
(4)标准状况下,将22.4L②溶于83mL水中形成溶液的密度为0.88g/cm3,该氨水溶质的物质的量浓度为
您最近一年使用:0次
8 . 将30mL0.5mol/LNaOH溶液加水稀释到500mL。计算:稀释后NaOH溶液中的物质的量浓度_____ 。
您最近一年使用:0次
名校
9 . 向蔗糖(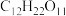 )中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生
)中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生 ,
, ;
; 可用酸性高锰酸钾溶液吸收。请回答下列问题:
可用酸性高锰酸钾溶液吸收。请回答下列问题:
(1)蔗糖的摩尔质量为______ 。17.1 g 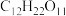 的物质的量为
的物质的量为______ 。
(2)500℃时,34.2 g蔗糖完全燃烧,产生两种气体的体积之比为______ ,其中产生 的体积(折算成标准状况下)为
的体积(折算成标准状况下)为______ L。
(3)质量分数为98%、密度为1.84 g⋅cm 的浓硫酸的物质的量浓度为
的浓硫酸的物质的量浓度为______ mol·L ;酸性高锰酸钾溶液需要用浓度为3 mol⋅L
;酸性高锰酸钾溶液需要用浓度为3 mol⋅L 的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸
的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸______ mL,需要用到的定量仪器有______ 。
(4) 被酸性高锰酸钾溶液吸收发生反应的离子方程式为
被酸性高锰酸钾溶液吸收发生反应的离子方程式为______ 。
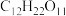 )中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生
)中滴入98%的浓硫酸,蔗糖会变成疏松的“炭块”,同时产生 ,
, ;
; 可用酸性高锰酸钾溶液吸收。请回答下列问题:
可用酸性高锰酸钾溶液吸收。请回答下列问题:(1)蔗糖的摩尔质量为
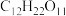 的物质的量为
的物质的量为(2)500℃时,34.2 g蔗糖完全燃烧,产生两种气体的体积之比为
 的体积(折算成标准状况下)为
的体积(折算成标准状况下)为(3)质量分数为98%、密度为1.84 g⋅cm
 的浓硫酸的物质的量浓度为
的浓硫酸的物质的量浓度为 ;酸性高锰酸钾溶液需要用浓度为3 mol⋅L
;酸性高锰酸钾溶液需要用浓度为3 mol⋅L 的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸
的硫酸酸化,则实验室配制50 mL该浓度的硫酸需质量分数为98%的浓硫酸(4)
 被酸性高锰酸钾溶液吸收发生反应的离子方程式为
被酸性高锰酸钾溶液吸收发生反应的离子方程式为
您最近一年使用:0次
名校
10 . 某无色透明溶液中可能大量存在Ag+、Ca2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白。
(1)不做任何实验就可以肯定原溶液中不存在的离子是___________ 。
(2)取少量原溶液,加入过量稀盐酸、有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是___________ 。
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有___________ ,该过程产生白色沉淀的离子方程式为___________ 。
(4)原溶液可能大量共存的阴离子是___________(选填字母编号)。
(5)写出NaHSO4在水溶液中的电离方程式___________ 。12gNaHSO4中含有___________ 个O原子,将其溶于水配成500mL溶液,则溶液的物质的量浓度为___________ mol/L,从中取出l00mL可以消耗1mol/L的NaOH溶液___________ mL。
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸、有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的碳酸钠溶液,出现白色沉淀,说明原溶液中肯定有
(4)原溶液可能大量共存的阴离子是___________(选填字母编号)。
| A.OH- | B. | C. | D.Cl- |
您最近一年使用:0次



