1 . 氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
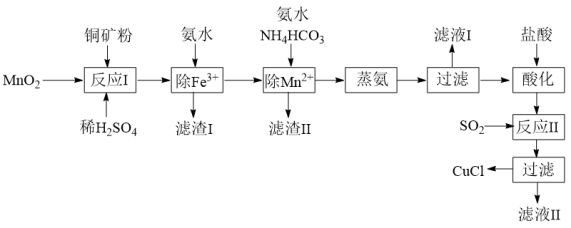
(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:__________ 。
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________ 。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
由表中信息可知蒸氨的条件应选_______ (填序号),请用平衡移动原理解释选择该条件的原因是__________________________________________________ 。
(4)反应Ⅱ的离子方程式___________________________ 。
(5)实验证明通过如图装置也可获得CuCl,现象为阴极:产生无色气体;阳极:有白色胶状沉淀生成且逐渐增多;U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
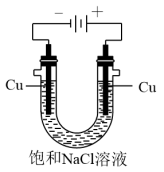
①生成CuCl的电极反应式为________________________________ 。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法________ 。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2

(1)滤渣Ⅰ是Fe(OH)3和单质硫的混合物,反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);氧化产物为:
(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。Cu(OH)2+4NH3
 [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:| 序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
| a | 110 | 60 | 101.3 | 浅蓝色 |
| b | 100 | 40 | 74.6 | 几乎很浅 |
| c | 90 | 30 | 60.0 | 无色透明 |
(4)反应Ⅱ的离子方程式
(5)实验证明通过如图装置也可获得CuCl,现象为阴极:产生无色气体;阳极:有白色胶状沉淀生成且逐渐增多;U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。

①生成CuCl的电极反应式为
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些可以支持该同学的说法
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
您最近一年使用:0次
名校
解题方法
2 . 莫尔盐[(NH4)2Fe(SO4)2·8H2O]溶液经常用于定量滴定实验。下列有关说法正确的是
| A.配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐21.4克 |
| B.可与含HClO、H+、Clˉ微粒的溶液大量共存 |
C.加入过量Ba(OH)2溶液发生反应:2Ba2++2SO +Fe2++2OHˉ=2BaSO4↓+Fe(OH)2↓ +Fe2++2OHˉ=2BaSO4↓+Fe(OH)2↓ |
D.取样,加入浓NaOH溶液并加热,生成能使蓝色石蕊试纸变红的气体,证明含NH |
您最近一年使用:0次
3 . 有关下列离子方程式的说法正确的是
| A.等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O |
| B.向NaAlO2溶液中通入过量CO2的反应为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| C.等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
您最近一年使用:0次
14-15高一上·甘肃天水·期中
名校
4 . 下列说法中正确的是
| A.某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+ |
| B.能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3- |
| C.取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42- |
| D.H++OH-=H2O可描述所有酸碱中和反应的实质 |
您最近一年使用:0次
2016-12-09更新
|
1231次组卷
|
15卷引用:2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷
(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷(已下线)2014-2015学年甘肃省天水市秦安县二中高一上学期期中考试化学试卷湖北省沙市中学2017-2018学年高一上学期第四次双周考试化学试题【全国市级联考】贵州省毕节市2017-2018学年高一毕业学业达标模拟考试化学试题吉林省长春市九台区师范高级中学2018-2019学年高一上学期期中考试化学试题贵州省黄平县第二中学2018-2019学年高一上学期12月月考化学试题云南省元江县一中2020届高三上学期开学考试化学试题云南省河口县一中2019-2020学年高二上学期开学考试化学试题第2章《元素与物质世界》期中复习检测试卷云南省保山市昌宁县二中2019-2020学年高一10月月考化学试题吉林省白城市第一中学2019-2020学年高一上学期期中考试化学试题湖南省长沙市长沙县第六中学2020届高三上学期第二次月考化学试题(已下线)第09练 离子反应-2022年【寒假分层作业】高一化学(苏教版2019必修第一册)广东省普宁市华侨中学2022-2023学年高一上学期(11月)期中考试化学试题黑龙江省牡丹江市第三高级中学2023-2024学年高一上学期第一次月考化学试题
5 . 有关下列离子方程式的说法正确的是
A.向NH4HCO3溶液中加过量的NaOH溶液并加热: NH4+ +OH- NH3↑+H2O NH3↑+H2O |
| B.向NaAlO2溶液中通入过量CO2的反应为:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32— |
| C.等物质的量的FeBr2与Cl2反应为:2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl— |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4— + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O |
您最近一年使用:0次
名校
6 . 莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液经常用于定量滴定实验。下列有关说法正确的是
| A.配制0.1mol•L-1莫尔盐溶液500mL,需莫尔盐19.6克 |
| B.可与含Fe2+、HClO、H+、Cl-微粒的溶液大量共存 |
| C.加入过量Ba(OH)2溶液发生反应:2Ba2++2SO42-+Fe2++2OH-=2BaSO4↓+Fe(OH)2↓ |
| D.取样,加入浓NaOH溶液并加热,出现可让蓝色石蕊试纸变红的气体,证明含NH4+ |
您最近一年使用:0次
2016-12-09更新
|
599次组卷
|
4卷引用:2016届浙江省建人高复学校高三上学期第二次月考化学试卷
2016届浙江省建人高复学校高三上学期第二次月考化学试卷福建省莆田第六中学2018届高三上学期期中考试化学试题B卷福建省莆田第六中学2018届高三上学期期中考试化学试题(已下线)考点02 离子反应 离子方程式(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)
7 .
(1)下列说法不正确的是_______。
(2)下列有关说法正确的是_______。

(3)常温常压下,将一定质量的Fe、Fe2O3、Fe3O4的混合物平均分成两份:一份溶于一定量的稀硝酸中恰好完全反应,生成0.1 mol NO气体;另一份溶于足量稀盐酸中生成一定量气体。向两次反应后溶液中分别加入硫氰化钾溶液,溶液颜色均无明显变化,则固体溶于盐酸后生成的气体,在标准状况下的体积约为_______ mL。
(1)下列说法不正确的是_______。
| A.由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳池馆常用硫酸铜作池水消毒剂 |
| B.明矾溶于水后能生成Al(OH)3胶体,它能凝聚水中的悬浮物并起到杀菌消毒的作用,从而达到净水的目的 |
| C.铝制品表面有致密的氧化膜保护层,所以不能盛放酸、碱溶液,但可以长时间盛放咸菜等腌制品 |
| D.工业电解氧化铝时,向其中添加冰晶石,使氧化铝的熔点降低,从而减少冶炼过程中的能量消耗 |

| A.按图I装置电解一段时间后,往蛋壳外溶液中滴加几滴酚酞,溶液呈红色 |
| B.按图II装置实验,可以证明酸性强弱关系为:硝酸>碳酸>硅酸 |
C.图III表示:向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量随Ba(OH)2加入量的变化曲线,则oa段发生的离子反应为:2Al3+ + 3 + 3Ba2+ + 6OH- = 2Al(OH)3 ↓+ 3BaSO4↓ + 3Ba2+ + 6OH- = 2Al(OH)3 ↓+ 3BaSO4↓ |
| D.图IV表示:室温时,将1 mol·L–1 NaOH溶液逐滴滴入0.2 mol·L–1 Al2(SO4)3溶液中,实验测得溶液pH随NaOH溶液体积变化曲线,则d点时Al(OH)3沉淀开始溶解 |
您最近一年使用:0次
名校
解题方法
8 . 下列实验设计及其对应的离子方程式均正确的是
A.氯气溶于水制备次氯酸: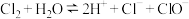 |
B.用浓盐酸酸化的 溶液与 溶液与 反应,证明 反应,证明 具有还原性: 具有还原性: |
C.向澄清石灰水中加入少量的 溶液产生沉淀: 溶液产生沉淀: |
D.用铜做电极电解NaCl溶液制备氯气: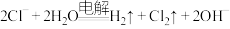 |
您最近一年使用:0次
2023-01-05更新
|
167次组卷
|
4卷引用:天津市南开区2020届高三上学期期末考试化学试题
名校
解题方法
9 . 下列反应的离子方程式与解释均正确的是
| A.将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++ =Fe3++2H2O+NO↑ =Fe3++2H2O+NO↑ |
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 +6H++5H2O2=2Mn2++5O2↑+8H2O +6H++5H2O2=2Mn2++5O2↑+8H2O |
您最近一年使用:0次
2023-04-26更新
|
304次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
10 . FeBr2是一种黄绿色固体,某学习小组制备并探究它的还原性。
Ⅰ.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴, 为外套电炉丝的不锈钢管,
为外套电炉丝的不锈钢管, 是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至
是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至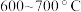 ,然后将干燥、纯净的CO2气流通入D中,
,然后将干燥、纯净的CO2气流通入D中, 管中反应开始。不断将d中液溴滴入温度为
管中反应开始。不断将d中液溴滴入温度为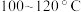 的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。
的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。


(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸,为使通入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中的试剂:B为___________ ,C为___________ 。为防止污染空气,实验时应在F处连接盛___________ 的尾气吸收装置。
(2)反应过程中要不断通入CO2,其主要作用是①___________ ,②___________ 。
Ⅱ.探究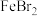 的还原性
的还原性
(3)实验需要90 mL0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是___________ 。
(4)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:Br-被Cl2氧化成Br2溶解在溶液中:假设2:Fe2+被Cl2氧化成Fe3+。设计实验证明假设2正确:___________ 。
(5)请用一个离子方程式来证明还原性Fe2+>Br-:___________ 。
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为___________ 。
Ⅰ.实验室制备FeBr2
实验室用如图所示装置制取溴化亚铁。其中A为CO2发生装置,D和d中均盛有液溴,
 为外套电炉丝的不锈钢管,
为外套电炉丝的不锈钢管, 是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至
是两个耐高温的瓷皿,其中盛有细铁粉。实验开始时,先将铁粉加热至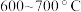 ,然后将干燥、纯净的CO2气流通入D中,
,然后将干燥、纯净的CO2气流通入D中, 管中反应开始。不断将d中液溴滴入温度为
管中反应开始。不断将d中液溴滴入温度为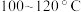 的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。
的D中。经过几小时的连续反应,在钢管的一端沉积有黄绿色鳞片状溴化亚铁。

(1)若在A中盛固体CaCO3,a中盛6 mol/L盐酸,为使通入D中的CO2为干燥纯净的气体,则图中B、C处的洗气瓶中的试剂:B为
(2)反应过程中要不断通入CO2,其主要作用是①
Ⅱ.探究
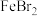 的还原性
的还原性(3)实验需要90 mL0.1 mol/L FeBr2溶液,配制FeBr2溶液除烧杯、量筒、胶头滴管、玻璃棒外,还需要的玻璃仪器是
(4)取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设。假设1:Br-被Cl2氧化成Br2溶解在溶液中:假设2:Fe2+被Cl2氧化成Fe3+。设计实验证明假设2正确:
(5)请用一个离子方程式来证明还原性Fe2+>Br-:
(6)若在40 mL上述FeBr2溶液中通入3×10-3mol Cl2,则反应的离子方程式为
您最近一年使用:0次
2021-08-05更新
|
260次组卷
|
5卷引用:2017届江西省上高二中高三上学期第三次月考化学试卷
2017届江西省上高二中高三上学期第三次月考化学试卷黑龙江省哈尔滨市第六中学2017届高三下学期第三次模拟考试理科综合化学试题(已下线)【中等生百日捷进提升系列-技能方法】专题27 假设猜想型实验探究评价题重庆市第三十七中学校 2021-2022学年(2022届)高三上学期 7月月考化学试题天津市新华中学2022-2023学年高三上学期学科练习(一)化学试题



