1 . 以硫酸工业产生的SO2尾气和氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质,生产流程如下:
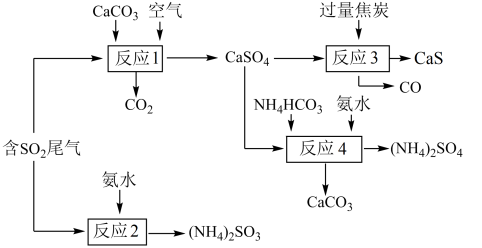
(1)反应1的化学方程式为________________ ;
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为___________________ ;
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为______________ ;
(4)整个合成路线中可以循环利用的物质是_____________ ;
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)_______________ 。

(1)反应1的化学方程式为
(2)反应2中用足量氨水吸收SO2,该反应的离子方程式为
(3)为充分利用副产品CO,有人提出以熔融K2CO3为电解质,设计成CO燃料电池以减少对环境的污染。该燃料电池负极的电极反应式为
(4)整个合成路线中可以循环利用的物质是
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥, 形成共生系统。计算10.00L 2.00mol/L的(NH4)2SO3溶液可以处理标准状况下NO气体的体积(写出计算过程)
您最近一年使用:0次
名校
解题方法
2 . 按要求回答下列问题:
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:__________________________________________ ;若将此混合溶液置于50℃的水浴中,则出现浑浊的时间将__________ (填“增加”、“减少”或“不变”)。
(2)已知 的电离平衡常数
的电离平衡常数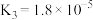 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至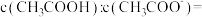 1:18,此时溶液PH=
1:18,此时溶液PH=________ 。
(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
则该反应的热化学反应方程式为:___________________________ 。分别在v L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是_______ (填“A” 或“B ”)。
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是_________________________________ 。

(4)已知2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
①此时,反应向___________ (填“左”或“右”)移动,才能达到平衡。
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为_____________ 。
③达到平衡后CH3OH的浓度为_____________ 。
(5)制取聚乙二酸乙二酯的反应方程式_______________________________
(6)有一种耐热型树脂材料的结构简式为 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:__________ 。
(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为_________ 。
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。
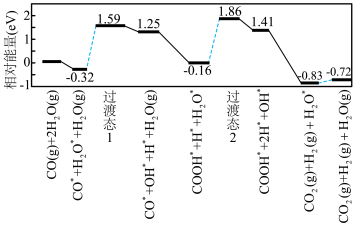
可知水煤气变换的ΔH________ 0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________ eV,写出该步骤的化学方程式_______________________ 。
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:_________________________
(10)已知: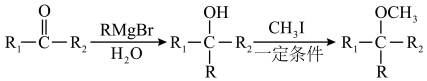 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以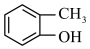 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)_______________________________________________________________ 。
(1)常温下,将等浓度的Na2S2O3溶液与硫酸溶液混合,2 min后溶液中明显出现浑浊,请写出相关反应的离子方程式:
(2)已知
 的电离平衡常数
的电离平衡常数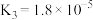 ,向0.1mol/L
,向0.1mol/L 溶液中滴加NaOH溶液至
溶液中滴加NaOH溶液至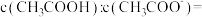 1:18,此时溶液PH=
1:18,此时溶液PH=(3)CO2与CH4经催化重整,制得合成气CO和H2:
①已知上述反应中相关的化学键键能数据如下:
| 化学键 | C—H | C=O | H—H | C O(CO) O(CO) |
| 键能/kJ·mol−1 | 413 | 745 | 436 | 1075 |
②按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率的影响如下图所示。此反应优选温度为900℃的原因是

(4)已知2CH3OH(g)
 CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数K = 4。此温度下,在密闭容器中加入CH3OH,反应到20min时测得各组分的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c / mol·L-1 | 0.4 | 0.1 | 0.1 |
②从加入CH3OH开始反应到20min时,CH3OCH3的生成速率为
③达到平衡后CH3OH的浓度为
(5)制取聚乙二酸乙二酯的反应方程式
(6)有一种耐热型树脂材料的结构简式为
 ,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:
,写出其合成单体除丙烯氰(CH2=CHCN),2-甲基苯乙烯外,还需要的单体名称是:(7)有机物R(C6H12O2)与稀硫酸共热生成A和B,A能够发生银镜反应,B不能发生催化氧化反应,那么R的结构简式为
(8)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]的反应历程,如图所示,其中吸附在金催化剂表面上的物种用❉标注。

可知水煤气变换的ΔH
(9)某有机物A由C、H、O三种元素组成,相对分子质量为90 .将9.0gA完全燃烧的产物依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,A能与NaHCO3溶液反应,且2分子A之间脱水可生成八元环化合物.则A在一定条件下发生缩聚反应的产物的结构简式是:
(10)已知:
 (R表示烃基,R1、R2表示烃基或氢原子)。设计以
(R表示烃基,R1、R2表示烃基或氢原子)。设计以 为原料制备
为原料制备 的合成路线(提供CH3MgBr及需要的无机试剂)
的合成路线(提供CH3MgBr及需要的无机试剂)
您最近一年使用:0次
2019高三下·江苏·专题练习
解题方法
3 . 氯化亚铜是一种应用较广的催化剂,易水解,微溶于水,不溶于乙醇和稀硫酸;在空气中迅速被氧化成绿色;见光易分解变成褐色。以低品位铜矿砂(主要成分CuS)为原料制备氯化亚铜的路线如下:

回答下列问题:
(1)“酸溶1”过程中发生反应的化学方程式是________ 。
(2)“除锰”过程中加入NH3·H2O的目的是________ 。
(3)“酸溶2”步骤加入的硫酸略过量的原因是________ 。
(4)“合成”步骤反应的离子方程式是________ 。
(5)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇的目的是________ 。
(6)在CuCl的生产过程中除环境问题和安全问题外,还应该注意的关键问题是________ 。

回答下列问题:
(1)“酸溶1”过程中发生反应的化学方程式是
(2)“除锰”过程中加入NH3·H2O的目的是
(3)“酸溶2”步骤加入的硫酸略过量的原因是
(4)“合成”步骤反应的离子方程式是
(5)“洗涤”步骤先用盐酸洗,再用无水乙醇洗涤。用无水乙醇的目的是
(6)在CuCl的生产过程中除环境问题和安全问题外,还应该注意的关键问题是
您最近一年使用:0次
名校
解题方法
4 . 生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______ (填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
以下是一种废钒催化剂回收工艺路线:
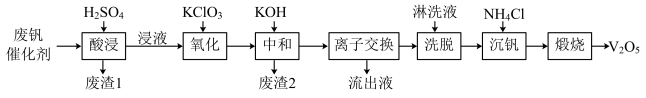
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________ ,同时V2O5转化为VO2+。“废渣1”的主要成分是________ 。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____ 。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-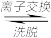 R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______ 性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____ 。
(6)“煅烧”中发生反应的化学方程式2NH4VO3 V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________ 。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__ kg(保留小数点后一位)。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |

回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-
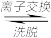 R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是
(6)“煅烧”中发生反应的化学方程式2NH4VO3
 V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5
您最近一年使用:0次
5 . 硼氢化钠(NaBH4)是合成中常用的还原剂。采用NaBO2为主要原料制备NaBH4(B元素化合价为+3)的反应为NaBO2+SiO2+Na+H2 NaBH4+Na2SiO3(未配平)。请回答下列问题:
NaBH4+Na2SiO3(未配平)。请回答下列问题:
(1)在该反应加料之前,需要将反应容器加热至100 ℃以上并通入氩气,通入氩气的目的是_______ 。
(2)上述反应中H2与Na的物质的量之比为_______ 。
(3)硅酸钠水溶液俗称水玻璃,能产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是_______ (用离子方程式表示)。铸造工艺中可用氯化铵作为水玻璃的硬化剂。请用平衡原理加以解释:_______ 。
(4)在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以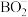 形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为_______ 。
(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1 L 6 mol·L−1 H2O2溶液,理论上流过电路中的电子数为_______ (用NA表示阿伏加德罗常数的值)。
 NaBH4+Na2SiO3(未配平)。请回答下列问题:
NaBH4+Na2SiO3(未配平)。请回答下列问题:(1)在该反应加料之前,需要将反应容器加热至100 ℃以上并通入氩气,通入氩气的目的是
(2)上述反应中H2与Na的物质的量之比为
(3)硅酸钠水溶液俗称水玻璃,能产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是
(4)在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以
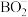 形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为
形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1 L 6 mol·L−1 H2O2溶液,理论上流过电路中的电子数为
您最近一年使用:0次
解题方法
6 . 完成下列填空:硼氧化钠(NaBH4)是合成中常用的还原剂。采用NaBO2为主要原料制备NaBH4(B元素化合价为+3)的反应为:NaBO2+SiO2+Na+H2 NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
完成下列填空:
(1)上述反应中,原子最外层有两个未成对电子的元素是_____ (填元素符号)。SiO2熔点高的原因是_____ 。
(2)上述反应中H2与Na的物质的量之比为_____ 。
(3)硅酸钠水溶液产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是_____ (用离子方程式表示)。铸造工艺中可用氯化铵作为水玻璃的硬化剂。试用平衡原理加以解释_____ 。
(4)NaBH4可使许多金属离子还原成金属单质。例如它从含金离子(Au3+)的废液中提取Au.配平该反应的离子方程式:_____ Au3++_____ BH4﹣+_____ OH-→_____ Au+_____ BO2﹣+_____ H2O。
(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1L6mol/L H2O2溶液,理论上流过电路中的电子数为_____ 。
 NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)
NaBH4+Na2SiO3(未配平);硅酸钠俗称泡花碱,又名水玻璃,在工业生产中也有广泛应用(已知硅酸为难溶性弱酸)完成下列填空:
(1)上述反应中,原子最外层有两个未成对电子的元素是
(2)上述反应中H2与Na的物质的量之比为
(3)硅酸钠水溶液产生硅酸(H2SiO3),硬化粘结,且有碱性,其原因是
(4)NaBH4可使许多金属离子还原成金属单质。例如它从含金离子(Au3+)的废液中提取Au.配平该反应的离子方程式:
(5)最新研究发现以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,则每消耗1L6mol/L H2O2溶液,理论上流过电路中的电子数为
您最近一年使用:0次
7 . “来自石油和煤的两种基本化工原料”之一A,A是气态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯。其合成路线如图所示。

(1)A的分子式是_____ 。在反应①~④中,属于加成反应的是___ (填序号)。
(2)写出反应②的化学方程式:__ 。
写出D与小苏打溶液反应的离子方程式:___ 。
(3)下图是分离B、D和乙酯乙酯混合物的实验操作流程图。

上述实验过程中,所涉及的三次分离操作分别是_____ 。
A.①蒸馏;②过滤;③分液 B.①分液;②蒸馏;③结晶、过滤
C.①分液;②蒸馏;③蒸馏 D.①蒸馏;②分液;③分液
(4)满足与C互为同系物,且相对分子质量比C大56的分子的同分异构体有___ 种。

(1)A的分子式是
(2)写出反应②的化学方程式:
写出D与小苏打溶液反应的离子方程式:
(3)下图是分离B、D和乙酯乙酯混合物的实验操作流程图。

上述实验过程中,所涉及的三次分离操作分别是
A.①蒸馏;②过滤;③分液 B.①分液;②蒸馏;③结晶、过滤
C.①分液;②蒸馏;③蒸馏 D.①蒸馏;②分液;③分液
(4)满足与C互为同系物,且相对分子质量比C大56的分子的同分异构体有
您最近一年使用:0次
8 . (1)龚老师在大学时候以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:

已知:①Cl2+2OH− ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为_____ ;实验中控制温度除用冰水浴外,还需采取的措施是_______ 。
(2)步骤Ⅱ合成N2H4·H2O的装置如图所示。

NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是_________ ;使用冷凝管的目的是_____ 。
(3)紧接着龚老师查阅资料发现AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了下图实验装置并进行下列实验。

先断开电键K,向溶液X中滴加0.1mol·L-1KSCN溶液,无明显现象,说明___________________ ;闭合电键K后,若观察到的实验现象有溶液X逐渐变红、右边石墨电极上有固体析出、电流计指针偏转,据此得出的结论是_____ ,溶液变红的原因是__________________ (用离子方程式表示),该实验设计的优点是_____ 。

已知:①Cl2+2OH−
 ClO−+Cl−+H2O是放热反应。
ClO−+Cl−+H2O是放热反应。②N2H4·H2O沸点约118℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤Ⅰ制备NaClO溶液时,若温度超过40℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为
(2)步骤Ⅱ合成N2H4·H2O的装置如图所示。

NaClO碱性溶液与尿素水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。实验中通过滴液漏斗滴加的溶液是
(3)紧接着龚老师查阅资料发现AgSCN为白色难溶物,Ag+可以氧化SCNˉ和Fe2+。为探究SCNˉ和Fe2+的还原性强弱,该同学设计了下图实验装置并进行下列实验。

先断开电键K,向溶液X中滴加0.1mol·L-1KSCN溶液,无明显现象,说明
您最近一年使用:0次
9 . 雾霾含有大量的污染物SO2、NO,工业上变废为宝利用工业尾气获得NH4NO3产品的流程图如下:(Ce为铈元素):

(1)上述流程中循环使用的物质有_____________ ,
(2)上述合成路线中用到15%-20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O HOCH2CH2NH3+ + OH-,写出乙醇胺吸收CO2的化学方程式
HOCH2CH2NH3+ + OH-,写出乙醇胺吸收CO2的化学方程式_____________ 。
(3)写出吸收池Ⅲ中,酸性条件下NO转化为NO2-的离子方程式为_____________ 。
(4)向吸收池Ⅳ得到的HSO3﹣溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:_____________ 。
(5)电解池Ⅴ可使Ce4+再生,装置如下图所示:

生成Ce4+从______ 口(填字母)流出,写出阴极的电极反应式_____________ :
(6)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是_____________ 、_____________ 、过滤、洗涤等。

(1)上述流程中循环使用的物质有
(2)上述合成路线中用到15%-20%的乙醇胺(HOCH2CH2NH2),其水溶液具有弱碱性,显碱性的原因:HOCH2CH2NH2 + H2O
 HOCH2CH2NH3+ + OH-,写出乙醇胺吸收CO2的化学方程式
HOCH2CH2NH3+ + OH-,写出乙醇胺吸收CO2的化学方程式(3)写出吸收池Ⅲ中,酸性条件下NO转化为NO2-的离子方程式为
(4)向吸收池Ⅳ得到的HSO3﹣溶液中滴加少量CaCl2溶液,出现浑浊,pH降低,用平衡移动原理解释溶液pH降低的原因:
(5)电解池Ⅴ可使Ce4+再生,装置如下图所示:

生成Ce4+从
(6)从氧化池Ⅵ中得到粗产品NH4NO3的实验操作是
您最近一年使用:0次
名校
解题方法
10 . 氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色,难溶于水和乙醇。工业上以废铜料(含少量铁)为原料,制备氯化亚铜的流程如图:

(1)步骤③中,为提高反应速率,可用稀HNO3代替O2,此时需要严格控制n(HNO3):n(H2SO4)=
(2)步骤④中,该反应的离子方程式为
(3)若在实验室中用98%的浓H2SO4配制步骤③所需的稀H2SO4 1000 mL所需的仪器有:
您最近一年使用:0次



