名校
解题方法
1 . 足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和二氧化氮、一氧化氮的混合气体2.24L(标准状况),这些气体与一定体积(标准状况)氧气混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·L-1氢氧化钠溶液至铜离子恰好完全沉淀,则消耗氢氧化钠溶液的体积是50mL,下列说法正确的是
| A.混合气体中含二氧化氮1.12L |
| B.消耗氧气的体积为1.68L |
| C.此反应过程中转移的电子为0.3mol |
| D.参加反应的硝酸是0.4mol |
您最近一年使用:0次
2021-08-25更新
|
794次组卷
|
30卷引用:2018届高三一轮复习化学:考点21-铜及其化合物性质探究
2018届高三一轮复习化学:考点21-铜及其化合物性质探究(已下线)2015届宁夏银川一中高三第四次月考化学试卷2014-2015吉林省松原市扶余县一中高一上学期期末化学试卷2015届山东省滕州市三中上学期高三第四次月考理综化学试卷2016届河南省扶沟县高级中学高三上学期开学考试化学试卷2016届河南省三门峡市陕州中学高三上学期第一次精英对抗赛化学试卷2016届重庆市万州第二高级中学高三上学期期中测试理综化学试卷2015-2016学年河北省冀州中学高一下开学考试化学试卷2016届河南省信阳市鸡公山风景区学校高三下2月月考化学试卷2015-2016学年安徽省六安一中高一下周末作业二化学试卷2015-2016学年安徽师大附中高一下学期期中考查化学试卷2015-2016学年山东省淄博六中高一下学科竞赛化学试卷2017届广西桂林市第十八中学高三上第二次月考化学试卷(已下线)《考前20天终极攻略》-5月26日 元素及其化合物福建省三明市第一中学2018-2019学年高二上学期开学考化学试题云南省新平县一中2018-2019学年高一上学期12月月考化学试题贵州省黔南布依族苗族自治州龙里中学2019-2020学年高一上学期期末考试化学试题辽宁省大连市一〇三中学2019-2020学年高一下学期期中考试化学试题河南省漯河市临颍县南街高级中学2020届高三阶段性测试化学试题安徽省芜湖市2021届高三第二次月考化学试题江西省高安中学2020-2021学年高一上学期期末考试化学试题四川省邻水实验学校2020-2021学年高一下学期第一次月考化学试题福建省福州第三中学2020-2021学年高一下学期期中考化学试题(已下线)专题02 氮及其化合物【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 浙江省诸暨市第二高级中学2020-2021学年高二下学期期中考试化学试题内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题重庆市第七中学校2021-2022学年高一下学期3月月考化学试题云南省普洱市镇沅彝族哈尼族拉祜族自治县第一中学2021-2022学年高一下学期4月份考试化学试题湖南省怀化市沅陵县第一中学2021-2022学年高一下学期第一次月考化学试题
解题方法
2 . 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,发生如下反应:
3S + 6KOH 2K2S+ K2SO3+3H2O
2K2S+ K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
K2Sx(x=2~6)
S+ K2SO3 K2S2O3
K2S2O3
请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=_______ mL。
(2)3.840 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=_______ 。
3S + 6KOH
 2K2S+ K2SO3+3H2O
2K2S+ K2SO3+3H2O(x-1)S+K2S
 K2Sx(x=2~6)
K2Sx(x=2~6)S+ K2SO3
 K2S2O3
K2S2O3请计算:
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=
(2)3.840 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=
您最近一年使用:0次
3 . 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)(2016·衡阳一中高三3月月考)高铁酸钾有以下几种常见制备方法:
干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
电解法 制备中间产物Na2FeO4,再与KOH溶液反应
①干法制备K2FeO4的化学方程式为_____________________________________ ,
氧化剂与还原剂的物质的量之比为____________ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______________________________________ 。
(2)(2016·青岛高三上学期期末)工业上常采用NaClO氧化法生产高铁酸钾,反应原理为
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为_________________________________________________________________ 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH===K2FeO4+2NaOH,K2FeO4在水溶液中易水解:4FeO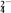 +10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________ 溶液(填序号)。
A.水 B.NH4Cl、异丙醇
C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
(1)(2016·衡阳一中高三3月月考)高铁酸钾有以下几种常见制备方法:
干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
电解法 制备中间产物Na2FeO4,再与KOH溶液反应
①干法制备K2FeO4的化学方程式为
氧化剂与还原剂的物质的量之比为
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:
(2)(2016·青岛高三上学期期末)工业上常采用NaClO氧化法生产高铁酸钾,反应原理为
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH===K2FeO4+2NaOH,K2FeO4在水溶液中易水解:4FeO
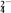 +10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用A.水 B.NH4Cl、异丙醇
C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
您最近一年使用:0次



