名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: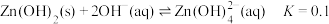 ;
;
②室温下,部分离子浓度的对数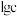 与
与 的关系如下图所示(其中
的关系如下图所示(其中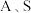 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物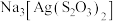 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: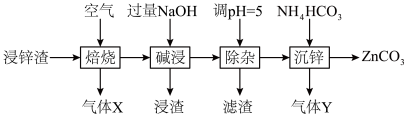
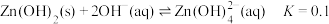 ;
;②室温下,部分离子浓度的对数
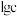 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):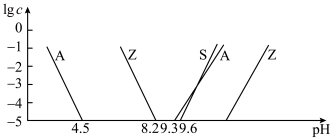
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
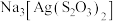 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次
7日内更新
|
122次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
解题方法
2 . CH4既是一种重要的能源,也是一种重要的化工原料。
(1)已知8.0gCH4完全燃烧生成液体水放出444.8kJ热量。
CH4(g)+202(g)=CO2(g)+2H2O(1) ∆H=___________ kJ·mol-1。
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为___________ ,通入b气体的电极反应式为___________ 。(质子交换膜只允许H'通过)___________ ℃左右。
②该反应催化剂的有效成分为CuAlO2,其用氧化物的形式表示为mCu2O·nAl2O3.m:n=___________ 。
(4)CH4还原法是处理NOx气体的一种方法。一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为___________ 。
(1)已知8.0gCH4完全燃烧生成液体水放出444.8kJ热量。
CH4(g)+202(g)=CO2(g)+2H2O(1) ∆H=
(2)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为
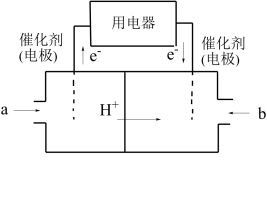
②该反应催化剂的有效成分为CuAlO2,其用氧化物的形式表示为mCu2O·nAl2O3.m:n=
(4)CH4还原法是处理NOx气体的一种方法。一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为
您最近半年使用:0次
3 . 有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:
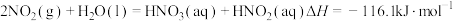
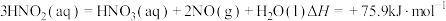
反应 的
的
___________  。
。
(2)用稀硝酸吸收 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:___________ 。( 是弱酸)
是弱酸)
(3)用酸性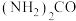 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与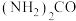 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:___________ 。
(4)在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 。
。
① 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为___________  。
。
②将一定比例的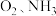 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
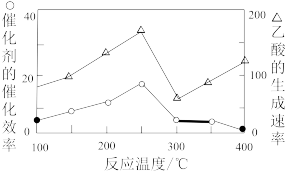
的反应器中反应(装置见图): 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在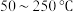 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是___________ 。 (氯的化合价为
(氯的化合价为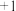 价),其原理是
价),其原理是
 接电源的
接电源的___________ (填“正”或“负”)极。
②阳极反应式是___________ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下: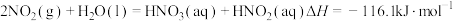
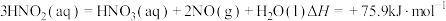
反应
 的
的
 。
。(2)用稀硝酸吸收
 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式: 是弱酸)
是弱酸)(3)用酸性
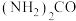 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与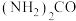 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:(4)在有氧条件下,新型催化剂
 能催化
能催化 与
与 反应生成
反应生成 。
。①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为 。
。②将一定比例的
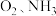 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图):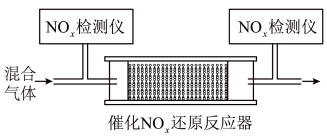
 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在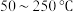 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是
 (氯的化合价为
(氯的化合价为 价),其原理是
价),其原理是
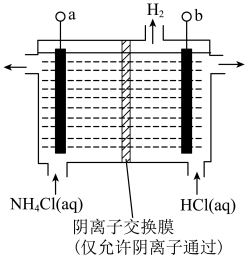
 接电源的
接电源的②阳极反应式是
您最近半年使用:0次
名校
解题方法
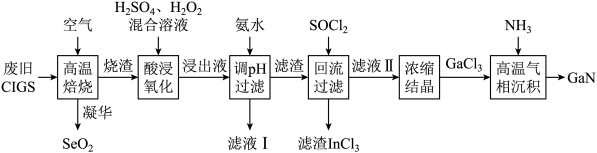
4 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2.某探究小组回收处理流程如下:
(1)硒(Se)与硫为同族相邻元素,Se在元素周期表中的位置为___________ ;稳定性:H2Se___________ H2S(填“大于”或“小于”)。
(2)镓(Ga)和铟(In)位于元素周期表第ⅢA族,CuIn0.5Ga0.5Se2中Cu的化合价为___________ 。
(3)“酸浸氧化”发生的主要氧化还原反应为Cu2O+H2O2+H2SO4→CuSO4+H2O(未配平),参加反应的氧化剂与还原剂的质量比为___________ 。“酸浸氧化”时的温度不宜过高,可能的原因是___________ 。
(4)加入氨水时开始会生成蓝色沉淀,反应的离子方程式为___________ 。
(5)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中 是否洗净的操作为
是否洗净的操作为___________ 。
(6)“高温气相沉积”过程中发生的化学反应方程式为___________ 。
(1)硒(Se)与硫为同族相邻元素,Se在元素周期表中的位置为
(2)镓(Ga)和铟(In)位于元素周期表第ⅢA族,CuIn0.5Ga0.5Se2中Cu的化合价为
(3)“酸浸氧化”发生的主要氧化还原反应为Cu2O+H2O2+H2SO4→CuSO4+H2O(未配平),参加反应的氧化剂与还原剂的质量比为
(4)加入氨水时开始会生成蓝色沉淀,反应的离子方程式为
(5)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中
 是否洗净的操作为
是否洗净的操作为(6)“高温气相沉积”过程中发生的化学反应方程式为
您最近半年使用:0次
2024-04-30更新
|
116次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高一下学期期中考试化学试题(A)
名校
解题方法
5 . 以焙烧黄铁矿(FeS2,杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料,工艺流程如图。
颜料,工艺流程如图。
(1)写出两种能够提高酸浸率的措施___________ 。
(2)红渣的主要成分是___________ (填化学式),焙烧黄铁矿过程中若产生8.96 L(标准状况)SO2,则反应中转移电子的数目为___________ 。
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为___________ 。
(4)“一系列操作”包括___________ 、___________ 、过滤。
(5)简述洗涤铵铁蓝沉淀的操作:___________ 。
 颜料,工艺流程如图。
颜料,工艺流程如图。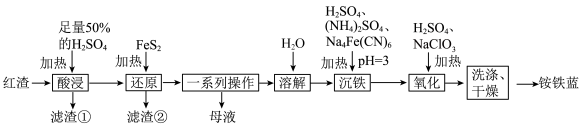
(1)写出两种能够提高酸浸率的措施
(2)红渣的主要成分是
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为
(4)“一系列操作”包括
(5)简述洗涤铵铁蓝沉淀的操作:
您最近半年使用:0次
名校
6 . 氮的化合物是重要的化工原料,也是空气污染物的重要来源,其转化一直是化学研究的热点。
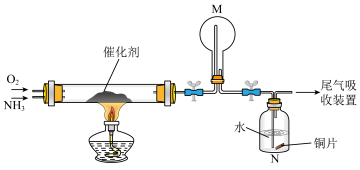
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示: 。分别生成含等物质的量氮元素的NO和
。分别生成含等物质的量氮元素的NO和 时,各自消耗的
时,各自消耗的 的物质的量之比为
的物质的量之比为___________ 。
②一段时间后,观察到装置M中有白烟生成,该白烟成分是___________ (写化学式)。
③再经过一段时间观察到装置N中溶液变成蓝色,装置N中溶液变成蓝色的原因是___________ 。
(2)可用 将氮氧化物转化成
将氮氧化物转化成 。向1 L含200mg
。向1 L含200mg  的溶液中加入NaOH溶液调节至碱性,
的溶液中加入NaOH溶液调节至碱性, 转化为去除氮氧化物效果更好的
转化为去除氮氧化物效果更好的 ,再通入NO气体进行反应。碱性条件下
,再通入NO气体进行反应。碱性条件下 去除NO反应的离子方程式为
去除NO反应的离子方程式为___________ 。
(3)纳米铁粉可去除水中的 。控制其他条件不变,用纳米铁粉还原水体中的
。控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示:
)浓度随时间变化如图所示: 的机理:
的机理: 得到纳米铁粉失去的电子转化为
得到纳米铁粉失去的电子转化为 ,极少量
,极少量 在纳米铁粉或Cu表面得到电子转化为
在纳米铁粉或Cu表面得到电子转化为 。与不添加少量铜粉相比,添加少量铜粉时去除
。与不添加少量铜粉相比,添加少量铜粉时去除 效率更高,主要原因是
效率更高,主要原因是___________ 。
②与初始溶液中 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是___________ 。
(4)NO也可以利用电化学手段将其转化为 脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是
脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是___________ 。
(1)氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如图所示:
 。分别生成含等物质的量氮元素的NO和
。分别生成含等物质的量氮元素的NO和 时,各自消耗的
时,各自消耗的 的物质的量之比为
的物质的量之比为②一段时间后,观察到装置M中有白烟生成,该白烟成分是
③再经过一段时间观察到装置N中溶液变成蓝色,装置N中溶液变成蓝色的原因是
(2)可用
 将氮氧化物转化成
将氮氧化物转化成 。向1 L含200mg
。向1 L含200mg  的溶液中加入NaOH溶液调节至碱性,
的溶液中加入NaOH溶液调节至碱性, 转化为去除氮氧化物效果更好的
转化为去除氮氧化物效果更好的 ,再通入NO气体进行反应。碱性条件下
,再通入NO气体进行反应。碱性条件下 去除NO反应的离子方程式为
去除NO反应的离子方程式为(3)纳米铁粉可去除水中的
 。控制其他条件不变,用纳米铁粉还原水体中的
。控制其他条件不变,用纳米铁粉还原水体中的 ,测得溶液中含氮物质(
,测得溶液中含氮物质( 、
、 、
、 )浓度随时间变化如图所示:
)浓度随时间变化如图所示: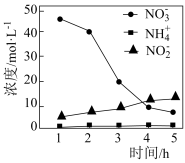
 的机理:
的机理: 得到纳米铁粉失去的电子转化为
得到纳米铁粉失去的电子转化为 ,极少量
,极少量 在纳米铁粉或Cu表面得到电子转化为
在纳米铁粉或Cu表面得到电子转化为 。与不添加少量铜粉相比,添加少量铜粉时去除
。与不添加少量铜粉相比,添加少量铜粉时去除 效率更高,主要原因是
效率更高,主要原因是②与初始溶液中
 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质( 、
、 、
、 )总浓度减小,原因是
)总浓度减小,原因是(4)NO也可以利用电化学手段将其转化为
 脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是
脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是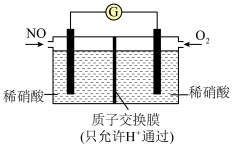
您最近半年使用:0次
解题方法
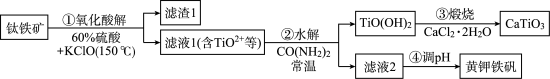
7 .  是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾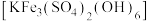 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
(1) 中Ti的化合价为
中Ti的化合价为_______ 。
(2)步骤①滤渣1的主要成分是_______ ,若氧化酸解的氧化剂用 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为_______ ,相同条件下,用 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是_______ 。
(3)已知 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为_______ ;常温下,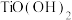
 为
为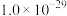 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为_______ 。
(4)步骤③反应的化学方程式为_______ ,若在实验室煅烧,用到的实验仪器除了玻璃棒、酒精灯、三脚架及泥三角外,还需要_______ 。
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
 是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾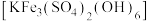 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
| 物质 | 纯碱(99% ) ) | 氢氧化钾(90% ) ) | 碳酸钾(99% ) ) | 液氨(99.9%) |
| 价格(元/吨) | 1800 | 4000 | 4500 | 25000 |
 中Ti的化合价为
中Ti的化合价为(2)步骤①滤渣1的主要成分是
 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是(3)已知
 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为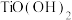
 为
为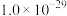 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为(4)步骤③反应的化学方程式为
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
A. | B. | C. | D. |
您最近半年使用:0次
2024-03-28更新
|
101次组卷
|
3卷引用:2024届四川省雅安市高三上学期第一次诊断性考试理综试题
解题方法
8 . ClO2是新一代高效安全的杀菌剂,可用于自来水消毒。由于其浓度过高时易分解,常将其转化成NaClO2晶体以便储运。亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸张漂白、食品消毒、水处理等,消毒时本身被还原成Cl-。亚氯酸钠晶体的一种生产工艺如图:
②H2O受热易分解。
(1)向“反应器”中鼓入空气的作用是______ 。
(2)“吸收塔”的作用是将产生的ClO2转化为NaClO2,在此过程中加入的H2O2的作用是_____ (填“氧化剂”或“还原剂”),当有1molH2O2参与该反应时,反应转移的电子数为______ 。
(3)“吸收塔”中需要控制温度不超过20℃,其原因是______ 。
(4)写出“反应器”步骤中生成ClO2的离子方程式______ 。
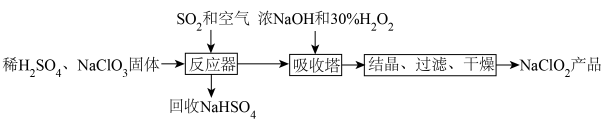
②H2O受热易分解。
(1)向“反应器”中鼓入空气的作用是
(2)“吸收塔”的作用是将产生的ClO2转化为NaClO2,在此过程中加入的H2O2的作用是
(3)“吸收塔”中需要控制温度不超过20℃,其原因是
(4)写出“反应器”步骤中生成ClO2的离子方程式
您最近半年使用:0次
名校
解题方法
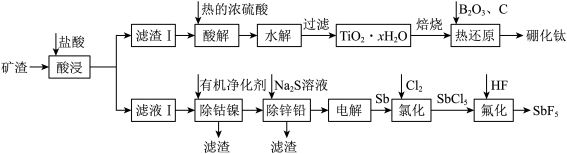
9 . 硼化钛强度高、硬度大,广泛应用于机械制造领域;五氟化锑(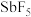 )是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含
)是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含 、
、 、
、 、
、 、
、 、
、 )为原料制取硼化钛和五氟化锑的流程如图所示。
)为原料制取硼化钛和五氟化锑的流程如图所示。
已知:① 性质较稳定,加热时可溶于浓硫酸中形成
性质较稳定,加热时可溶于浓硫酸中形成 。
。
②25℃时, 、
、 的
的 分别为
分别为 ,
,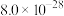 。
。
(1)“水解”步骤中对应的离子方程式为___________ 。为了使水解趋于完全,可采取的措施有___________ 。
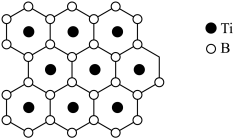
(2)硼化钛有类似石墨的层状结构,硼原子平面和钛原子平面在晶体结构中交替出现,形成二维网状结构,其投影图如下,硼化钛的化学式为___________ 。“热还原”步骤中使用电弧炉高温加热装置(1450~1550℃),每消耗1mol 转移电子数为
转移电子数为___________ 。
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理表示为:
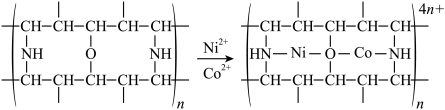
 ,
, 能发生上述转化而
能发生上述转化而 不能,推测可能的原因为
不能,推测可能的原因为___________ 。
(4)已知滤液I中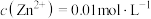 ,
,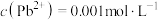 。“除锌铅”步骤中,缓慢滴加稀
。“除锌铅”步骤中,缓慢滴加稀 溶液,先产生的沉淀是(填化学式)
溶液,先产生的沉淀是(填化学式)___________ ;当 、
、 共沉时,先沉淀的物质是否已经沉淀完全(离子浓度
共沉时,先沉淀的物质是否已经沉淀完全(离子浓度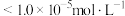 )
)___________ (填“是”或“否”)。
(5)1986年化学家用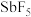 和
和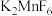 反应,首次实现了用非电解法制取
反应,首次实现了用非电解法制取 ,同时生成
,同时生成 ,已知该过程中
,已知该过程中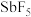 接受了一个
接受了一个 的电子对,请写出该反应的化学方程式
的电子对,请写出该反应的化学方程式___________ 。
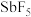 )是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含
)是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含 、
、 、
、 、
、 、
、 、
、 )为原料制取硼化钛和五氟化锑的流程如图所示。
)为原料制取硼化钛和五氟化锑的流程如图所示。
已知:①
 性质较稳定,加热时可溶于浓硫酸中形成
性质较稳定,加热时可溶于浓硫酸中形成 。
。②25℃时,
 、
、 的
的 分别为
分别为 ,
,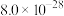 。
。(1)“水解”步骤中对应的离子方程式为
(2)硼化钛有类似石墨的层状结构,硼原子平面和钛原子平面在晶体结构中交替出现,形成二维网状结构,其投影图如下,硼化钛的化学式为
 转移电子数为
转移电子数为
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理表示为:

 ,
, 能发生上述转化而
能发生上述转化而 不能,推测可能的原因为
不能,推测可能的原因为(4)已知滤液I中
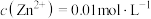 ,
,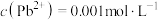 。“除锌铅”步骤中,缓慢滴加稀
。“除锌铅”步骤中,缓慢滴加稀 溶液,先产生的沉淀是(填化学式)
溶液,先产生的沉淀是(填化学式) 、
、 共沉时,先沉淀的物质是否已经沉淀完全(离子浓度
共沉时,先沉淀的物质是否已经沉淀完全(离子浓度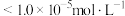 )
)(5)1986年化学家用
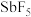 和
和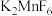 反应,首次实现了用非电解法制取
反应,首次实现了用非电解法制取 ,同时生成
,同时生成 ,已知该过程中
,已知该过程中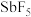 接受了一个
接受了一个 的电子对,请写出该反应的化学方程式
的电子对,请写出该反应的化学方程式
您最近半年使用:0次
解题方法
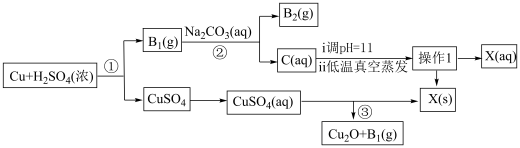
10 . 一种制备 的工艺路线如图所示
的工艺路线如图所示
已知:ⅰ.常温下, 的电离平衡常数
的电离平衡常数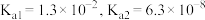
ⅱ.反应②所得C溶液 在
在 之间
之间
ⅲ.反应③需及时补加 以保持反应在
以保持反应在 条件下进行。
条件下进行。
(1)反应①中氧化剂与还原剂物质的量之比为___________ ,溶液C的溶质为___________ (填化学式)。
(2)低温真空蒸发主要目的是___________ ,操作1的名称为___________ 。
(3)写出流程中可以循环利用的物质___________ (填化学式)。
(4)写出反应③的化学反应方程式___________ 。
(5)若 产量不变,参与反应③的X与
产量不变,参与反应③的X与 物质的量之比
物质的量之比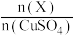 增大时,需补加
增大时,需补加 的量
的量___________ (填“减少”或“增多”或“不变”)。
 的工艺路线如图所示
的工艺路线如图所示
已知:ⅰ.常温下,
 的电离平衡常数
的电离平衡常数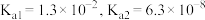
ⅱ.反应②所得C溶液
 在
在 之间
之间ⅲ.反应③需及时补加
 以保持反应在
以保持反应在 条件下进行。
条件下进行。(1)反应①中氧化剂与还原剂物质的量之比为
(2)低温真空蒸发主要目的是
(3)写出流程中可以循环利用的物质
(4)写出反应③的化学反应方程式
(5)若
 产量不变,参与反应③的X与
产量不变,参与反应③的X与 物质的量之比
物质的量之比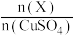 增大时,需补加
增大时,需补加 的量
的量
您最近半年使用:0次



