名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: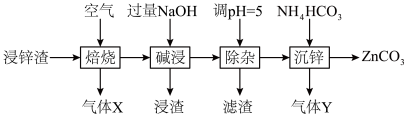
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):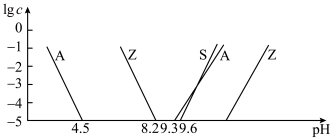
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
212次组卷
|
2卷引用:2024届四川省射洪中学校高三下学期二模理综试题-高中化学
名校
解题方法
2 . 以焙烧黄铁矿(FeS2,杂质为石英等)产生的红渣为原料制备铵铁蓝 颜料,工艺流程如图。
颜料,工艺流程如图。
(1)写出两种能够提高酸浸率的措施___________ 。
(2)红渣的主要成分是___________ (填化学式),焙烧黄铁矿过程中若产生8.96 L(标准状况)SO2,则反应中转移电子的数目为___________ 。
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为___________ 。
(4)“一系列操作”包括___________ 、___________ 、过滤。
(5)简述洗涤铵铁蓝沉淀的操作:___________ 。
 颜料,工艺流程如图。
颜料,工艺流程如图。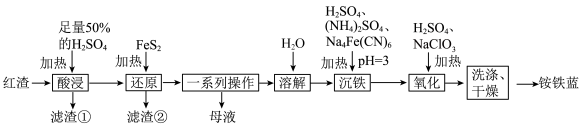
(1)写出两种能够提高酸浸率的措施
(2)红渣的主要成分是
(3)若“滤渣②”的成分中含有S单质,则生成S单质的离子方程式为
(4)“一系列操作”包括
(5)简述洗涤铵铁蓝沉淀的操作:
您最近一年使用:0次
解题方法
3 .  是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾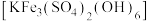 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
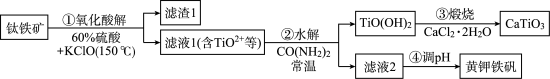
部分原料价格表:
(1) 中Ti的化合价为
中Ti的化合价为_______ 。
(2)步骤①滤渣1的主要成分是_______ ,若氧化酸解的氧化剂用 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为_______ ,相同条件下,用 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是_______ 。
(3)已知 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为_______ ;常温下,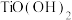
 为
为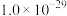 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为_______ 。
(4)步骤③反应的化学方程式为_______ ,若在实验室煅烧,用到的实验仪器除了玻璃棒、酒精灯、三脚架及泥三角外,还需要_______ 。
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
 是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾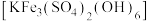 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
| 物质 | 纯碱(99% ) ) | 氢氧化钾(90% ) ) | 碳酸钾(99% ) ) | 液氨(99.9%) |
| 价格(元/吨) | 1800 | 4000 | 4500 | 25000 |
 中Ti的化合价为
中Ti的化合价为(2)步骤①滤渣1的主要成分是
 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是(3)已知
 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为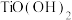
 为
为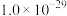 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为(4)步骤③反应的化学方程式为
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
A. | B. | C. | D. |
您最近一年使用:0次
2024-03-28更新
|
111次组卷
|
3卷引用:2024届四川省雅安市高三上学期第一次诊断性考试理综试题
名校
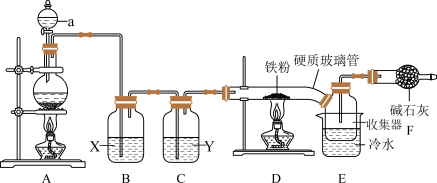
4 .  是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。
回答下列问题:
(1)A中发生的化学反应方程式是___________ 。为使实验顺利进行,可将仪器a更换为恒压滴液漏斗(如上图),更换后优点是___________ 。
(2)试剂“X”是___________ ,其作用是___________ 。
(3)硬质玻璃管直接连接收集器的优点___________ 。
(4)实验开始时,应先点燃A处酒精灯,当___________ 时,再点燃D处酒精灯。
(5)装置F作用是吸收多余氯气和___________ ,氯气和碱石灰反应时,若有0.71g氯气被氧化成次氯酸盐,1.42g氯气被氧化成氯酸盐,则被还原的氯原子的物质的量为___________ 。
 是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。

回答下列问题:
(1)A中发生的化学反应方程式是
(2)试剂“X”是
(3)硬质玻璃管直接连接收集器的优点
(4)实验开始时,应先点燃A处酒精灯,当
(5)装置F作用是吸收多余氯气和
您最近一年使用:0次
名校
5 . Ⅰ.阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)制备 需要在
需要在________ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是________
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
Ⅱ.如图是以铁屑为原料制备 的工艺流程图:
的工艺流程图:

请回答下列问题:
(4)流程图中的吸收剂X为________(填字母)。
(5)氧化剂Y为漂白液的有效成分;反应④的化学方程式中氧化剂与还原剂的物质的量之比为______ 。
(6)写出反应⑤的化学方程式________ 。
| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着  减小,稳定性下降,与水反应放出氧气, 减小,稳定性下降,与水反应放出氧气, 通过强烈的氧化作用可迅速杀灭细菌有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化  水投放: 水投放: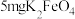 ,即可达到卫生标准 ,即可达到卫生标准 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
Ⅱ.如图是以铁屑为原料制备
 的工艺流程图:
的工艺流程图:
请回答下列问题:
(4)流程图中的吸收剂X为________(填字母)。
A. 溶液 溶液 | B. 粉 粉 | C. 溶液 溶液 | D. 溶液 溶液 |
(5)氧化剂Y为漂白液的有效成分;反应④的化学方程式中氧化剂与还原剂的物质的量之比为
(6)写出反应⑤的化学方程式
您最近一年使用:0次
名校
解题方法
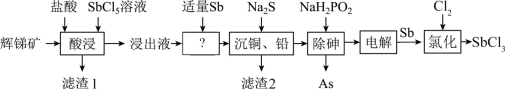
6 . SbCl3用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为的Sb2S3,还含有As2S3、PbS、CuO和SiO2等)为原料制备SbCl3的工艺流程如下:
②常温下, ,
, ;
;
③溶液中离子浓度小于或等于 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。
回答下列问题:
(1)加快辉锑矿“酸浸”的措施有 。
(2)滤渣1中除了S之外,还有__________ 。
(3)浸出液中加入适量Sb的目的是________________________ 。(用化学方程式表示)
(4)已知浸出液中c(Cu2+)=0.01mol/L、c(Pb2+)=0.10mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是__________ (填化学式);常温下,“除铜、铅”时Cu2+和Pb2+均沉淀完全,此时溶液中 不低于
不低于__________ mol/L,Na2S也不宜过多,其原因为__________________ 。
(5)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为___________ ;已知在“电解”SbCl3溶液时,无气体生成,被氧化的Sb元素与被还原的Sb元素的质量之比为3:2,可在上述流程中循环利用的物质有_________________ 。
②常温下,
 ,
, ;
;③溶液中离子浓度小于或等于
 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。回答下列问题:
(1)加快辉锑矿“酸浸”的措施有 。
| A.将辉锑矿粉碎 | B.用酒精灯加热 | C.用玻璃棒搅拌 | D.适当增加酸液浓度 |
(3)浸出液中加入适量Sb的目的是
(4)已知浸出液中c(Cu2+)=0.01mol/L、c(Pb2+)=0.10mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是
 不低于
不低于(5)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为
您最近一年使用:0次
2024-01-13更新
|
451次组卷
|
5卷引用:2024届四川省成都市第七中学高三上学期一诊模拟考试理科综合试卷
名校
解题方法
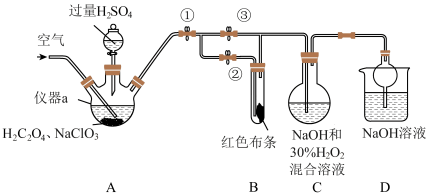
7 . ClO2又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。
(1)仪器a的名称为_______ 。
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为_______ 。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的_______ 性。若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______ 。
(4)D装置的作用是_______ 。
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的_______ 倍(结果保留两位小数)。
(1)仪器a的名称为
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的
(4)D装置的作用是
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的
您最近一年使用:0次
2023-10-04更新
|
230次组卷
|
2卷引用:四川省德阳市外国语学校2023-2024学年高一上学期期末模拟考试化学试题
名校
解题方法
8 . 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,得到标准状况下8.96 L NO和NO2的混合气体及Cu(NO3)2。在所得溶液中加入1.0 mol/L的NaOH溶液1.0 L,恰好使金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法正确的是
| A.硝酸浓度为2.4 mol/L | B.Cu、Cu2O物质的量之比为1:2 |
| C.产生的NO2为0.1 mol | D.固体与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2023-10-01更新
|
132次组卷
|
2卷引用:四川省南充市嘉陵第一中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
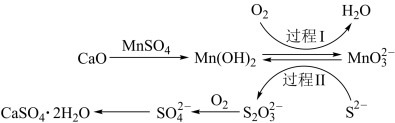
9 . 利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的S2-,制取石膏(CaSO4·2H2O)的过程如下:
下列说法正确的是

下列说法正确的是
A.将10 L上清液中的S2- (S2-的浓度为0.48 g/L)转化为 ,理论上共需要0.3 mol O2 ,理论上共需要0.3 mol O2 |
| B.过程Ⅰ后溶液pH增大 |
C.过程Ⅱ中反应的离子方程式为2S2-+4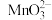 +10H+=4Mn(OH)2+ +10H+=4Mn(OH)2+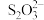 +H2O +H2O |
| D.CaSO4·2H2O属于混合物 |
您最近一年使用:0次
10 . 氢氧化铁、高铁酸盐(如 )均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:
)均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:
第一组:取 饱和
饱和 溶液,慢慢加入
溶液,慢慢加入 的
的 溶液,并不断搅拌;
溶液,并不断搅拌;
第二组:取 饱和
饱和 溶液,滴加12%硫酸酸化的双氧水,再慢慢加入
溶液,滴加12%硫酸酸化的双氧水,再慢慢加入 的
的 溶液;
溶液;
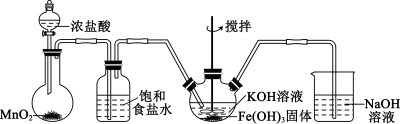
第三组:在第二组实验的基础上用制得的 合成
合成 ,其装置如下(夹持仪器已略去):
,其装置如下(夹持仪器已略去):
已知:① 对双氧水的分解有一定的催化作用;
对双氧水的分解有一定的催化作用;
②氧元素的非金属性大于碘。
回答下列问题:
(1)第一组同学看到的现象是__________ ,不断搅拌的目的是__________ 。
(2)第二组同学滴加双氧水的过程中,观察到溶液颜色变成黄色,其反应的离子方程式为__________ ,在溶液变成黄色的同时,看到不断有气泡产生,其原因是__________ (用化学方程式解释)。
(3)第二组同学完成实验后,及时对烧杯壁上附着的 进行了清洗,但错把氢碘酸
进行了清洗,但错把氢碘酸 当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质
当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质 。他们认为一定是
。他们认为一定是 和
和 反应的过程中,
反应的过程中, 氧化了
氧化了 ,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是
,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是__________ 。
(4)第三组实验装置中的明显缺陷是__________ ,用双线桥表示制备 时的电子转移情况:
时的电子转移情况:__________ 。

生成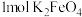 理论上需要标准状态下的
理论上需要标准状态下的
__________ L。
(5)实验发现,在制备氯气时,浓盐酸的实际加入量远超过理论用量,分析出现该情况的原因:_____ 。
 )均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:
)均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:第一组:取
 饱和
饱和 溶液,慢慢加入
溶液,慢慢加入 的
的 溶液,并不断搅拌;
溶液,并不断搅拌;第二组:取
 饱和
饱和 溶液,滴加12%硫酸酸化的双氧水,再慢慢加入
溶液,滴加12%硫酸酸化的双氧水,再慢慢加入 的
的 溶液;
溶液;第三组:在第二组实验的基础上用制得的
 合成
合成 ,其装置如下(夹持仪器已略去):
,其装置如下(夹持仪器已略去):
已知:①
 对双氧水的分解有一定的催化作用;
对双氧水的分解有一定的催化作用;②氧元素的非金属性大于碘。
回答下列问题:
(1)第一组同学看到的现象是
(2)第二组同学滴加双氧水的过程中,观察到溶液颜色变成黄色,其反应的离子方程式为
(3)第二组同学完成实验后,及时对烧杯壁上附着的
 进行了清洗,但错把氢碘酸
进行了清洗,但错把氢碘酸 当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质
当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质 。他们认为一定是
。他们认为一定是 和
和 反应的过程中,
反应的过程中, 氧化了
氧化了 ,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是
,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是(4)第三组实验装置中的明显缺陷是
 时的电子转移情况:
时的电子转移情况:
生成
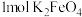 理论上需要标准状态下的
理论上需要标准状态下的
(5)实验发现,在制备氯气时,浓盐酸的实际加入量远超过理论用量,分析出现该情况的原因:
您最近一年使用:0次
2023-01-06更新
|
376次组卷
|
2卷引用:四川省成都市蓉城名校联盟2022-2023学年高一上学期期末联考化学试题



