1 . 有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)用水吸收 的相关热化学方程式如下:
的相关热化学方程式如下:
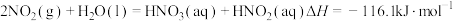
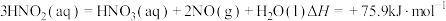
反应 的
的
___________  。
。
(2)用稀硝酸吸收 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:___________ 。( 是弱酸)
是弱酸)
(3)用酸性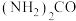 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与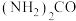 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:___________ 。
(4)在有氧条件下,新型催化剂 能催化
能催化 与
与 反应生成
反应生成 。
。
① 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为___________  。
。
②将一定比例的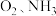 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图): 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在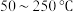 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是___________ 。 (氯的化合价为
(氯的化合价为 价),其原理是
价),其原理是
 接电源的
接电源的___________ (填“正”或“负”)极。
②阳极反应式是___________ 。
 是环境保护的重要课题。
是环境保护的重要课题。(1)用水吸收
 的相关热化学方程式如下:
的相关热化学方程式如下: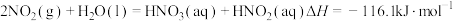
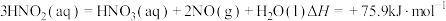
反应
 的
的
 。
。(2)用稀硝酸吸收
 ,得到
,得到 和
和 的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式:
的混合溶液,电解该混合溶液可获得较浓的硝酸,写出电解时阳极的电极反应式: 是弱酸)
是弱酸)(3)用酸性
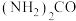 水溶液吸收
水溶液吸收 ,吸收过程中存在
,吸收过程中存在 与
与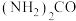 生成
生成 和
和 的反应,写出该反应的化学方程式:
的反应,写出该反应的化学方程式:(4)在有氧条件下,新型催化剂
 能催化
能催化 与
与 反应生成
反应生成 。
。①
 与
与 生成
生成 的反应中,当生成
的反应中,当生成 时,转移的电子数为
时,转移的电子数为 。
。②将一定比例的
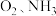 和
和 的混合气体,匀速通入装有催化剂
的混合气体,匀速通入装有催化剂 的反应器中反应(装置见图):
的反应器中反应(装置见图):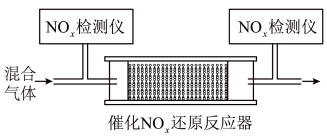
 的去除率随反应温度的变化曲线如图所示,在
的去除率随反应温度的变化曲线如图所示,在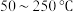 范围内随着温度的升高,
范围内随着温度的升高, 的去除率先迅速上升后缓慢上升的主要原因是
的去除率先迅速上升后缓慢上升的主要原因是
 (氯的化合价为
(氯的化合价为 价),其原理是
价),其原理是
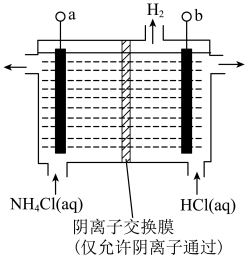
 接电源的
接电源的②阳极反应式是
您最近一年使用:0次
名校
2 . ClO2已被世界卫生组织(WHO)列为AI级的安全高效灭菌消毒剂,我国从2000年起就逐渐用ClO2取代 对饮用水进行消毒。下图是某实验室用于制备一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。
对饮用水进行消毒。下图是某实验室用于制备一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。

已知:
①实验室可用亚氯酸钠固体(Na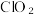 )与氯气反应来制备ClO2
)与氯气反应来制备ClO2
②通常情况下,ClO2是一种有刺激性气味的黄绿色气体,常温下1L水约溶解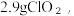 遇热水不稳定,其熔点为-59.5℃,沸点为11℃。请回答:
遇热水不稳定,其熔点为-59.5℃,沸点为11℃。请回答:
(1)盛放浓盐酸的仪器名称是______ 。
(2)写出A装置中发生反应的化学反应方程式并用单线桥标明电子转移的方向和数目______ 。
(3)写出D中制备ClO2反应的化学反应方程式______ 。
(4)下列操作或描述正确的是______。
(5)C中所盛试剂是______ ,B装置的作用是______ (写出两点作用即可)。
(6)已知氯气与氢氧化钠溶液在较低温度下生成 和
和 O,在较高温度下生成
O,在较高温度下生成 和
和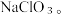 在一定温度下,将一定量氯气通入氢氧化钠溶液中,溶液中生成的
在一定温度下,将一定量氯气通入氢氧化钠溶液中,溶液中生成的 O⁻和
O⁻和 个数之比为5:2,则该反应中氧化剂与还原剂质量之比为
个数之比为5:2,则该反应中氧化剂与还原剂质量之比为______
 对饮用水进行消毒。下图是某实验室用于制备一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。
对饮用水进行消毒。下图是某实验室用于制备一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。
已知:
①实验室可用亚氯酸钠固体(Na
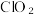 )与氯气反应来制备ClO2
)与氯气反应来制备ClO2②通常情况下,ClO2是一种有刺激性气味的黄绿色气体,常温下1L水约溶解
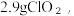 遇热水不稳定,其熔点为-59.5℃,沸点为11℃。请回答:
遇热水不稳定,其熔点为-59.5℃,沸点为11℃。请回答:(1)盛放浓盐酸的仪器名称是
(2)写出A装置中发生反应的化学反应方程式并用单线桥标明电子转移的方向和数目
(3)写出D中制备ClO2反应的化学反应方程式
(4)下列操作或描述正确的是______。
| A.装置A中导气管a起平衡气压作用,可以使浓盐酸顺利流下 |
| B.A装置中的高锰酸钾可用二氧化锰替代 |
| C.E装置用以收集ClO2,宜采用冰水浴冷却 |
| D.F可起防倒吸作用,若用氢氧化钠溶液吸收尾气,只含一种溶质 |
(5)C中所盛试剂是
(6)已知氯气与氢氧化钠溶液在较低温度下生成
 和
和 O,在较高温度下生成
O,在较高温度下生成 和
和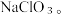 在一定温度下,将一定量氯气通入氢氧化钠溶液中,溶液中生成的
在一定温度下,将一定量氯气通入氢氧化钠溶液中,溶液中生成的 O⁻和
O⁻和 个数之比为5:2,则该反应中氧化剂与还原剂质量之比为
个数之比为5:2,则该反应中氧化剂与还原剂质量之比为
您最近一年使用:0次
名校
解题方法
3 . 向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,得到标准状况下8.96 L NO和NO2的混合气体及Cu(NO3)2。在所得溶液中加入1.0 mol/L的NaOH溶液1.0 L,恰好使金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法正确的是
| A.硝酸浓度为2.4 mol/L | B.Cu、Cu2O物质的量之比为1:2 |
| C.产生的NO2为0.1 mol | D.固体与硝酸反应后剩余HNO3为0.2 mol |
您最近一年使用:0次
2023-10-01更新
|
132次组卷
|
2卷引用:天津市南开中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
4 . 汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
| A.生成42.0LN2(标准状况) | B.有0.25molKNO3被氧化 |
| C.转移电子的物质的量为1.25mol | D.被还原的N原子的物质的量为3.75mol |
您最近一年使用:0次
2023-03-05更新
|
424次组卷
|
3卷引用:天津市区重点中学2023届高三毕业班联考(一)化学试题
天津市区重点中学2023届高三毕业班联考(一)化学试题上海市行知中学2022-2023学年高二下学期2月月考化学试题(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
5 . 水热法制备直径为1~100nm的颗粒Y(化合物),反应原理为3Fe2++2S2O +O2+aOH—=Y+S4O
+O2+aOH—=Y+S4O +2H2O,下列说法中错误的是
+2H2O,下列说法中错误的是
 +O2+aOH—=Y+S4O
+O2+aOH—=Y+S4O +2H2O,下列说法中错误的是
+2H2O,下列说法中错误的是| A.a=4 |
| B.将Y均匀分散到水中形成的分散系具有丁达尔效应 |
C.还原剂是Fe2+、S2O |
| D.反应过程中转移电子数为3 |
您最近一年使用:0次
2021-10-22更新
|
185次组卷
|
2卷引用:天津市第二十中学2023-2024学年高一上学期期中考试化学试题
名校
6 . 钠在液氨中溶剂化速度极快,生成蓝色的溶剂合电子,如图为钠投入液氨中的溶剂化图。钠沉入液氨中,快速得到深蓝色溶液,并慢慢产生气泡。下列说法错误的是
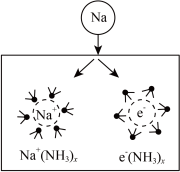

| A.钠的密度比液氨大 |
| B.溶液的导电性增强 |
| C.钠和液氨可发生以下反应:2NH3+2Na=2NaNH2+H2↑ |
| D.0.1mol钠投入液氨生成0.01molH2时,Na共失去0.02mol电子 |
您最近一年使用:0次
2021-05-07更新
|
1587次组卷
|
15卷引用:天津市耀华中学2021-2022学年高三上学期第一次月考化学试题
天津市耀华中学2021-2022学年高三上学期第一次月考化学试题天津市耀华中学2022-2023学年高一上学期期中考试化学试题山东省临沂市部分县区2020-2021学年高一下学期期中考试化学试题广东省广州市广州大学附属中学2020-2021学年高一下学期4月月考试题(已下线)课时14 钠及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点13 钠及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)重庆市第一中学校 2021-2022学年高二上学期入学摸底考试化学试题黑龙江省实验中学2021-2022高三上学期第三次月考(开学考)化学试题浙江省湖州市三贤联盟2021-2022学年高一上学期期中考试化学试题吉林省吉林市普通中学2022-2023学年高三第一次调研测试化学试题吉林省吉林市普通中学2022-2023学年高三上学期10月调研化学试题吉林省延边第二中学2022-2023学年高三上学期10月月考化学试题河南省许昌市禹州市高级中学2023-2024学年高三上学期9月月考化学试题福建省莆田第一中学2023-2024学年高一上学期期末考试化学试题
7 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是
| A.此反应过程中转移了0.5mol的电子 | B.消耗氧气的体积为1.12L(标准状况) |
| C.参加反应的HNO3是0.4mol | D.混合气体中含2.24L(标准状况)NO |
您最近一年使用:0次
2021-04-26更新
|
1138次组卷
|
8卷引用:天津市第二十一中学2020-2021学年高一下学期期中质量检测化学试题
8 . SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下化学反应:①SO2+2Fe3++2H2O=SO +2Fe2++4H+;②Cr2O
+2Fe2++4H+;②Cr2O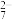 +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
 +2Fe2++4H+;②Cr2O
+2Fe2++4H+;②Cr2O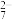 +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是A.氧化性:Cr2O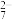 >Fe3+ >Fe3+ |
| B.标准状况下,若有6.72LSO2参加反应,则最终消耗0.2molK2Cr2O7 |
| C.反应②中,每有1molK2Cr2O7参加反应,转移电子的数目为6NA |
D.由上述反应原理推断:K2Cr2O7溶液也可以将SO2氧化成SO |
您最近一年使用:0次
2021-01-27更新
|
496次组卷
|
7卷引用:天津市静海区第一中学2020-2021学年高一上学期期末考试化学试题
名校
解题方法
9 . 亚硝酰硫酸(NOSO4H)是一种浅黄色或蓝紫色液体,遇水分解,溶于浓硫酸不分解,主要用于燃料、医药领域的重氮化反应中取代亚硝酸钠。实验室用如图装置(夹持装置略)制备少量 NOSO4H,并测定产品的纯度。
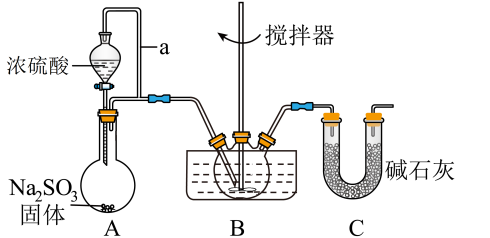
(1)导管a的作用是___________ 。
(2)装置B中浓 HNO3与 SO2 在浓 H2SO4作用下反应制得 NOSO4H。
①该反应必须维持体系温度不得高于 20℃,故可将三颈烧瓶置于___________ 中。
②开始时,反应缓慢,待生成少量NOSO4H 后,温度变化不大,但反应速率明显加快,其原因是___________ 。
③该实验装置存在导致NOSO4H 产量降低的缺陷,请提出改进方案___________ 。
④利用装置A 制备 SO2,下列试剂最适合的是___________ 。
A.Na2SO3固体和 20%硝酸 B.Na2SO3固体和 20%硫酸
C.Na2SO3固体和 70%硫酸 D.Na2SO3固体和 98%硫酸
⑤已知亚硝酸不稳定,易分解,发生反应 2HNO2=NO2↑+NO↑+H2O。请写出NOSO4H遇水分解时发生反应的化学方程式___________ 。
⑥装置 C 的作用是___________ 。
(3)测定亚硝酰硫酸NOSO4H 的纯度。
准确称取1.380g 产品放入250mL的碘量瓶中,加入60.00mL 0.1000mol·L‾1 KMnO4标准溶液和 10mL 25%的 H2SO4溶液,然后摇匀(过程中无气体产生)。用 0.2500 mol·L‾1的草酸钠标准溶液滴定,消耗草酸钠溶液的体积为 20.00mL。已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。亚硝酰硫酸的纯度为___________ 。

(1)导管a的作用是
(2)装置B中浓 HNO3与 SO2 在浓 H2SO4作用下反应制得 NOSO4H。
①该反应必须维持体系温度不得高于 20℃,故可将三颈烧瓶置于
②开始时,反应缓慢,待生成少量NOSO4H 后,温度变化不大,但反应速率明显加快,其原因是
③该实验装置存在导致NOSO4H 产量降低的缺陷,请提出改进方案
④利用装置A 制备 SO2,下列试剂最适合的是
A.Na2SO3固体和 20%硝酸 B.Na2SO3固体和 20%硫酸
C.Na2SO3固体和 70%硫酸 D.Na2SO3固体和 98%硫酸
⑤已知亚硝酸不稳定,易分解,发生反应 2HNO2=NO2↑+NO↑+H2O。请写出NOSO4H遇水分解时发生反应的化学方程式
⑥装置 C 的作用是
(3)测定亚硝酰硫酸NOSO4H 的纯度。
准确称取1.380g 产品放入250mL的碘量瓶中,加入60.00mL 0.1000mol·L‾1 KMnO4标准溶液和 10mL 25%的 H2SO4溶液,然后摇匀(过程中无气体产生)。用 0.2500 mol·L‾1的草酸钠标准溶液滴定,消耗草酸钠溶液的体积为 20.00mL。已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。亚硝酰硫酸的纯度为
您最近一年使用:0次
10 . 有一混合溶液,其中只含有Fe2+、Cl-、Br-、I- (忽略水的电离),Cl-、Br-、I- 的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为
| A.7:4 | B.7:3 | C.7:2 | D.7:1 |
您最近一年使用:0次
2020-08-20更新
|
1245次组卷
|
33卷引用:天津市南开中学2020届高三第二次月考化学试题
天津市南开中学2020届高三第二次月考化学试题(已下线)2010年湖北省监利县一中2011届高三八月月考化学试题(已下线)2011届年山东省淄博市重点中学高三上学期期中考试化学试卷(已下线)2010~2011学年河北省唐山一中高二下学期期末考试化学(已下线)2012届河北省唐山一中高三上学期期中考试化学试卷(已下线)2012届辽宁省铁岭中学高三上学期第三次月考化学试卷2014届河北省衡水中学高三上学期一调考试化学试卷(已下线)2014届江西省师大附中高三上学期期中考试化学试卷(已下线)2014届江西省师大附中高三上学期期中考试化学试卷2015届辽宁省丹东市高三总复习质量测试(一)理综化学试卷2016届甘肃省天水市第一中学高三上学期期中测试化学试卷2017届江西省鹰潭一中高三上学期第二次月考化学试卷2017届甘肃省天水一中高三上学期12月月考化学卷2017届甘肃省天水一中高三上12月月考化学试卷江西省鹰潭市2017-2018学年高一上学期期末质量检测化学试题【全国百强校】山东省济南市历城第二中学2019届高三上学期11月调研检测化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第2讲 氯及其化合物 (题型专练)山西省晋中市平遥县第二中学2020届高三10月月考化学试题江苏省常州市第一中学2019-2020学年高一上学期期中考试化学试题河南省鹤壁市淇滨高级中学2019-2020学年高一上学期期中考试化学试题江西省宜春九中(外国语学校)2019-2020学年高一上学期第二次月考化学试题2020届高考化学知识点必练——氧化还原反应的规律夯基提能2020届高三化学选择题对题专练——氧化还原反应的综合分析(基础过关)湖南省长沙市湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题湖南师范大学附属中学2019-2020学年高二上学期入学考试化学试题黑龙江省哈尔滨市第六中学校2021届高三上学期开学考试化学试题吉林省白城市洮南市第一中学2021届高三上学期第一次月考化学试题(已下线)江西省宜丰中学2018_2019学年高一化学上学期期末考试试卷黑龙江省大庆中学2021届高三10月月考化学试题安徽省池州市第一中学2021届高三上学期9月月考化学试题黑龙江省鹤岗市第一中学2020-2021学年高二6月月考化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题河南省鹤壁高中2021-2022学年高三上学期一轮复习第二次质量检测化学试题



