名校
解题方法
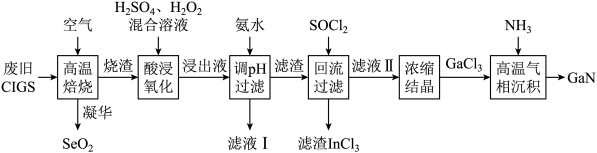
1 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2.某探究小组回收处理流程如下:
(1)硒(Se)与硫为同族相邻元素,Se在元素周期表中的位置为___________ ;稳定性:H2Se___________ H2S(填“大于”或“小于”)。
(2)镓(Ga)和铟(In)位于元素周期表第ⅢA族,CuIn0.5Ga0.5Se2中Cu的化合价为___________ 。
(3)“酸浸氧化”发生的主要氧化还原反应为Cu2O+H2O2+H2SO4→CuSO4+H2O(未配平),参加反应的氧化剂与还原剂的质量比为___________ 。“酸浸氧化”时的温度不宜过高,可能的原因是___________ 。
(4)加入氨水时开始会生成蓝色沉淀,反应的离子方程式为___________ 。
(5)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中 是否洗净的操作为
是否洗净的操作为___________ 。
(6)“高温气相沉积”过程中发生的化学反应方程式为___________ 。
(1)硒(Se)与硫为同族相邻元素,Se在元素周期表中的位置为
(2)镓(Ga)和铟(In)位于元素周期表第ⅢA族,CuIn0.5Ga0.5Se2中Cu的化合价为
(3)“酸浸氧化”发生的主要氧化还原反应为Cu2O+H2O2+H2SO4→CuSO4+H2O(未配平),参加反应的氧化剂与还原剂的质量比为
(4)加入氨水时开始会生成蓝色沉淀,反应的离子方程式为
(5)“滤渣”与SOCl2混合前需要洗涤、干燥,检验滤渣中
 是否洗净的操作为
是否洗净的操作为(6)“高温气相沉积”过程中发生的化学反应方程式为
您最近一年使用:0次
2024-04-30更新
|
139次组卷
|
2卷引用:湖北省新高考联考协作体2023-2024学年高一下学期期中考试化学试题(A)
名校
2 . 有A、B两种常见化合物,其焰色试验均呈黄色,C是一种单质气体,相互转化关系如下图所示(部分生成物已略去)。回答下列问题:

(1)A的化学式为_______ ,用化学方程式表示A的用途_______ ,上述反应消耗2mol A时,制得气体的质量为_______ ,转移电子总数约为_______ 个。
(2)简述鉴别E与纯碱的一种方法_______ 。
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为_______ ,气体产物有_______ 。
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为_______ 或_______ 。

(1)A的化学式为
(2)简述鉴别E与纯碱的一种方法
(3)200℃在密闭装置中加热A、B固体混合物,两者恰好反应,只得到一种固体化合物G和其他气体产物。
①A与B的物质的量之比为
②若只加入0.5mol某一纯净物就可将只含1mol B的溶液转变成只含1mol G的溶液,则该纯净物化学式为
您最近一年使用:0次
解题方法
3 . 氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。工业上用钛铁矿(主要成分为FeTiO3,含有少量的SiO2、MgO等杂质)制备氮化钛的工艺流程如下:
部分物质的熔、沸点
请回答下列问题:
(1)滤渣A的主要成分是___________ (化学式)。
(2) 溶液转化为H2TiO3的离子方程式为
溶液转化为H2TiO3的离子方程式为___________ ,加水稀释、加热的目的分别是___________ 。
(3)由滤液丙制备FePO4的过程中,理论上消耗的17%双氧水与H3PO4的质量比是________ 。
(4)TiCl4制取单质Ti涉及的过程中:①由TiCl4→Ti需在严格隔水、Ar气氛围中进行,原因是___________ ;②反应后得到Mg、MgCl2、Ti的混合物,可采用___________ 方法分离得到Ti。
(5)用氧化还原滴定法测定TiOSO4的含量。先取待测钛液10.00mL酸化后加水稀释至100mL,加过量铝粉,充分振荡,使 还原为
还原为 ,发生的离子方程式为
,发生的离子方程式为___________ ;过滤后,取无色滤液20.00mL,向其中滴入2~3滴KSCN溶液作指示剂,用0.1000mol/L 的标准液进行滴定,原理为
的标准液进行滴定,原理为 ,若用去了30.00mL
,若用去了30.00mL 溶液,则待测钛液中TiOSO4的物质的量浓度是
溶液,则待测钛液中TiOSO4的物质的量浓度是___________ mol/L。

部分物质的熔、沸点
| 物质 | TiCl4 | Mg | MgCl2 | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(1)滤渣A的主要成分是
(2)
 溶液转化为H2TiO3的离子方程式为
溶液转化为H2TiO3的离子方程式为(3)由滤液丙制备FePO4的过程中,理论上消耗的17%双氧水与H3PO4的质量比是
(4)TiCl4制取单质Ti涉及的过程中:①由TiCl4→Ti需在严格隔水、Ar气氛围中进行,原因是
(5)用氧化还原滴定法测定TiOSO4的含量。先取待测钛液10.00mL酸化后加水稀释至100mL,加过量铝粉,充分振荡,使
 还原为
还原为 ,发生的离子方程式为
,发生的离子方程式为 的标准液进行滴定,原理为
的标准液进行滴定,原理为 ,若用去了30.00mL
,若用去了30.00mL 溶液,则待测钛液中TiOSO4的物质的量浓度是
溶液,则待测钛液中TiOSO4的物质的量浓度是
您最近一年使用:0次
名校
解题方法
4 . 某温度下,将氯气Cl2通入氢氧化钾溶液中,发生反应为:Cl2+KOH-KCl+KClO+KClO3+H2O(未配平),得到KCl,KClO,KCO3的混合液,经测定溶液中ClO-与ClO 的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
 的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为
的个数之比为3:4,则被还原的氯原子与被氧化的氯原子的个数之比为| A.23:7 | B.7:23 | C.12:7 | D.7:12 |
您最近一年使用:0次
2023-10-13更新
|
1072次组卷
|
6卷引用:湖北省宜昌市远安县第一高级中学2023-2024学年高一上学期期中考试化学试题
名校
5 . 向 稀
稀 与稀
与稀 的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是
的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是
 稀
稀 与稀
与稀 的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是
的混合溶液中逐渐加入铁粉,已知加入铁粉的质量与产生气体的体积(标准状况)之间的关系如图所示,则下列说法不正确的是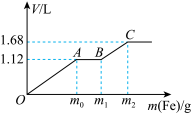
A.OA段产生的气体是NO,BC段产生的气体是 |
B.该实验可以证明氧化性: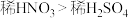 |
C.参加反应铁粉的总质量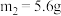 |
D.所用混合溶液中 |
您最近一年使用:0次
2023-04-15更新
|
460次组卷
|
3卷引用:湖北省鄂东南重点中学2022-2023学年高一下学期期中联考化学试题
解题方法
6 . 近几年,我国汽车工业得到了飞速发展,新能源汽车走在世界前列。回答下列问题:
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为_______ 。
(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为_______ 作为汽车燃料最好,简述理由_______ (至少回答两点)
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:_______ 。
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应: ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。
①反应中,每生成16molN2,转移的电子数为_______ 。
②反应中,氧化产物与还原产物的物质的量之比为_______ 。
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为: 。
。

①充电时,电解质溶液中的锂离子向电极_______ (填写“M”“N”)方向移动
②若放电时外电路有2NA电子转移,则理论上电极M的质量_______ (填序号)。
A.增重14g B.不变 C.减重14g D.无法确定
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以
 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应:
 ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。①反应中,每生成16molN2,转移的电子数为
②反应中,氧化产物与还原产物的物质的量之比为
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为:
 。
。
①充电时,电解质溶液中的锂离子向电极
②若放电时外电路有2NA电子转移,则理论上电极M的质量
A.增重14g B.不变 C.减重14g D.无法确定
您最近一年使用:0次
解题方法
7 . 一方面,磷矿藏在地球上分布不均匀且储量有限;另一方面,污水中含有较多的磷元素。因此在污水处理生物污泥中的蓝铁矿[Fe3(PO4)2·nH2O]因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。

(1)水处理时,加入的高铁酸钾(K2FeO4)作为净水消毒剂,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4中Fe的化合价为_______ 价,上述反应涉及的物质中属于盐的是_______ 。
②高铁酸钾可用于净水消毒的原因是_______ 。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:________ _______Fe(OH)3+______CH4+_______H+ ______Fe2++_______HCO
______Fe2++_______HCO +_______H2O,
+_______H2O,
该反应中的氧化产物为_______ (填离子符号),被氧化的原子与被还原的原子的数目之比为_______ 。
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=
Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=_______ ,蓝铁矿的相对分子质量为_______ 。

(1)水处理时,加入的高铁酸钾(K2FeO4)作为净水消毒剂,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4中Fe的化合价为
②高铁酸钾可用于净水消毒的原因是
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:
 ______Fe2++_______HCO
______Fe2++_______HCO +_______H2O,
+_______H2O,该反应中的氧化产物为
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O
 Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=
Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=
您最近一年使用:0次
2022-10-10更新
|
803次组卷
|
3卷引用:湖北省黄冈市蕲春县第四高级中学2022-2023学年高一上学期期中质量检测化学试题
名校
解题方法
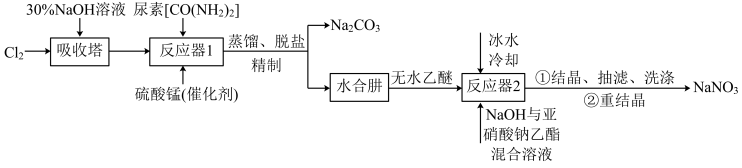
8 . 叠氮化钠( )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(1)吸收塔内发生反应的离子方程式为_______ 。
(2)写出反应器1中生成水合肼反应的化学方程式:_______ 。
(3)反应器2中加入无水乙醚的作用是_______ 。
(4)已知亚硝酸乙酯的结构简式为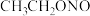 ,反应器2中生成
,反应器2中生成 和
和 。若生成39g
。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为_______ 。
(5)反应器1要控制NaClO溶液的用量,其主要目的是_______ 。
(6)某实验室设计了如图所示装置制备 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
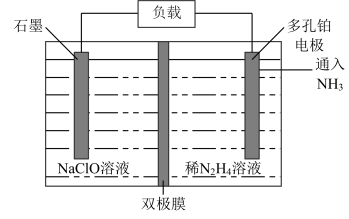
①双极膜中产生的_______ (填“ ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。
②石墨电极反应式为_______ 。
 )不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼(
)不溶于乙醚,微溶于乙醇,易溶于水,常用于汽车安全防护袋的气源,汽车发生剧烈碰撞时,立即自动充气。实验室模拟尿素法制备水合肼( )并利用其进一步反应制取
)并利用其进一步反应制取 的流程如下:
的流程如下:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 ;
;②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(1)吸收塔内发生反应的离子方程式为
(2)写出反应器1中生成水合肼反应的化学方程式:
(3)反应器2中加入无水乙醚的作用是
(4)已知亚硝酸乙酯的结构简式为
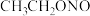 ,反应器2中生成
,反应器2中生成 和
和 。若生成39g
。若生成39g  ,则该反应中转移电子的物质的量为
,则该反应中转移电子的物质的量为(5)反应器1要控制NaClO溶液的用量,其主要目的是
(6)某实验室设计了如图所示装置制备
 。双极膜是阴、阳复合膜,层间的
。双极膜是阴、阳复合膜,层间的 解离成
解离成 和
和 并可分别通过阴、阳膜定向移动。
并可分别通过阴、阳膜定向移动。
①双极膜中产生的
 ”或“
”或“ ”)移向多孔铂电极。
”)移向多孔铂电极。②石墨电极反应式为
您最近一年使用:0次
名校
解题方法
9 . 将 由
由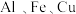 组成的合金等分为两份,将其中一份合金溶于足量的
组成的合金等分为两份,将其中一份合金溶于足量的 溶液中,产生气体
溶液中,产生气体 (标准状况);另一份合金溶于过量的稀硝酸中,得到
(标准状况);另一份合金溶于过量的稀硝酸中,得到 (标准状况下)
(标准状况下) 气体,向反应后的溶液中加入过量的
气体,向反应后的溶液中加入过量的 溶液,过滤得到滤液X和
溶液,过滤得到滤液X和 的沉淀Y(若
的沉淀Y(若 的还原产物仅为
的还原产物仅为 ),则下列说法正确的是
),则下列说法正确的是
 由
由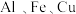 组成的合金等分为两份,将其中一份合金溶于足量的
组成的合金等分为两份,将其中一份合金溶于足量的 溶液中,产生气体
溶液中,产生气体 (标准状况);另一份合金溶于过量的稀硝酸中,得到
(标准状况);另一份合金溶于过量的稀硝酸中,得到 (标准状况下)
(标准状况下) 气体,向反应后的溶液中加入过量的
气体,向反应后的溶液中加入过量的 溶液,过滤得到滤液X和
溶液,过滤得到滤液X和 的沉淀Y(若
的沉淀Y(若 的还原产物仅为
的还原产物仅为 ),则下列说法正确的是
),则下列说法正确的是A. 的合金中含铝 的合金中含铝 | B.滤液X中的溶质只有硝酸钠 |
| C.V为6.72 | D.沉淀Y中含氢氧化铜 |
您最近一年使用:0次
2022-05-14更新
|
723次组卷
|
3卷引用:湖北省武汉市洪山高级中学2022-2023学年高二上学期开学考试化学试题
名校
解题方法
10 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
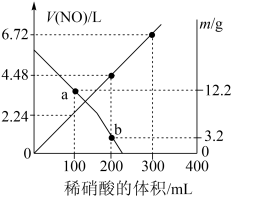

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3560次组卷
|
14卷引用:湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题
湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题山西省长治市2021-2022学年高一下学期期末联合考化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题



