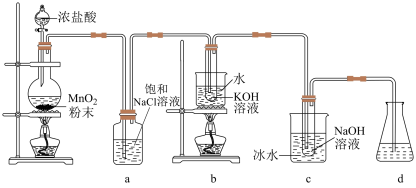
1 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域,实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。
回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是___________ ,装置a的作用是___________ 。
(2)写出b中试管内反应的化学方程式___________ 。
(3)装置c采用冰水浴冷却的目的是___________ 。
(4)反应结束后,取出b中试管,经蒸发浓缩,___________ ,___________ ,少量冷水洗涤,干燥,得到 晶体。
晶体。
(5)设计实验探究 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。
因此, 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO的氧化能力。
(6) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: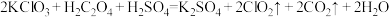 。
。
①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:___________
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为___________ 。(计算结果保留两位小数)
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响
 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是
(2)写出b中试管内反应的化学方程式
(3)装置c采用冰水浴冷却的目的是
(4)反应结束后,取出b中试管,经蒸发浓缩,
 晶体。
晶体。(5)设计实验探究
 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。| 实验操作 | 现象 | |
| Ⅰ | 取  溶液,振荡。 溶液,振荡。 | 无明显变化 |
| Ⅱ | 取 溶液于2号试管中, 溶液于2号试管中, | 出现红褐色沉淀 |
 的氧化能力
的氧化能力(6)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: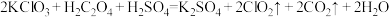 。
。①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2 . “化肥也能爆炸”。阅读下面信息材料,回答相关问题。
硝酸铵可用作肥料;一定条件下会剧烈分解生成 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。
(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是___________ (填化学式)。
(2)根据上述材料写出工业制备硝酸铵的化学方程式___________ ,该反应___________ (填“是”或“否”)属于氧化还原反应。
(3)上述硝酸铵爆炸发生的反应为 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为___________ ,氧化产物为___________ 。
(4)某化学小组需要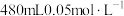 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。
①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有___________ 和___________ 。
②根据计算需用天平称取___________ g硝酸铵固体。
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制 溶液的浓度
溶液的浓度___________ (填“偏低”、“偏高”或“无影响”)。
硝酸铵可用作肥料;一定条件下会剧烈分解生成
 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是
(2)根据上述材料写出工业制备硝酸铵的化学方程式
(3)上述硝酸铵爆炸发生的反应为
 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为(4)某化学小组需要
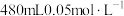 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有
②根据计算需用天平称取
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制
 溶液的浓度
溶液的浓度
您最近一年使用:0次
名校
解题方法
3 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
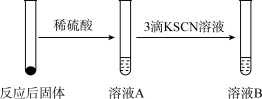
Ⅰ.某学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
请回答下列问题:
(1)实验①中湿棉花、肥皂液作用分别是___________ 、___________ ;实验①中能观察到肥皂液中持续产生肥皂泡,当用燃烧着火柴靠近肥皂泡时,气泡破裂,气体燃烧,火焰呈黄色,并发出轻微的爆鸣声。解释火焰呈黄色的原因___________ ;实验①中反应的化学方程式是___________ 。
(2)实验②前,甲同学对其反应及现象进行预测:向反应后固体加入稀硫酸发生反应的离子方程式_______________ ;实验②中溶液B呈现______ 色,其中发生反应的离子方程式___________ 。
(3)实验②中,乙同学观察到溶液B未呈现红色,则溶液B未呈现红色的原因__________ (用离子方程式表示)。检验B溶液中金属离子的方法_______________ 。
Ⅱ.我国具有5000年文化,文物是活的历史。某博物馆修复出土铁器包括:检测锈蚀产物→分析腐蚀原理→脱氯→形成保护层等过程。
(4)锈蚀产物的主要成分为 、
、 、
、 、
、 、FeOCl。研究发现,出土文物
、FeOCl。研究发现,出土文物 保护层被
保护层被 氧化为
氧化为 而引起腐蚀的。
而引起腐蚀的。 中铁的化合价为
中铁的化合价为_______ 。
(5)利用在NaOH溶液中,溶解度FeOCl大于 ,对固体FeOCl进行脱氯,离子方程式为
,对固体FeOCl进行脱氯,离子方程式为_______________ 。
(6)用 把脱氯产物
把脱氯产物 还原为
还原为 ,生成1mol
,生成1mol  需要
需要___________ mol  。
。
Ⅰ.某学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
| 实验① | 实验② |
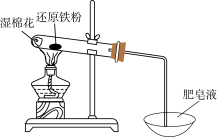 |  |
(1)实验①中湿棉花、肥皂液作用分别是
(2)实验②前,甲同学对其反应及现象进行预测:向反应后固体加入稀硫酸发生反应的离子方程式
(3)实验②中,乙同学观察到溶液B未呈现红色,则溶液B未呈现红色的原因
Ⅱ.我国具有5000年文化,文物是活的历史。某博物馆修复出土铁器包括:检测锈蚀产物→分析腐蚀原理→脱氯→形成保护层等过程。
(4)锈蚀产物的主要成分为
 、
、 、
、 、
、 、FeOCl。研究发现,出土文物
、FeOCl。研究发现,出土文物 保护层被
保护层被 氧化为
氧化为 而引起腐蚀的。
而引起腐蚀的。 中铁的化合价为
中铁的化合价为(5)利用在NaOH溶液中,溶解度FeOCl大于
 ,对固体FeOCl进行脱氯,离子方程式为
,对固体FeOCl进行脱氯,离子方程式为(6)用
 把脱氯产物
把脱氯产物 还原为
还原为 ,生成1mol
,生成1mol  需要
需要 。
。
您最近一年使用:0次
4 . I.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题。
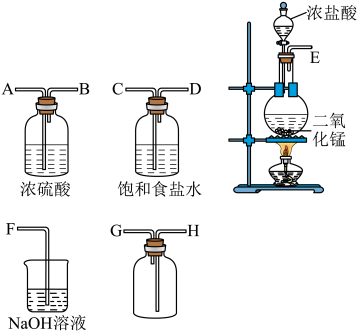
(1)连接上述仪器的正确顺序(填各接口处的字母):_______ 。
II.用如下装置制取氯气,并用氯气进行实验。回答下列问题:
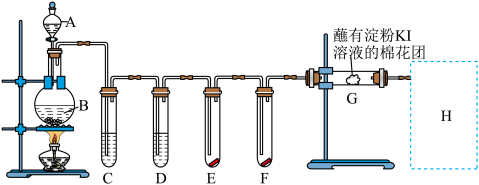
(2)A中盛有浓盐酸,B中盛有MnO2,写出反应方程式并用双线桥表示该反应中电子转移的方向和数目_______ 。反应中,如果有17.4g纯MnO2被还原,那么被氧化的氯化氢的质量为_______ 。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是_______ 。
(4)G处的现象是_______ 。
(5)H处装置的作用为_______ ,反应的离子方程式为_______ 。

(1)连接上述仪器的正确顺序(填各接口处的字母):
II.用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(2)A中盛有浓盐酸,B中盛有MnO2,写出反应方程式并用双线桥表示该反应中电子转移的方向和数目
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是
(4)G处的现象是
(5)H处装置的作用为
您最近一年使用:0次
解题方法
5 . 金属钴(Co)广泛用作电池材料,草酸钴用途广泛,可用于指示剂和催化剂制备。
某工厂以水钴矿(主要成分为 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:

(1) 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为___________ ,固体1的成分是___________ 。
(2)酸浸过程涉及两个氧化还原反应,写出 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:___________ ,另一个反应中氧化剂与还原剂(均指固体)物质的量之比为___________ 。
(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于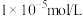 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
___________ ,用NaF沉镁而不是用调pH的方法除镁的原因最可能是___________ {已知常温下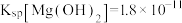 、
、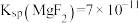 }。
}。
(4) 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:___________ 。
(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式: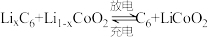 。
。
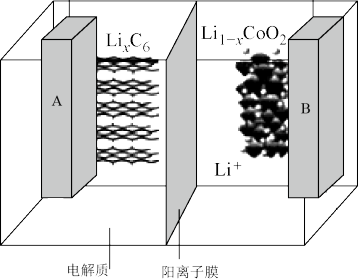
则充电时 从
从___________ (填“A”或“B”)极区移向另一区,阳极上的电极反应式为___________ 。
某工厂以水钴矿(主要成分为
 ,含少量
,含少量 、
、 、
、 、
、 等)为原料制备草酸钴的流程如图,回答下列问题:
等)为原料制备草酸钴的流程如图,回答下列问题:
(1)
 中钴元素显+2价,则碳元素的化合价为
中钴元素显+2价,则碳元素的化合价为(2)酸浸过程涉及两个氧化还原反应,写出
 与盐酸反应(有气体单质生成)的离子方程式:
与盐酸反应(有气体单质生成)的离子方程式:(3)为实现调pH除杂的目的(溶液中杂质离子浓度不大于
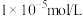 ,溶液的pH不应小于a,则所得固体1的
,溶液的pH不应小于a,则所得固体1的
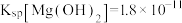 、
、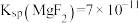 }。
}。(4)
 在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g
在隔绝空气条件下加热到350℃时会分解生成两种物质,实验表明,14.7g 充分加热后,固体质量减少8.8g,写出相应的化学方程式:
充分加热后,固体质量减少8.8g,写出相应的化学方程式:(5)钴酸锂具有功率大的特点而用作电动汽车的动力电池,其工作原理如图,A极中的碳作为金属锂的载体,电池反应式:
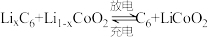 。
。
则充电时
 从
从
您最近一年使用:0次
6 . 炼锌工厂产生的含砷酸性污水需做无害化处理后排放,一种提取砷并将其资源化的工艺流程如下:
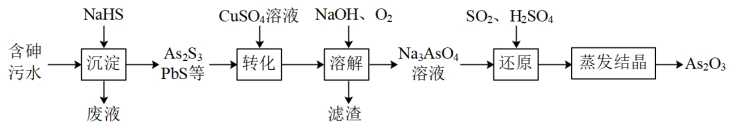
回答下列问题:
(1)“沉淀”时,需控制溶液中HS—的浓度不能过高,原因为_______ 。
(2)“转化”时,As2S3在CuSO4溶液中转化为HAsO2,HAsO2中As元素的化合价为_______ ,该反应的化学方程式为_______ 。
(3)已知Ksp(CuS)=1×10-36、Ksp(PbS)=1×10-26、Ksp(PbSO4)=1×10-8,若“转化时,调节溶液中Cu2+浓度为10-8mol/L,SO 的浓度为0.1mol/L,此时c(Pb2+)=
的浓度为0.1mol/L,此时c(Pb2+)=_______ ,滤渣中的Pb的存在形式为_______ 。
(4)“溶解”时,发生反应的氧化剂和还原剂的物质的量之比为_______ ,实验测得Na3AsO4溶液呈碱性,其原因为_______ (用离子方程式表示)。
(5)该流程制得99g As2O3,则“还原”时消耗标准状况下SO2的体积为_______ 。

回答下列问题:
(1)“沉淀”时,需控制溶液中HS—的浓度不能过高,原因为
(2)“转化”时,As2S3在CuSO4溶液中转化为HAsO2,HAsO2中As元素的化合价为
(3)已知Ksp(CuS)=1×10-36、Ksp(PbS)=1×10-26、Ksp(PbSO4)=1×10-8,若“转化时,调节溶液中Cu2+浓度为10-8mol/L,SO
 的浓度为0.1mol/L,此时c(Pb2+)=
的浓度为0.1mol/L,此时c(Pb2+)=(4)“溶解”时,发生反应的氧化剂和还原剂的物质的量之比为
(5)该流程制得99g As2O3,则“还原”时消耗标准状况下SO2的体积为
您最近一年使用:0次
名校
7 . 铁与不同密度硝酸溶液反应时,还原产物百分比与硝酸密度的关系如图所示,下列说法错误的是
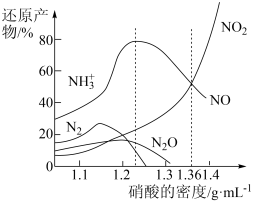
| A.其他条件相同,铁与足量密度为1.23g/mL的硝酸反应,还原产物主要为NO |
| B.一定量的铁粉与足量密度为1.36g/mL的HNO3反应,得到气体2.24L(标准状况),则参加反应的硝酸的物质的量为0.3mol |
| C.足量铁与一定量密度为1.36g/mL的硝酸反应,反应的化学方程式始终为:2Fe+6HNO3=2Fe(NO3)2+NO↑+NO2↑+3H2O |
| D.硝酸的密度越大,其还原产物中高价态的成分所占比例越多 |
您最近一年使用:0次
2022-04-21更新
|
1060次组卷
|
7卷引用:广东省潮州市饶平县第二中学2023-2024学年高一下学期第一次月考化学试题
8 . 利用“价类二维图”可以从不同角度研究含铁物质的性质及其转化关系,图中甲~己均含铁元素。回答下列问题:

(1)甲在高温下与水蒸气反应,若生成的H2在标准状况下的体积为22.4L,则参加反应的甲的物质的量为____ 。
(2)写出检验某红色氧化物固体是否含有乙的操作____ 。
(3)K2FeO4常用作杀菌消毒剂,从化合价的角度分析是K2FeO4具有____ 性(氧化性或还原性)。用FeCl3与KClO在强碱性条件下制取K2FeO4时,该反应中氧化剂与还原剂的物质的量之比为____ 。
(4)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-=Cu2+;还原反应为:2Fe3++2e-=2Fe2+。请据此将图中甲与盐酸反应的离子方程式拆写成两个“半反应式”,其中还原反应为____ 。

(1)甲在高温下与水蒸气反应,若生成的H2在标准状况下的体积为22.4L,则参加反应的甲的物质的量为
(2)写出检验某红色氧化物固体是否含有乙的操作
(3)K2FeO4常用作杀菌消毒剂,从化合价的角度分析是K2FeO4具有
(4)一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+的拆写结果是:氧化反应为:Cu-2e-=Cu2+;还原反应为:2Fe3++2e-=2Fe2+。请据此将图中甲与盐酸反应的离子方程式拆写成两个“半反应式”,其中还原反应为
您最近一年使用:0次
名校
9 . 三氯化六氨合钴(Ⅲ) 是钴化合物合成中的重要原料。实验室以
是钴化合物合成中的重要原料。实验室以 为原料制备
为原料制备 ,步骤如下:
,步骤如下:
Ⅰ. 的制备:
的制备: 可以通过钴和纯净氯气反应制得,实验室制备
可以通过钴和纯净氯气反应制得,实验室制备 可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,
可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化, 易潮解)。
易潮解)。

(1)A中发生反应的离子方程式为_______ ,反应中氧化剂和氧化产物的物质的量之比为_______ 。
(2)装置的连接顺序为_______ (按气流方向,用大写字母表示),装置B中的试剂Z是_______ ,其作用是_______ 。
(3)反应开始前应先点燃A处的酒精灯,其目的是_______ 。
Ⅱ.家用泡腾消毒片由 、固体强酸及辅助剂(辅助剂不参与反应)混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体强酸及辅助剂(辅助剂不参与反应)混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 气体。
气体。
(4)①泡腾片在水中发生反应的离子方程式为_______ 。
②泡腾片使用时需要加水,水作为_______ (填字母)。
A.氧化剂 B.还原剂 C.既不是氧化剂,也不是还原剂 D.既是氧化剂,又是还原剂
(5)消毒剂的消毒效率常用单位质量的消毒剂得到的电子数表示。理论上 的消毒效率是
的消毒效率是 的
的_______ 倍(结果保留两位小数)。
 是钴化合物合成中的重要原料。实验室以
是钴化合物合成中的重要原料。实验室以 为原料制备
为原料制备 ,步骤如下:
,步骤如下:Ⅰ.
 的制备:
的制备: 可以通过钴和纯净氯气反应制得,实验室制备
可以通过钴和纯净氯气反应制得,实验室制备 可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化,
可用下图实验装置实现(已知:钴单质在300℃以上易被氧气氧化, 易潮解)。
易潮解)。
(1)A中发生反应的离子方程式为
(2)装置的连接顺序为
(3)反应开始前应先点燃A处的酒精灯,其目的是
Ⅱ.家用泡腾消毒片由
 、固体强酸及辅助剂(辅助剂不参与反应)混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出
、固体强酸及辅助剂(辅助剂不参与反应)混合制得,使用时只需将泡腾片放入水中,5~10分钟即可完全溶解,释放出 气体。
气体。(4)①泡腾片在水中发生反应的离子方程式为
②泡腾片使用时需要加水,水作为
A.氧化剂 B.还原剂 C.既不是氧化剂,也不是还原剂 D.既是氧化剂,又是还原剂
(5)消毒剂的消毒效率常用单位质量的消毒剂得到的电子数表示。理论上
 的消毒效率是
的消毒效率是 的
的
您最近一年使用:0次
2022-01-22更新
|
258次组卷
|
2卷引用:广东省广州市天河区2021-2022学年高一上学期期末考试化学试题
10 . 液溴沸点为58.8℃,易挥发,与氯气化学性质相似,在化工中有重要用途,一种用氯气直接氧化HBr回收液溴的工艺如图,回答下列问题:
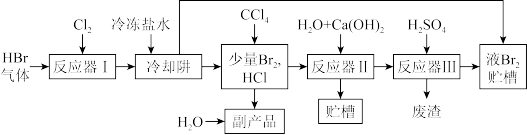
(1)反应器I中反应的化学方程式为___ 。
(2)通过冷却阱可冷凝回收80%的溴蒸气,写出一条提高溴蒸气回收率的措施___ 。
(3)副产品名称是___ ,废渣成分的化学式是___ 。
(4)反应器II中溴转化为两种易溶于水的盐,其中氧化产物是BrO ,反应的离子方程式为
,反应的离子方程式为___ ;反应器III中加入H2SO4的目的是使上一步生成的两种盐在酸性条件下反应再次转化为Br2,该反应中氧化产物与还原产物的物质的量之比为___ 。
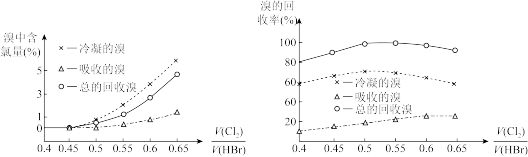
(5)反应器I中投入的氯气与溴化氢的体积比对溴中含氯量以及溴的回收率的影响如图所示。要得到纯度达到97%以上的合格液溴,应选择的合适的投料比范围为___ 。

| 物质 | 溶解性 | |
| Br2 | 微溶于水,易溶于CCl4 | CCl4为无色油状液体,良好的有机溶剂,往 溴水中加入CCl4可使Br2转移至CCl4中 |
| HCl | 极易溶于水,难溶于CCl4 | |
| HBr | 易溶于水,难溶于CCl4 |
(1)反应器I中反应的化学方程式为
(2)通过冷却阱可冷凝回收80%的溴蒸气,写出一条提高溴蒸气回收率的措施
(3)副产品名称是
(4)反应器II中溴转化为两种易溶于水的盐,其中氧化产物是BrO
 ,反应的离子方程式为
,反应的离子方程式为(5)反应器I中投入的氯气与溴化氢的体积比对溴中含氯量以及溴的回收率的影响如图所示。要得到纯度达到97%以上的合格液溴,应选择的合适的投料比范围为

您最近一年使用:0次



