I.实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题。
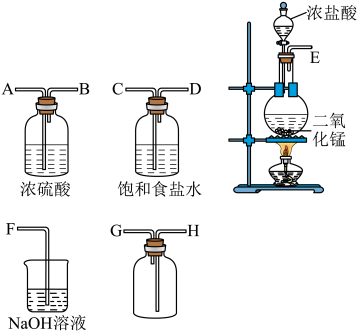
(1)连接上述仪器的正确顺序(填各接口处的字母):_______ 。
II.用如下装置制取氯气,并用氯气进行实验。回答下列问题:
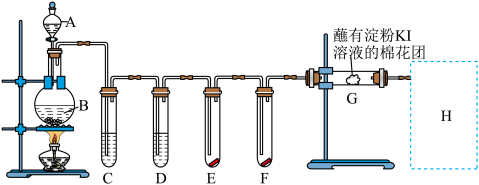
(2)A中盛有浓盐酸,B中盛有MnO2,写出反应方程式并用双线桥表示该反应中电子转移的方向和数目_______ 。反应中,如果有17.4g纯MnO2被还原,那么被氧化的氯化氢的质量为_______ 。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是_______ 。
(4)G处的现象是_______ 。
(5)H处装置的作用为_______ ,反应的离子方程式为_______ 。

(1)连接上述仪器的正确顺序(填各接口处的字母):
II.用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(2)A中盛有浓盐酸,B中盛有MnO2,写出反应方程式并用双线桥表示该反应中电子转移的方向和数目
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是
(4)G处的现象是
(5)H处装置的作用为
更新时间:2023-11-16 19:30:20
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:
①K2FeO4为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
②K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
③K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用。

(1)K2FeO4中铁元素的化合价为___________ 。
(2)A为氯气发生装置。发生反应的方程式为:KMnO4+HCl=MnCl2+Cl2↑+KCl+H2O,配平上述方程式______ ,并用单线桥分析该氧化还原反应的电子转移情况。
(3)装置B是为了除去Cl2中混有的HCl杂质,将除杂装置B补充完整并标明所用试剂_____ 。
(4)D中盛放的是___________ 溶液。
(5)C中得到紫色固体K2FeO4和溶液,请判断氧化性Cl2___________ K2FeO4(填“>”“=”或“<”)。C中通Cl2制得K2FeO4的化学方程式_______ ,同时还发生了另一个反应的离子方程式是_____ 。
(6)下列关于K2FeO4的说法中,正确的是___________ 。
A.是强氧化性的盐
B.固体保存需要防潮
C.其净水优点有:作用快、安全性好、无异味
(7)将K2FeO4与水反应的化学方程式补充完整:4K2FeO4+( )H2O=( )Fe(OH)3(胶体)+( )_______+( )KOH,_________ 。
资料:
①K2FeO4为紫色固体,干燥品在室温下稳定,在碱性溶液中较稳定。随着碱性的减弱,稳定性下降,与水反应放出氧气。
②K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。
③K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用。

(1)K2FeO4中铁元素的化合价为
(2)A为氯气发生装置。发生反应的方程式为:KMnO4+HCl=MnCl2+Cl2↑+KCl+H2O,配平上述方程式
(3)装置B是为了除去Cl2中混有的HCl杂质,将除杂装置B补充完整并标明所用试剂
(4)D中盛放的是
(5)C中得到紫色固体K2FeO4和溶液,请判断氧化性Cl2
(6)下列关于K2FeO4的说法中,正确的是
A.是强氧化性的盐
B.固体保存需要防潮
C.其净水优点有:作用快、安全性好、无异味
(7)将K2FeO4与水反应的化学方程式补充完整:4K2FeO4+( )H2O=( )Fe(OH)3(胶体)+( )_______+( )KOH,
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】已知M、N是两种常见的金属,且是地壳中含量前二的金属元素的单质,A是二元化合物,A、B、C含同种金属元素,X是一种常见的黑色非金属固体,其转化关系如图(注意:有的反应物和生成物未标出)

请回答以下问题:
(1)A的名称_____ ,H常见的两点用途有_____ 。
(2)请用单线桥表示反应④的电子转移的方向和数目_____ 。
(3)写出反应①的离子方程式_____ 。
(4)向0.1molD和0.1molF的混合溶液中逐滴滴加稀盐酸,生成3.9g沉淀,消耗HCl的物质的量为_____ 。
(5)现有Fe、Fe2O3、Fe5O7混合物共0.1mol,加盐酸后固体全部溶解,共收集到0.01molH2,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中N的物质的量为_____ 。

请回答以下问题:
(1)A的名称
(2)请用单线桥表示反应④的电子转移的方向和数目
(3)写出反应①的离子方程式
(4)向0.1molD和0.1molF的混合溶液中逐滴滴加稀盐酸,生成3.9g沉淀,消耗HCl的物质的量为
(5)现有Fe、Fe2O3、Fe5O7混合物共0.1mol,加盐酸后固体全部溶解,共收集到0.01molH2,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中N的物质的量为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】(1)将新制氯水逐滴滴入FeBr2溶液中,写出最初发生的反应的离子方程式,并标出电子转移的方向和数目。___ 。
(2)在硫酸铝铵(NH4Al(SO4)2)溶液中滴加少量Ba(OH)2溶液并不断搅拌。用一个离子方程式表示最初发生的反应。___ 。
(3)石油气“芳构化”是由石油气生产高辛烷值汽油的一种有效生产工艺。测得反应2C4H10 C8H10(g)+5H2在不同温度下的平衡常数变化如下:
C8H10(g)+5H2在不同温度下的平衡常数变化如下:
①该反应的正反应是____ (吸热、放热)反应。
②向2L密闭定容容器中充入2molC4H10,反应10s后测得H2浓度为1mol/L,此10s内,以C8H10表示的平均速率为___ 。
③能表示该反应在恒温恒容密闭容器中t1时刻后已经达平衡状态的图示是___ 。
a.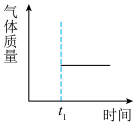 b.
b.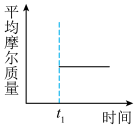 c.
c.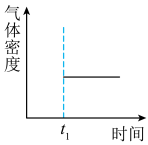 d.
d.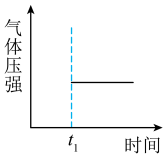
④如图表示某温度时将一定量的C4H10(含少量H2)充入容器中反应期间物质浓度随时间的变化(容器容积可变),实线代表C8H10,虚线代表C4H10。请用实线补充画出t1~t4间C8H10的浓度变化曲线___ 。

(2)在硫酸铝铵(NH4Al(SO4)2)溶液中滴加少量Ba(OH)2溶液并不断搅拌。用一个离子方程式表示最初发生的反应。
(3)石油气“芳构化”是由石油气生产高辛烷值汽油的一种有效生产工艺。测得反应2C4H10
 C8H10(g)+5H2在不同温度下的平衡常数变化如下:
C8H10(g)+5H2在不同温度下的平衡常数变化如下:| 温度(℃) | 400 | 450 | 500 |
| 平衡常数K | a | 6a | 40a |
②向2L密闭定容容器中充入2molC4H10,反应10s后测得H2浓度为1mol/L,此10s内,以C8H10表示的平均速率为
③能表示该反应在恒温恒容密闭容器中t1时刻后已经达平衡状态的图示是
a.
 b.
b. c.
c. d.
d.
④如图表示某温度时将一定量的C4H10(含少量H2)充入容器中反应期间物质浓度随时间的变化(容器容积可变),实线代表C8H10,虚线代表C4H10。请用实线补充画出t1~t4间C8H10的浓度变化曲线

您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】含氯消毒剂是一类毒性低、价格低、杀菌效率高、被广泛使用的高效杀毒剂,在控制病原微生物污染和传播等方面右着重要作用。亚氯酸钠(NaClO2)是一种优质的漂白剂和消毒剂。一种以氯酸钠(NaClO3)为原料制备NaClO2粗品的工艺流程如图所示:
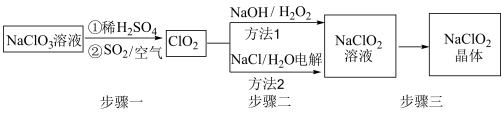
已知:①纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②硫单质与碱在一定条件下可以反应:3S+6KOH=2K2S+K2SO3+3H2O。
(1)步骤一中通入空气的作用是___________ 。
(2)写出方法1中发生反应的化学方程式:___________ ,此方法中不宜用S代替H2O2,理由是___________ 。
(3)方法2所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的Ca2+和 ,按顺序加入的除杂试剂为
,按顺序加入的除杂试剂为_______ 。可用NaOH溶液吸收电解产生的氯气,该反应的离子方程式是________ 。
(4)NaClO2和Cl2消毒时,还原产物均为Cl-。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,计算NaClO2的消毒效率是Cl2的___________ 倍。(计算结果保留一位小数)

已知:①纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②硫单质与碱在一定条件下可以反应:3S+6KOH=2K2S+K2SO3+3H2O。
(1)步骤一中通入空气的作用是
(2)写出方法1中发生反应的化学方程式:
(3)方法2所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的Ca2+和
 ,按顺序加入的除杂试剂为
,按顺序加入的除杂试剂为(4)NaClO2和Cl2消毒时,还原产物均为Cl-。消毒剂的消毒效率可用单位质量消毒剂被还原时得电子数表示,计算NaClO2的消毒效率是Cl2的
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】净化汽车尾气对于保护环境意义重大。其中的一个反应原理为:2NO(g)+2CO(g) ⇌N2(g)+2CO2(g) +Q(Q>0)。
回答下列问题:
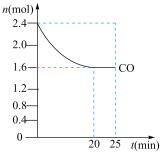
(1)一定温度下,将等物质的量的NO和CO通入固定容积为4L的密闭容器中,反应过程中部分物质的物质的量变化如图所示,则0~20min平均反应速率v(NO)为______ 。
(2)如图所示,若Y表示平衡常数,只改变某一反应条件X,反应由平衡I达到新平衡Ⅱ,则条件X为_______________ ,NO的转化率为平衡I_________ 平衡Ⅱ(填:“大于”、“小于”或“不变”)
(3)能判断该反应达到平衡状态的标志是_______________ (选填编号)
a.v生成(CO2)=v消耗(CO) b.混合气体的平均相对分子质量不再改变
c.平衡常数保持不变 d.NO、CO、N2、CO2的浓度均不再变化
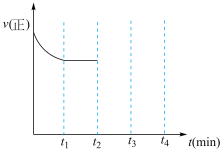
(4)在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在上图中,补充画出从t2到t4时刻正反应速率随时间的变化曲线________ 。
(5)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应分两步进行。第一步是:C3N3(OH)3 3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式
3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式______________________________________ ,每消除1mol NO2转移电子_________ 个。
回答下列问题:
(1)一定温度下,将等物质的量的NO和CO通入固定容积为4L的密闭容器中,反应过程中部分物质的物质的量变化如图所示,则0~20min平均反应速率v(NO)为

(2)如图所示,若Y表示平衡常数,只改变某一反应条件X,反应由平衡I达到新平衡Ⅱ,则条件X为

(3)能判断该反应达到平衡状态的标志是
a.v生成(CO2)=v消耗(CO) b.混合气体的平均相对分子质量不再改变
c.平衡常数保持不变 d.NO、CO、N2、CO2的浓度均不再变化

(4)在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在上图中,补充画出从t2到t4时刻正反应速率随时间的变化曲线
(5)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2,其反应分两步进行。第一步是:C3N3(OH)3
 3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式
3HCNO;第二步是HCNO与NO2反应,把氮元素和碳元素转变成无毒气体。请写出第二步发生的化学反应方程式
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐3】工厂烟气(主要污染物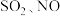 )直接排放会造成空气污染,需处理后才能排放。
)直接排放会造成空气污染,需处理后才能排放。
(1)“纳米零价铁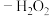 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。在一定温度下,将
。在一定温度下,将 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
① 催化
催化 分解产生HO·,HO·将NO氧化为
分解产生HO·,HO·将NO氧化为 的机理如下图所示,Y的化学式为
的机理如下图所示,Y的化学式为___________ 。 反应生成HNO3的化学方程式为
反应生成HNO3的化学方程式为___________ 。
③纳米零价铁的作用是___________ 。
④NO脱除率随温度的变化如下图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是___________ 。 、
、 ,下列措施能提高尾气中NO和
,下列措施能提高尾气中NO和 去除率的有
去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(3) 脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达
脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达 %以上。反应机理如下图所示,写出该反应发生的化学方程式
%以上。反应机理如下图所示,写出该反应发生的化学方程式___________ 。 溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随
的转化率随 溶液初始pH(用稀盐酸调节)的变化如图所示:
溶液初始pH(用稀盐酸调节)的变化如图所示: 溶液中,
溶液中, 氧化NO生成Cl-和
氧化NO生成Cl-和 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(5)目前, 溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置
溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置 如图
如图 。设计该装置的优点是
。设计该装置的优点是___________ 。脱硝反应中,每吸收标准状况下448mL的NO,转移的电子数为___________ mol。
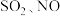 )直接排放会造成空气污染,需处理后才能排放。
)直接排放会造成空气污染,需处理后才能排放。(1)“纳米零价铁
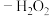 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 。在一定温度下,将
。在一定温度下,将 溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液和HCl溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。①
 催化
催化 分解产生HO·,HO·将NO氧化为
分解产生HO·,HO·将NO氧化为 的机理如下图所示,Y的化学式为
的机理如下图所示,Y的化学式为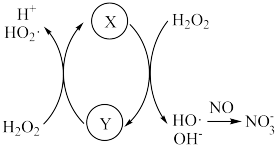
 反应生成HNO3的化学方程式为
反应生成HNO3的化学方程式为③纳米零价铁的作用是
④NO脱除率随温度的变化如下图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是

 、
、 ,下列措施能提高尾气中NO和
,下列措施能提高尾气中NO和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(3)
 脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达
脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达 %以上。反应机理如下图所示,写出该反应发生的化学方程式
%以上。反应机理如下图所示,写出该反应发生的化学方程式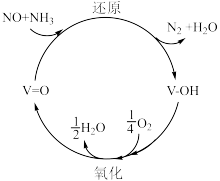
 溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随
的转化率随 溶液初始pH(用稀盐酸调节)的变化如图所示:
溶液初始pH(用稀盐酸调节)的变化如图所示: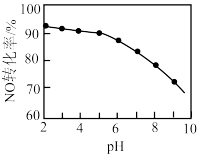
 溶液中,
溶液中, 氧化NO生成Cl-和
氧化NO生成Cl-和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
(5)目前,
 溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置
溶液广泛地应用于脱硫脱硝。某课外小组同学设计了如图喷淋吸收塔装置 如图
如图 。设计该装置的优点是
。设计该装置的优点是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】溴及其化合物是重要的化工基础原料,广泛应用于制药、染料、电子、日化等行业。
Ⅰ.用图所示装置A可制取氯气。将纯净的氯气通入装置C的NaBr溶液中可以在实验室制取少量溴单质。_______ 。
(2)为了富集生成的溴单质,用热空气吹出,并在装置D中收集,则装置D中可选用的试剂为_______。
Ⅱ.工业上从海水中提取 过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:
过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:_______ 。主反应塔1中温度保持在82~99℃,减少了水蒸气的用量。从化学性质的角度分析这么做的主要目的有两点:①减少氯气与水的反应,②减少_______ 反应。从经济角度来看这么做还可以减少的_______ 用量。
(4)为了让原料卤水与氯气在主反应塔1中更充分反应,请将正确装置对应的选项填在图中“□”处:_______ 。_______ 。冷凝器需要铺设循环冷却水管道,循环冷却水管道中水流方向是_______ (填“从地面到顶端”或“从顶端到地面”),请说明原因_______ 。
(6)在分离器中经冷凝、分离、纯化后制得精溴。少量氯、溴与混合废气需要经过水蒸气喷射泵喷入气体吸收器。此时,还需进行酸化调节,再经过排水管通入主反应塔1中循环利用。请写出吸收器中酸化调节主要发生的离子反应方程式:_______ 。
Ⅰ.用图所示装置A可制取氯气。将纯净的氯气通入装置C的NaBr溶液中可以在实验室制取少量溴单质。
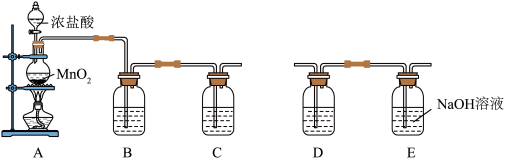
(2)为了富集生成的溴单质,用热空气吹出,并在装置D中收集,则装置D中可选用的试剂为_______。
A. | B.NaOH | C.KI | D. |
Ⅱ.工业上从海水中提取
 过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:
过程更为复杂。研究集中在空气吹出法,空气吹出法提溴对原料的适应性高,但吹出设备庞大,且能耗高。某工厂针对空气吹出法的缺点进行工艺改造,提出连续双段真空提溴工艺,如图转化过程:
(4)为了让原料卤水与氯气在主反应塔1中更充分反应,请将正确装置对应的选项填在图中“□”处:
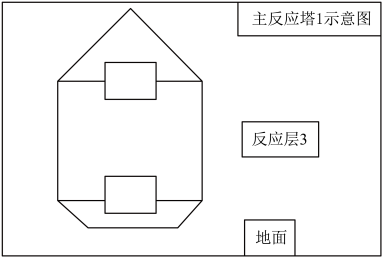

(6)在分离器中经冷凝、分离、纯化后制得精溴。少量氯、溴与混合废气需要经过水蒸气喷射泵喷入气体吸收器。此时,还需进行酸化调节,再经过排水管通入主反应塔1中循环利用。请写出吸收器中酸化调节主要发生的离子反应方程式:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐2】下图中A~H均为中学化学中常见的物质,A是黄绿色有刺激性气味的气体,B、H是无色无味气体,它们之间有如下转化关系。(反应中生成的水已略去)
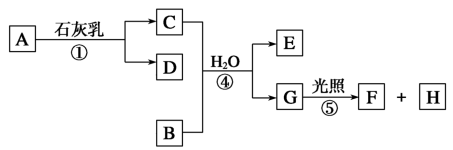
请回答以下问题:
(1)C物质在日常生活中可作______ 剂。
(2)写出反应①的化学方程式:_______ ,反应④的化学方程式:________ 。
(3)将5.6g灼热的铁丝放入充满A的集气瓶中,完全反应后,消耗标况下的A气体______ L,转移了_______ mol电子。
(4)写出实验室制取A气体的离子方程式:_____ ,此反应中氧化剂与还原剂的物质的量之比是_______ 。

请回答以下问题:
(1)C物质在日常生活中可作
(2)写出反应①的化学方程式:
(3)将5.6g灼热的铁丝放入充满A的集气瓶中,完全反应后,消耗标况下的A气体
(4)写出实验室制取A气体的离子方程式:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】氯气是一种重要的化工原料,能与多种物质反应。用图所示装置Ⅰ可制取纯净、干燥的氯气,并对其性质进行一系列的实验探究。
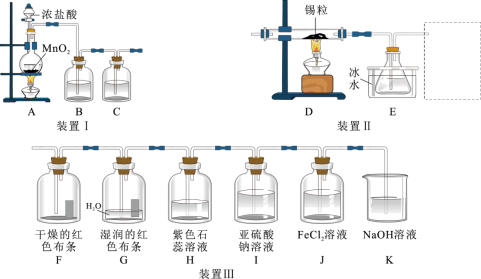
回答下列问题:
(1)①装置Ⅰ用于制取纯净、干燥的氯气。其中盛装浓盐酸的仪器名称是________ ,B瓶盛装的液体为________ (写名称)
②实验室利用装置A制氯气,反应的离子方程式是_____________________
(2)利用纯净、干燥的氯气与熔融金属锡反应可制备 ,将装置Ⅰ与装置Ⅱ连接起来可制备
,将装置Ⅰ与装置Ⅱ连接起来可制备 。已知:金属锡熔点为231℃,活泼性与铁相似;
。已知:金属锡熔点为231℃,活泼性与铁相似; 的沸点为114℃;
的沸点为114℃; 易与水反应。
易与水反应。
①装置E的作用是____________________________
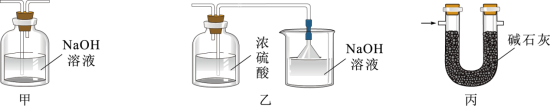
②虚线框可选用下列装置中的_______ (填“甲”“乙”或“丙”)。
(3)将装置Ⅰ与装置Ⅱ连接起来探究氯气的漂白性及氧化性。
①G中通入 后,观察到的现象是
后,观察到的现象是_________ ,根据F、G现象可得出结论: 无漂白性,
无漂白性, 与水反应生成的
与水反应生成的________ (用化学式填空)有漂白性。
②实验开始后,观察到洗气瓶H中的现象是_______________ -
③装置K的作用是___________ (用化学方程式和相应的文字说明)

回答下列问题:
(1)①装置Ⅰ用于制取纯净、干燥的氯气。其中盛装浓盐酸的仪器名称是
②实验室利用装置A制氯气,反应的离子方程式是
(2)利用纯净、干燥的氯气与熔融金属锡反应可制备
 ,将装置Ⅰ与装置Ⅱ连接起来可制备
,将装置Ⅰ与装置Ⅱ连接起来可制备 。已知:金属锡熔点为231℃,活泼性与铁相似;
。已知:金属锡熔点为231℃,活泼性与铁相似; 的沸点为114℃;
的沸点为114℃; 易与水反应。
易与水反应。①装置E的作用是
②虚线框可选用下列装置中的

(3)将装置Ⅰ与装置Ⅱ连接起来探究氯气的漂白性及氧化性。
①G中通入
 后,观察到的现象是
后,观察到的现象是 无漂白性,
无漂白性, 与水反应生成的
与水反应生成的②实验开始后,观察到洗气瓶H中的现象是
③装置K的作用是
您最近一年使用:0次
【推荐1】为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计了如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100°C时开始升华,157°C时大量升华 并开始分解;草酸蒸气在低温下可冷凝为固体且草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I、乙二酸的不稳定性:
根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置,
请回答下列问题:
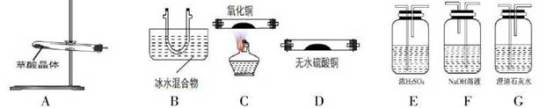
①装置的连接顺序为:A→B→___ →__ →F→E→C→G。
②装置中冰水混合物的作用是_________ 。
③能证明产物中C0的实验现象是__________ 。
④整套装置存在不合理之处为________ 。
Ⅱ、乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol·L-1的草酸溶液480ml。
(2)配置该溶液需要草酸晶体__________ g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是____________ 。
(4)该小组同学将0.1molL-1草酸溶液和0.1molL-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为_____________ 。
Ⅲ、乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪 色,从而判断草酸具有较强的还原性。该反应的离子方程式为_________________________ 。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100°C时开始升华,157°C时大量升华 并开始分解;草酸蒸气在低温下可冷凝为固体且草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I、乙二酸的不稳定性:
根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置,
请回答下列问题:

①装置的连接顺序为:A→B→
②装置中冰水混合物的作用是
③能证明产物中C0的实验现象是
④整套装置存在不合理之处为
Ⅱ、乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol·L-1的草酸溶液480ml。
(2)配置该溶液需要草酸晶体
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是
| A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 |
| B.测定0.1molL-1草酸溶液的pH |
| C.将草酸溶液加入Na2CO3溶液中,有CO2放出 |
| D.测定草酸钠溶液的pH |
Ⅲ、乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪 色,从而判断草酸具有较强的还原性。该反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某课外活动小组设计了下列装置,验证Na2O2跟CO2反应时需要与水接触。

(1)装置分析装置
①中反应的离子方程式是____ 。装置②中的试剂是____ (填序号)。
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
装置③中的试剂是____ 。
(2)进行实验
①步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。该步实验的目的是____ 。
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。该步实验的目的是____ 。
②实验证明步骤1中a处带火星的木条不复燃,步骤2中a处带火星的木条复燃。活动小组从而得出了“Na2O2跟CO2反应时需要与水接触”的结论。有同学认为步骤2的O2可能只是水与Na2O2反应产生的。请你设计实验证明装置⑤中的确发生了Na2O2跟CO2的反应。实验步骤和现象是____ 。
根据上述实验的结论,可以认为Na2O2跟CO2反应过程是首先Na2O2+2H2O=2NaOH+H2O2,然后发生了2NaOH+CO2=Na2CO3+H2O和____ (写方程式)两个反应。

(1)装置分析装置
①中反应的离子方程式是
a.饱和NaHCO3溶液 b.饱和Na2CO3溶液 c.浓H2SO4
装置③中的试剂是
(2)进行实验
①步骤1:打开弹簧夹K2,关闭K1,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。该步实验的目的是
步骤2:打开弹簧夹K1,关闭K2,打开分液漏斗活塞加入盐酸,将带火星的木条放在a处。该步实验的目的是
②实验证明步骤1中a处带火星的木条不复燃,步骤2中a处带火星的木条复燃。活动小组从而得出了“Na2O2跟CO2反应时需要与水接触”的结论。有同学认为步骤2的O2可能只是水与Na2O2反应产生的。请你设计实验证明装置⑤中的确发生了Na2O2跟CO2的反应。实验步骤和现象是
根据上述实验的结论,可以认为Na2O2跟CO2反应过程是首先Na2O2+2H2O=2NaOH+H2O2,然后发生了2NaOH+CO2=Na2CO3+H2O和
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】近年来,研究人员提出用I—作为水溶液中SO2歧化反应的催化剂,实现含SO2工业污水的处理,其催化过程分两步完成:
i.SO2+4I—+4H+= S↓+2I2+2H2O
ii. I2+ 2H2O+SO2 = + 4H++ 2I—
+ 4H++ 2I—
为探究i、ii反应速率与 SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I2易溶解在KI溶液中)
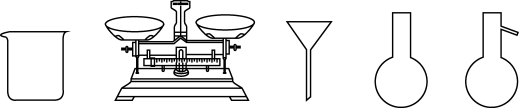
(1)KI的电子式为________ , 用KI固体配制50ml 0.4mol·L-1KI溶液,下图中的仪器需要使用到的有________ (填写名称)。
(2)实验室利用下图制备SO2气体的化学方程式为_______ 。
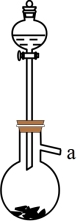
(3)水溶液中SO2歧化反应的离子方程式为________ 。
(4)实验①和②是对照实验,则a=_______ ,比较实验①和②可得出结论_______ 。
(5)实验③试剂X为________ 。比较实验②和③可知H+单独存在时不能催化SO2的歧化反应。
(6)实验表明,SO2歧化反应速率④>①,结合i和ii的反应速率,解释反应速率④>①的原因__________ 。
i.SO2+4I—+4H+= S↓+2I2+2H2O
ii. I2+ 2H2O+SO2 =
 + 4H++ 2I—
+ 4H++ 2I—为探究i、ii反应速率与 SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入2mL下列试剂中,密闭放置,观察现象(已知:I2易溶解在KI溶液中)
| 序号 | ① | ② | ③ | ④ |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1KI 0.2 mol·L-1 H2SO4 | x | 0.2 mol·L-1KI 0.002 mol·L-1 I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊比①快 | 无明显现象 | 棕褐色溶液迅速褪色,变成黄色,出现浑浊比①快 |

(2)实验室利用下图制备SO2气体的化学方程式为

(3)水溶液中SO2歧化反应的离子方程式为
(4)实验①和②是对照实验,则a=
(5)实验③试剂X为
(6)实验表明,SO2歧化反应速率④>①,结合i和ii的反应速率,解释反应速率④>①的原因
您最近一年使用:0次



