名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: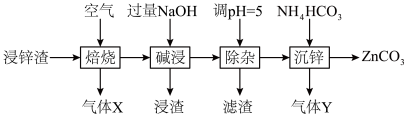
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):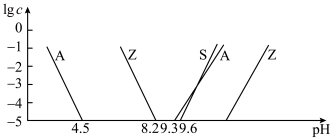
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次
昨日更新
|
121次组卷
|
2卷引用:2024届四川省射洪中学校高三下学期二模理综试题-高中化学
解题方法
2 . 高铁酸钠(Na2FeO4)是一种新型绿色消毒主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为:3C1O-+2Fe3++10OH-=2 +3Cl-+5H2O。下列说法正确的是
+3Cl-+5H2O。下列说法正确的是
 +3Cl-+5H2O。下列说法正确的是
+3Cl-+5H2O。下列说法正确的是| A.该反应中氧化剂与还原剂物质的量之比为3∶2 |
B.该反应中 是氧化剂,Cl-是还原剂 是氧化剂,Cl-是还原剂 |
| C.当生成1mol Na2FeO4时,转移6mol e- |
| D.在酸性溶液中,反应方程式不会发生变化 |
您最近半年使用:0次
名校
解题方法
3 . 将6.4 g铜加入50 mL 10 mol/L的硝酸溶液中,铜全部溶解,得到NO和NO2的混合气体(不考虑NO2与N2O4之间的相互转化)。将反应后溶液稀释至100 mL,测得 的浓度为3 mol/L。下列说法
的浓度为3 mol/L。下列说法错误 的是
 的浓度为3 mol/L。下列说法
的浓度为3 mol/L。下列说法| A.混合气体的物质的量为0.2 mol |
| B.稀释后溶液中H+的物质的量浓度为2 mol/L |
| C.反应中转移电子的物质的量为0.2 mol |
| D.硝酸在反应中部分体现氧化性,部分体现酸性 |
您最近半年使用:0次
名校
解题方法
4 . 以黄铁矿为原料来生产硫酸的工艺流程如图。下列说法错误 的是
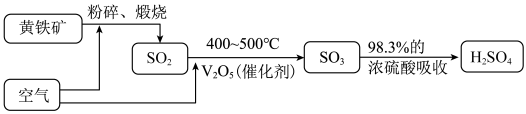
| A.一定条件下,2 mol SO2与足量O2充分反应转移4 mol 电子 |
| B.将黄铁矿粉碎的目的是增大接触面积,加快反应速率,提高原料的利用率 |
C.煅烧黄铁矿发生的反应为:4FeS2+11O2 2Fe2O3+8SO2,FeS2中S的化合价为-1价 2Fe2O3+8SO2,FeS2中S的化合价为-1价 |
| D.用98.3%的浓硫酸吸收三氧化硫可避免形成酸雾 |
您最近半年使用:0次
名校
解题方法
5 . 用NA表示阿伏加德罗常数的值。下列叙述正确 的是
| A.64g Cu与S完全反应转移的电子数为NA |
| B.标准状况下, 11.2L SO3所含的分子数为0.5NA |
| C.足量的Cu与2 mol浓硫酸充分反应转移电子数目为2NA |
| D.1mol氯气与铁完全反应,转移的电子数为3NA |
您最近半年使用:0次
名校
解题方法
6 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况) 与NO的混合气体,这些气体与一定体积的
与NO的混合气体,这些气体与一定体积的 混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入
混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入 溶液,
溶液, 恰好沉淀完全。下列说法正确的是
恰好沉淀完全。下列说法正确的是
 与NO的混合气体,这些气体与一定体积的
与NO的混合气体,这些气体与一定体积的 混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入
混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入 溶液,
溶液, 恰好沉淀完全。下列说法正确的是
恰好沉淀完全。下列说法正确的是| A.此反应过程中转移了0.5mol的电子 |
| B.消耗氧气的体积为1.12L(标准状况) |
C.参加反应的 是0.6mol 是0.6mol |
D.混合气体中含 (标准状况) (标准状况) |
您最近半年使用:0次
名校
解题方法
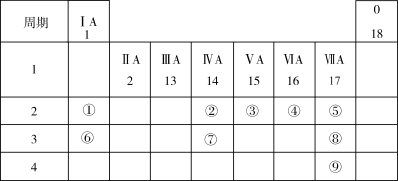
7 . 下表列出了9种元素在元素周期表中的位置示意图。
(1)画出元素⑧形成的简单离子的结构示意图___________ 。
(2)用电子式表示元素④和⑥的单质在常温下反应所得产物的形成过程为___________ 。
(3)将③的最简单氢化物通入③的最高价氧化物对应水化物的溶液中,所得溶液中主要阳离子含有的化学键是___________ 。
(4)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最差的是___________ (填化学式),写出元素⑧的单质与水反应的离子反应方程式___________ 。
(5)工业上可以用Na2CO3溶液吸收Br2(g),过程中有气体生成,且产物中BrO-与BrO 的物质的量之比为2:1,请写出该过程的离子反应方程式
的物质的量之比为2:1,请写出该过程的离子反应方程式___________ 。
(6)32.64gCu与一定浓度③的最高价氧化物对应水化物反应生成NO、NO2、N2O4等气体,将生成的NO、NO2、N2O4与0.1molO2混合后,通入NaOH溶液,气体被完全吸收得到NaNO3和NaNO2的混合溶液,则混合溶液中NaNO2的物质的量为___________ mol。
(1)画出元素⑧形成的简单离子的结构示意图
(2)用电子式表示元素④和⑥的单质在常温下反应所得产物的形成过程为
(3)将③的最简单氢化物通入③的最高价氧化物对应水化物的溶液中,所得溶液中主要阳离子含有的化学键是
(4)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最差的是
(5)工业上可以用Na2CO3溶液吸收Br2(g),过程中有气体生成,且产物中BrO-与BrO
 的物质的量之比为2:1,请写出该过程的离子反应方程式
的物质的量之比为2:1,请写出该过程的离子反应方程式(6)32.64gCu与一定浓度③的最高价氧化物对应水化物反应生成NO、NO2、N2O4等气体,将生成的NO、NO2、N2O4与0.1molO2混合后,通入NaOH溶液,气体被完全吸收得到NaNO3和NaNO2的混合溶液,则混合溶液中NaNO2的物质的量为
您最近半年使用:0次
名校
解题方法
8 . 在19.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成32.8g沉淀。则下列说法正确的是
| A.气体X中可能含0.2molNO、0.2molNO2 |
| B.气体X中含0.3molNO2、0.1molNO |
| C.32.8g沉淀为Cu(OH)2和Fe(OH)2的混合物 |
| D.原合金中含0.1molFe、0.15molCu |
您最近半年使用:0次
名校
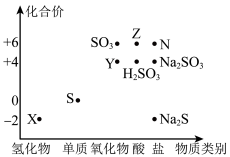
9 . 请根据硫元素的价类二维图,回答下列问题:___________ 。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误 的是___________(填字母)。
(3)Y转化为Z可以选择下列试剂___________ 。写出你所选试剂将Y转化为Z的离子方程式___________ 。
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲: 乙:
乙:
①写出甲方法反应的化学方程式:___________ 。
②甲和乙方法更合理的是___________ (填“甲”或“乙”),理由是(答两点) ___________ 。
(5)电化学法处理 是目前研究的热点。利用过氧化氢吸收
是目前研究的热点。利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示。
污染,设计装置如图所示。___________ 。
②石墨2电极处发生的电极反应式为___________ 。
(6)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。___________ mg•L-1(结果精确到0.001)。
(2)宋代著名法医学家宋慈的
 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
| B.银针验毒时,Ag被氧化 |
| C.X在上述验毒反应中作还原剂 |
| D.上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1 |
(3)Y转化为Z可以选择下列试剂
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲:
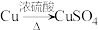 乙:
乙:
①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)电化学法处理
 是目前研究的热点。利用过氧化氢吸收
是目前研究的热点。利用过氧化氢吸收 可消除
可消除 污染,设计装置如图所示。
污染,设计装置如图所示。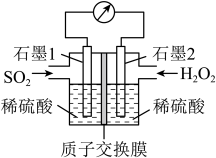
②石墨2电极处发生的电极反应式为
(6)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。
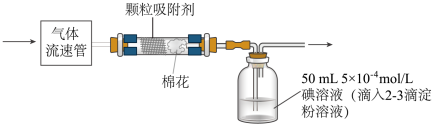
您最近半年使用:0次
名校
解题方法
10 . 二氧化硫是最常见、最简单、有刺激性的硫氧化物,大气主要污染物之一,火山爆发时会喷出该气体,在许多工业过程中也会产生二氧化硫。SO2在生活、生产中有重要用途,使用不当会造成环境污染。
(1)某同学利用如图所示装置研究二氧化硫的性质。___________ ,加入药品前需要___________ 。
②实验开始前先通入一段时间N2,此操作的目的是___________ 。
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有___________ 性。
④装置c中的溶液___________ (填能或不能)用澄清石灰水替换,理由是___________ 。
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。___________ 。该空气中二氧化硫的体积分数为___________ 。
(1)某同学利用如图所示装置研究二氧化硫的性质。
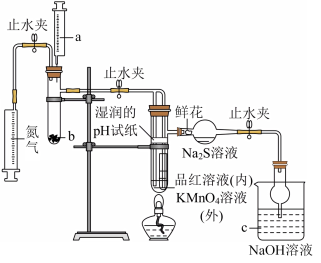
②实验开始前先通入一段时间N2,此操作的目的是
③装有Na2S溶液的球形干燥管中出现淡黄色浑浊,说明二氧化硫具有
④装置c中的溶液
(2)某兴趣小组用如图所示装置测定某硫酸厂附近空气中二氧化硫的含量。

您最近半年使用:0次



