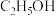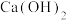解题方法
1 . 以大洋锰结核(主要由 和铁氧化物组成,还含有
和铁氧化物组成,还含有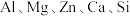 等元素)为原料制备
等元素)为原料制备 及
及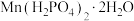 的工艺流程如下:
的工艺流程如下: 范围如下:
范围如下:
② 时,
时,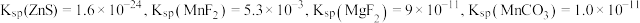 。
。
回答下列问题:
(1)锰元素在元素周期表中的位置为___________ 。
(2)“浸取”时,有副产物 生成。该副反应过程中氧化剂与还原剂的物质的量之比为
生成。该副反应过程中氧化剂与还原剂的物质的量之比为___________ 。温度对锰的浸出率、 生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为
生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为___________ 左右(填标号)。 B.
B.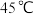 C.
C. D.
D.
(3)加氨水“调 ”时,应控制的
”时,应控制的 范围是
范围是___________ 。
(4)“净化”后,过滤出“滤渣3”,所得滤液中 的最低浓度为
的最低浓度为___________  。
。
(5)“沉锰”时,加入过量的 溶液与溶液中的
溶液与溶液中的 作用,反应的化学方程式为
作用,反应的化学方程式为___________ 。若改用加入 溶液,还会产生
溶液,还会产生 沉淀,可能的原因是:
沉淀,可能的原因是: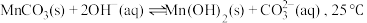 时,该反应的平衡常数的对数值
时,该反应的平衡常数的对数值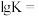
___________ (保留1位小数)。
(6)要将“溶解”后的溶液制得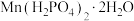 晶体,操作X为
晶体,操作X为___________ 、___________ 、过滤、洗涤、干燥。
 和铁氧化物组成,还含有
和铁氧化物组成,还含有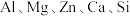 等元素)为原料制备
等元素)为原料制备 及
及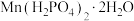 的工艺流程如下:
的工艺流程如下: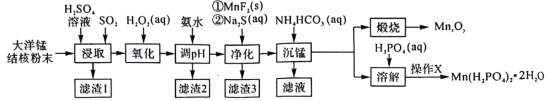
 范围如下:
范围如下:| 金属离子 |  |  |  |  |  |  |
开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 |
完全沉淀的 | 10.2 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 |
 时,
时,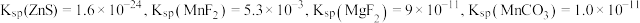 。
。回答下列问题:
(1)锰元素在元素周期表中的位置为
(2)“浸取”时,有副产物
 生成。该副反应过程中氧化剂与还原剂的物质的量之比为
生成。该副反应过程中氧化剂与还原剂的物质的量之比为 生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为
生成率的影响如图所示,为了减少副产物的生成并降低能耗,最适宜的温度为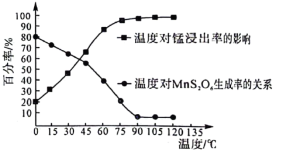
 B.
B.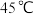 C.
C. D.
D.
(3)加氨水“调
 ”时,应控制的
”时,应控制的 范围是
范围是(4)“净化”后,过滤出“滤渣3”,所得滤液中
 的最低浓度为
的最低浓度为 。
。(5)“沉锰”时,加入过量的
 溶液与溶液中的
溶液与溶液中的 作用,反应的化学方程式为
作用,反应的化学方程式为 溶液,还会产生
溶液,还会产生 沉淀,可能的原因是:
沉淀,可能的原因是: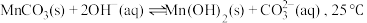 时,该反应的平衡常数的对数值
时,该反应的平衡常数的对数值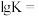
(6)要将“溶解”后的溶液制得
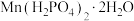 晶体,操作X为
晶体,操作X为
您最近半年使用:0次
解题方法
2 . 草酸(H2C2O4)、草酸铵[(NH4)2C2O4]是重要的化合物。回答下列问题:
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:_______________ (装置可重复利用)。装置F中发生的化学反应方程式为_______________ 。
②能证明草酸晶体分解产物中有CO的现象是_______________ 。
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为 。该反应中,还原剂为
。该反应中,还原剂为______________ (填化学式),若称取mg草酸晶体(H2C2O4·2H2O)粗产品,配成100mL溶液于锥形瓶中,加入V mL a mol·L-1KMnO4溶液,恰好完全反应,则该草酸晶体的纯度为______________ %[M(H2C2O4·2H2O)=126g·mol-1]。
(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:______________ (填化学式)。
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示:_______________ ;“高温分解”需控制的最低温度为_______________ (经测定290~890℃过程中产生的气体只有CO2)。
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:
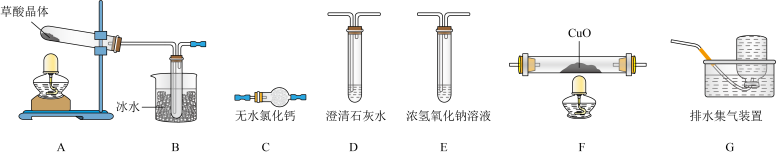
②能证明草酸晶体分解产物中有CO的现象是
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为
 。该反应中,还原剂为
。该反应中,还原剂为(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:
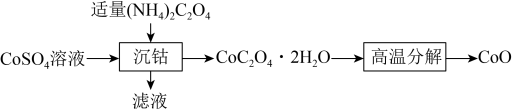
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示: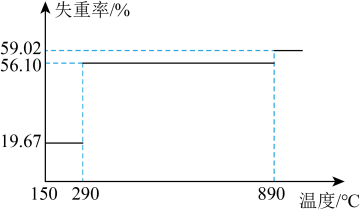
您最近半年使用:0次
解题方法
3 . 高铁酸钠(Na2FeO4)是一种优良的多功能水处理剂,具有很强的氧化性,工业上可采取干法和湿法制备Na2FeO4。回答下列问题:
(1)干法制备Na2FeO4,反应原理为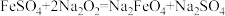 。
。
①Na2FeO4属于______________ (填“盐”“碱”或“氧化物”)。
②写出Na2O2的电子式:_______________ 。
③氧化性:Na2O2______________ (填“<”或“>”)Na2FeO4,每消耗1 mol FeSO4转移______________ mole-。
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是_______________ (填字母,下同)。_______________ 。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度_______________ (填“>”“<”或“=”)0.2mol·L-1。
④写出湿法制备Na2FeO4的化学方程式:_______________ 。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为______________ (用分数表示, →Fe3+)。
→Fe3+)。
(1)干法制备Na2FeO4,反应原理为
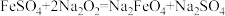 。
。①Na2FeO4属于
②写出Na2O2的电子式:
③氧化性:Na2O2
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是
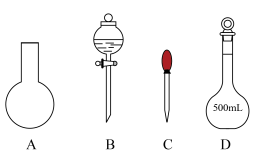
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度
④写出湿法制备Na2FeO4的化学方程式:
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为
 →Fe3+)。
→Fe3+)。
您最近半年使用:0次
4 . Ⅰ.下表是生活生产中常见的物质,表中列出了它们的一种主要成分(其中加碘盐是氯化钠中添加适量的 ,其他成分未列出)
,其他成分未列出)
(1)请你对表中①~⑦的主要成分进行分类,是电解质的是______ ,是非电解质的是______ 。(填序号)
(2)写出④在水中的电离方程式____________ 。
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:______________ 。
Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为
(4)反应中氧化剂与还原剂的个数之比为______ ,其中 反应中显出来的性质是
反应中显出来的性质是______ 。
(5)该反应中的氧化产物为______ ,每生成11.2L(标准状况下)的NO,转移的电子个数为______ 。
 ,其他成分未列出)
,其他成分未列出)名称 | 天然气 | 白酒 | 醋酸 | 小苏打 |
主要成分 | ① | ② | ③ | ④ |
名称 | 熟石灰 | 铜线 | 加碘盐 | |
主要成分 | ⑤ | ⑥Cu | ⑦NaCl和 |
(2)写出④在水中的电离方程式
(3)写出用④治疗胃酸(主要成分为盐酸)过多涉及的化学方程式:
Ⅱ.铁的化学性质比较活泼,常温下铁可以与稀硝酸发生反应,反应的化学方程式为

(4)反应中氧化剂与还原剂的个数之比为
 反应中显出来的性质是
反应中显出来的性质是(5)该反应中的氧化产物为
您最近半年使用:0次
解题方法
5 . 甘肃马家窑遗址出土的青铜刀是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、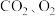 作用产生的,化学式为
作用产生的,化学式为 ,“铜绿”能跟酸反应生成铜盐、
,“铜绿”能跟酸反应生成铜盐、 和
和 。
。
(1) 属于
属于___________ (填“电解质”、“非电解质”)。
(2)从物质分类标准看,“铜绿”属于___________(填字母)。
(3)铜器表面有时会生成铜绿,这层铜绿可用化学方法除去。试写出用盐酸除去铜绿而不损伤器物的反应的离子方程式___________ 。
(4)古代人们高温灼烧孔雀石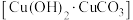 和木炭的混合物得到一种紫红色的金属铜,其化学反应式为
和木炭的混合物得到一种紫红色的金属铜,其化学反应式为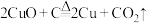 ,该反应属于___________(填序号)。
,该反应属于___________(填序号)。
(5)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应: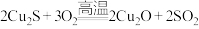 ;
; 。第一个反应中生成
。第一个反应中生成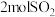 时,转移的电子数是
时,转移的电子数是___________  ,第二个反应中氧化剂有
,第二个反应中氧化剂有___________ 。如把红色的 固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为:
固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为: 。请用双线桥表示该反应电子转移的方向和数目
。请用双线桥表示该反应电子转移的方向和数目___________ 。
(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为___________ 。
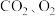 作用产生的,化学式为
作用产生的,化学式为 ,“铜绿”能跟酸反应生成铜盐、
,“铜绿”能跟酸反应生成铜盐、 和
和 。
。(1)
 属于
属于(2)从物质分类标准看,“铜绿”属于___________(填字母)。
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(4)古代人们高温灼烧孔雀石
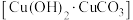 和木炭的混合物得到一种紫红色的金属铜,其化学反应式为
和木炭的混合物得到一种紫红色的金属铜,其化学反应式为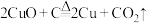 ,该反应属于___________(填序号)。
,该反应属于___________(填序号)。| A.化合反应 | B.置换反应 | C.氧化还原反应 | D.非氧化还原反应 |
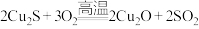 ;
; 。第一个反应中生成
。第一个反应中生成 时,转移的电子数是
时,转移的电子数是 ,第二个反应中氧化剂有
,第二个反应中氧化剂有 固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为:
固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为: 。请用双线桥表示该反应电子转移的方向和数目
。请用双线桥表示该反应电子转移的方向和数目(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为
您最近半年使用:0次
名校
6 . 为消除燃煤烟气中含有的 、
、 ,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将 气体转化为
气体转化为 的总反应化学方程式是
的总反应化学方程式是___________ 。
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。 还原NO的化学方程式是
还原NO的化学方程式是___________ 。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的 、NO转化为
、NO转化为 、
、 。
。
①在碱性条件下,NaClO溶液吸收烟气中 的离子方程式是
的离子方程式是___________ 。
②一定时间内,温度对硫、硝脱除率的影响曲线如图, 的脱除率高于NO,可能的原因是
的脱除率高于NO,可能的原因是___________ 。(1种即可)。 和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的
和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为___________ 。
 、
、 ,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
,研究者提出了若干烟气“脱硫”、“脱硝”的方法。(1)向燃煤中加入适量石灰石,高温时将
 气体转化为
气体转化为 的总反应化学方程式是
的总反应化学方程式是(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。
 还原NO的化学方程式是
还原NO的化学方程式是(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”,将烟气中的
 、NO转化为
、NO转化为 、
、 。
。①在碱性条件下,NaClO溶液吸收烟气中
 的离子方程式是
的离子方程式是②一定时间内,温度对硫、硝脱除率的影响曲线如图,
 的脱除率高于NO,可能的原因是
的脱除率高于NO,可能的原因是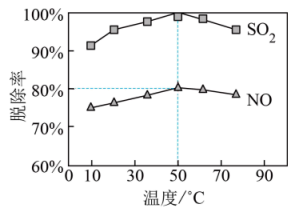
 和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的
和NO的体积比为4:1,50℃时的脱除率见图,则此吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为
您最近半年使用:0次
名校
7 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含Cr3+、Fe3+、Cu2+)和草酸泥渣(含草酸铅、硫酸铅)为原料制备铬酸铅的工艺流程如下:
回答下列问题
(1)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入碳酸钠是为了将硫酸铅转化为PbO,同时放出CO2,该转化过程的化学方程式为___________ 。
(2)滤渣的主要成分为___________ 、___________ 。(填化学式)
(3)“沉淀除杂”所得滤液中含铬化合物主要为___________ 。(填化学式)
(4)“氧化”工序中发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:___________ 。
(6)处理含 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为___________ mol。
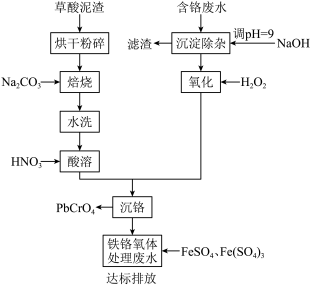

回答下列问题
(1)草酸泥渣“粉碎”的目的是
(2)滤渣的主要成分为
(3)“沉淀除杂”所得滤液中含铬化合物主要为
(4)“氧化”工序中发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因:
(6)处理含
 的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
的废水时,Cr(Ⅵ)被还原成Cr(Ⅲ)。若投入10molFeSO4,使金属阳离子恰好完全形成铁铬氧体(FeO·FexCryO3,其中FexCryO3中Fe为+3价)沉淀,理论上还需要投入Fe2(SO4)3的物质的量为
您最近半年使用:0次
2024-04-21更新
|
205次组卷
|
2卷引用:东北三省四市2024届高三教研联合体高考模拟(一)化学试卷
名校
8 . N-Zn/TiO2光催化氧化可用于工业上含硫废液的处理,光生电子(e-)与水电离出的H+、O2作用生成过羟基自由基(HO2·),空穴(h+)与水电离出的OH-作用生成羟基自由基(·OH),HO2·和·OH分别与 反应生成
反应生成 ,变化过程如下图所示。下列说法错误的是
,变化过程如下图所示。下列说法错误的是
 反应生成
反应生成 ,变化过程如下图所示。下列说法错误的是
,变化过程如下图所示。下列说法错误的是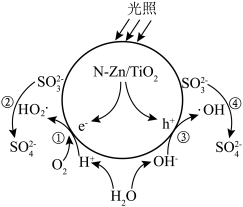
A.·OH氧化 的反应为 的反应为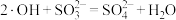 |
B.①②过程和③④过程产生的 之比为1:1 之比为1:1 |
| C.pH过低或过高均会影响催化剂的催化效果 |
D.氧化含硫废液的总反应为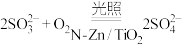 |
您最近半年使用:0次
2024-04-21更新
|
250次组卷
|
2卷引用:东北三省四市2024届高三教研联合体高考模拟(一)化学试卷
名校
9 . 常温常压下,电化学合成氨总反应方程式: ,设
,设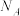 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
 ,设
,设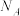 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是A. 氮气含有的共用电子对数为 氮气含有的共用电子对数为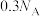 |
B.每产生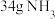 , , 失去电子数为 失去电子数为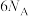 |
C. 氨水中,含 氨水中,含 分子数小于 分子数小于 |
D.标况下,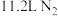 参加反应时,产生 参加反应时,产生 分子数为 分子数为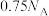 |
您最近半年使用:0次
2024-04-11更新
|
416次组卷
|
4卷引用:东北三省四市2024届高三教研联合体高考模拟(一)化学试卷
2024·安徽·一模
解题方法
10 . 雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的砷化物,中国自古有“信口雌黄”、“雄黄入药”之说。早期曾用作绘画颜料,因有抗病毒疗效也用来入药。砷元素有+2、+3 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。下列说法错误的是

| A.反应Ⅰ中Sn4+为氧化产物 |
| B.反应Ⅰ中As2S3和Sn²⁺恰好完全反应时,其物质的量a之比为2:1 |
| C.若反应Ⅱ中转移电子0.7 mol,则生成0.1molSO2 |
| D.反应Ⅲ和Ⅳ均属于非氧化还原反应 |
您最近半年使用:0次
2024-04-02更新
|
566次组卷
|
4卷引用:化学(新七省高考“15+4”)-2024年高考押题预测卷
(已下线)化学(新七省高考“15+4”)-2024年高考押题预测卷安徽省示范高中皖北协作区2024届高三联考化学试题(已下线)题型4 离子反应 氧化还原反应(25题)-2024年高考化学常考点必杀300题(新高考通用)安徽省部分学校2023-2024学年高三下学期3月联考化学试题