1 . 如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是
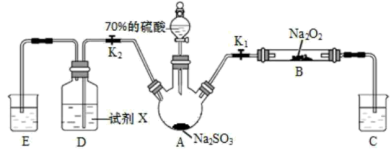

| A.为防止环境污染,装置C和E中的试剂均取用饱和的石灰水 |
| B.关闭K1,打开K2,试剂X是酸性KMnO4或FeCl3溶液,均可证明SO2有还原性 |
| C.实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性 |
| D.关闭K2,打开K1,滴加硫酸,则装置B中每消耗1molNa2O2,转移1mol电子 |
您最近一年使用:0次
2021-10-21更新
|
122次组卷
|
2卷引用:黑龙江省宾县第一中学校2021-2022学年高三上学期第一次月考化学试题
名校
2 . 食盐中所加的碘以碘酸钾(KIO3)形式存在。根据反应:IO +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO 。下列说法不正确的是
。下列说法不正确的是
 +I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO
+I-+H+→I2+H2O(未配平),可用KI淀粉试纸和食醋进行实验,证明加碘食盐中存在IO 。下列说法不正确的是
。下列说法不正确的是| A.上述反应中氧化剂和还原剂的物质的量之比为1∶5 |
| B.实验时可观察到试纸变蓝 |
| C.实验可证明该条件下I-的还原性强于Cl- |
| D.食醋中含有的乙酸是强酸,它能提供反应所需的H+ |
您最近一年使用:0次
2020-07-04更新
|
322次组卷
|
5卷引用:黑龙江省大庆市肇州县第二中学2019-2020学年高一下学期期末考试化学试题
黑龙江省大庆市肇州县第二中学2019-2020学年高一下学期期末考试化学试题北京市东城区北京景山学校2019~2020学年高一下学期期末考试化学试题贵州省铜仁市伟才学校2019-2020学年高一下学期期末考试化学(理)试题(已下线)1.3.4 氧化还原反应方程式的配平-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)江西省南昌市豫章中学20212-2022学年高一下学期第一次月考化学试题
解题方法
3 . 草酸(H2C2O4)、草酸铵[(NH4)2C2O4]是重要的化合物。回答下列问题:
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:_______________ (装置可重复利用)。装置F中发生的化学反应方程式为_______________ 。
②能证明草酸晶体分解产物中有CO的现象是_______________ 。
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为 。该反应中,还原剂为
。该反应中,还原剂为______________ (填化学式),若称取mg草酸晶体(H2C2O4·2H2O)粗产品,配成100mL溶液于锥形瓶中,加入V mL a mol·L-1KMnO4溶液,恰好完全反应,则该草酸晶体的纯度为______________ %[M(H2C2O4·2H2O)=126g·mol-1]。
(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:______________ (填化学式)。
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率( )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示:_______________ ;“高温分解”需控制的最低温度为_______________ (经测定290~890℃过程中产生的气体只有CO2)。
(1)实验表明,加热条件下,H2C2O4可分解生成CO2、CO和H2O。为了验证产物中的CO,设计如下实验装置:
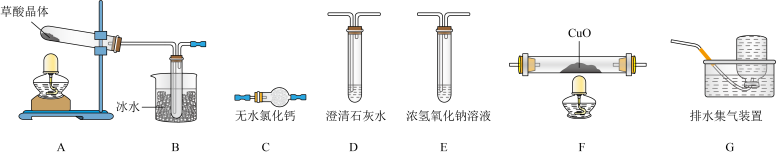
②能证明草酸晶体分解产物中有CO的现象是
(2)H2C2O4能与酸性高锰酸钾溶液反应,离子方程式为
 。该反应中,还原剂为
。该反应中,还原剂为(3)(NH4)2C2O4是良好的Co2+的沉淀剂,如下为(NH4)2C2O4加入CoSO4溶液中制备CoO的流程图:
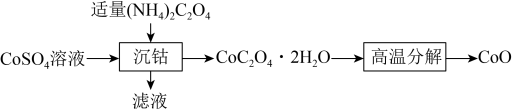
②称量mg CoC2O4·2H2O[M(CoC2O4·2H2O)=183g·mol-1]“高温分解”,测得固体的失重率(
 )与温度的关系曲线如图所示:
)与温度的关系曲线如图所示: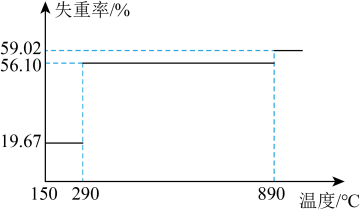
您最近一年使用:0次
名校
解题方法
4 . 实验室制备F2过程为;①KMnO4和H2O2在KF-HF介质中反应制得K2MnF6;② ;③
;③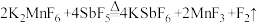 ,下列说法正确的是
,下列说法正确的是
 ;③
;③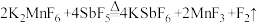 ,下列说法正确的是
,下列说法正确的是| A.①可选择圆底烧瓶作为反应发生装置 |
| B.②中反应可证明酸性:HF>HCl |
| C.③中制备和收集F2均需要无水环境 |
| D.同条件下转移相同电子数时,①和③产生气体体积比为1:2 |
您最近一年使用:0次
2023-07-23更新
|
239次组卷
|
4卷引用:黑龙江省鸡西市密山市第四中学2023-2024学年高二上学期11月月考化学试题
5 . 某同学研究浓硝酸与KSCN溶液的反应,在通风橱中进行如下实验,下列分析错误的是

已知:SCN-能被氧化为黄色的 ,
, 可聚合为红色的
可聚合为红色的

已知:SCN-能被氧化为黄色的
 ,
, 可聚合为红色的
可聚合为红色的
A.SCN-被氧化生成1mol 过程中,共失去2mol电子 过程中,共失去2mol电子 |
B.取少量③中的溶液加入 溶液,产生白色沉淀,证明最终有 溶液,产生白色沉淀,证明最终有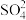 生成 生成 |
C.分析①②③知, 聚合为 聚合为 的速率大于 的速率大于 被浓硝酸氧化的速率 被浓硝酸氧化的速率 |
| D.浓硝酸在②③反应中,既表现强氧化性又表现酸性 |
您最近一年使用:0次
名校
解题方法
6 . Ⅰ.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_______ 与盐酸反应最剧烈,_______ 与盐酸反应产生的气体最多(填元素符号)。
(2)向 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:_______ 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
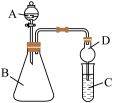
(3)仪器A的名称为_______ 。
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③ 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为_______ 、_______ (填序号)。但有同学认为该装置有缺陷,如何改进?_______ 。
Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式_______ 。
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现: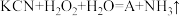 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式_______ ,如此反应中有6.72L(标准状况)气体生成,转移电子数目为_______ 。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向
 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(3)仪器A的名称为
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③
 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现:
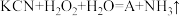 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式
您最近一年使用:0次
名校
7 . 现有16.8gFe粉,加入VL1mol·L-1HNO3溶液使其恰好完全溶解后,向所得溶液中继续滴加稀硫酸,至不再产生气泡。下列说法正确的是
| A.反应过程中产生气体的总体积为6.72L |
| B.V=0.8 |
C.该实验可以证明Fe2+与NO 不能大量共存 不能大量共存 |
| D.滴加稀硫酸时,产生的气体为SO2 |
您最近一年使用:0次
2022-04-19更新
|
309次组卷
|
6卷引用:黑龙江省鸡西市2021-2022学年高一下学期期末考试化学试题
名校
8 . 探究“外界条件对化学反应速率的影响”,可以用到定性分析、定量分析和对比分析等多种方法:
Ⅰ、H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
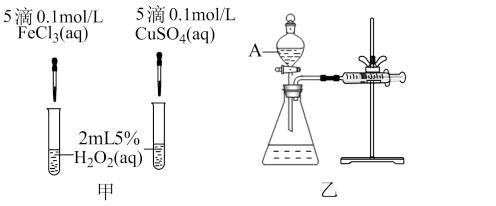
(1)若利用图甲装置,可通过观察_______ 现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______ 。
(3)若利用乙实验可进行定量分析,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是_______ 。
Ⅱ、 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
(4)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,每消耗1 mol H2C2O4转移_______ mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥_______ 。
(5)要探究温度对化学反应速率的影响,应选择的实验编号是_______ (填编号,下同),探究反应物浓度对化学反应速率的影响,应选择的实验编号是_______ 。
(6)该小组发现保持温度恒定,反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:_______ ,若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_______ (填序号)。

A.硫酸钾 B.硫酸锰 C.稀硫酸 D.二氯化锰
Ⅰ、H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。

(1)若利用图甲装置,可通过观察
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是
(3)若利用乙实验可进行定量分析,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
Ⅱ、 某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(5)要探究温度对化学反应速率的影响,应选择的实验编号是
(6)该小组发现保持温度恒定,反应速率走势如图,其中t1~t2时间内速率变快的主要原因可能是:

A.硫酸钾 B.硫酸锰 C.稀硫酸 D.二氯化锰
您最近一年使用:0次
名校
9 . 乙二酸俗称草酸,其钠盐和钾盐易溶于水,钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色、熔点为101℃。易溶于水,150℃-160℃大量升华,170℃以上分解。回答下列问题:
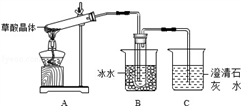
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是__________________________ ,由此可知草酸晶体分解的产物中有______________ ,装置B的主要作用是_____________________________________ 。
(2)乙组同学认为草酸晶体分解的产物中含有H2O和CO,为进行验证,选用下图中的装置进行实验。

实验装置连接的合理顺序为a→___________________ →k(填小写字母),能证明草酸晶体分解产物中有CO的现象是______________________________________________________________ ,草酸晶体受热分解的化学方程式为_______________________________________________________________ 。
(3)用酸性KMnO4溶液滴定反应结束后的F溶液,测定Na2C2O4的浓度
实验步骤:取20.00mLF中的溶液于锥形瓶中,再向锥形瓶中加入足量稀H2SO4,用0.1600mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在_________ (填“酸式”或“碱式”)滴定管中。
②滴定终点的现象是_______________________________________________________ 。
③计算F溶液中Na2C2O4的物质的量浓度为_________ 。

(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是
(2)乙组同学认为草酸晶体分解的产物中含有H2O和CO,为进行验证,选用下图中的装置进行实验。

实验装置连接的合理顺序为a→
(3)用酸性KMnO4溶液滴定反应结束后的F溶液,测定Na2C2O4的浓度
实验步骤:取20.00mLF中的溶液于锥形瓶中,再向锥形瓶中加入足量稀H2SO4,用0.1600mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液25.00mL。
①高锰酸钾溶液应装在
②滴定终点的现象是
③计算F溶液中Na2C2O4的物质的量浓度为
您最近一年使用:0次
名校
10 . 硫的多种化合物在工业中有重要应用。
(1)Na2S2可以做制革工业中原皮的脱毛剂,写出Na2S2的电子式______________ 。
(2)连二亚硫酸钠(Na2S2O4)又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为_____________
②将甲酸(HCOOH)和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,该反应的化学方程式为_________________ 。
③Na2SO4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,反应的化学方程式为____________ 。
(3)铬会造成环境污染,某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准。
①写出Na2SO5参加反应的离子方程式_______________________ 。
②处理后的废水中Cr3+的物质的量浓度为____________________ 。
(4)氢硫酸和亚硫酸是两种弱酸,回答下列问题
①0.1mol/L H2SO4与0.2mol/L H2S溶液等体积混合,所得溶液中S2-浓度为_____ mol/L。(已知氢硫酸Ka1=1.0×10-8、Ka2=1.0×10-15,忽略H2S和H2O电离产生的H+)
②已知亚硫酸的Ka1=1.0×10-2、Ka2=6.0×10-13,设计实验证明亚硫酸第一步不完全电离。(可用实验用品:0.1mol/L亚硫酸、0.1mol/L NaHSO3溶液、0.1mol/L Na2SO3溶液,广泛pH试纸、pH计)
(1)Na2S2可以做制革工业中原皮的脱毛剂,写出Na2S2的电子式
(2)连二亚硫酸钠(Na2S2O4)又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为
②将甲酸(HCOOH)和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,该反应的化学方程式为
③Na2SO4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,反应的化学方程式为
(3)铬会造成环境污染,某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准。
①写出Na2SO5参加反应的离子方程式
②处理后的废水中Cr3+的物质的量浓度为
(4)氢硫酸和亚硫酸是两种弱酸,回答下列问题
①0.1mol/L H2SO4与0.2mol/L H2S溶液等体积混合,所得溶液中S2-浓度为
②已知亚硫酸的Ka1=1.0×10-2、Ka2=6.0×10-13,设计实验证明亚硫酸第一步不完全电离。(可用实验用品:0.1mol/L亚硫酸、0.1mol/L NaHSO3溶液、0.1mol/L Na2SO3溶液,广泛pH试纸、pH计)
| 操作简述 | |
| 现象或数据 | |
| 结论 | H2SO3第一步不完全电离 |
您最近一年使用:0次



