名校
解题方法
1 . 以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列说法不正确 的是


| A.焙烧时产生的SO2气体可以用NaOH溶液吸收 |
| B.滤液中的铝元素主要以AlO2-存在,可以往滤液中通入过量二氧化碳,经过滤、灼烧生产氧化铝 |
| C.可以将少量Fe3O4产品溶于稀硫酸中,再滴入酸性高锰酸钾溶液,若溶液褪色则证明产品中含有FeO |
| D. Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2):n(Fe2O3)=1:16 |
您最近一年使用:0次
2020-02-28更新
|
284次组卷
|
5卷引用:重庆市渝北区、合川区、江北区等七区2019-2020学年高一下学期期末联考化学试题
名校
解题方法
2 . 氧化还原反应在生产生活中有着重要作用,回答下列有关问题:
(1)某同学设计如下实验研究 的性质,已知淀粉遇碘会变蓝,能证明
的性质,已知淀粉遇碘会变蓝,能证明 具有还原性的实验是
具有还原性的实验是_______________ 。(填序号)。
(2)某届奥运会期间,由于工作人员将84消毒液(有效成分 )与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
_______________  (填“>”或“<”);当参加反应的
(填“>”或“<”);当参加反应的 和
和 的个数比为
的个数比为 时,该反应的还原产物为
时,该反应的还原产物为_______________ (填字母序号)。
aA. B.
B. C.
C. D.
D. E.
E. F.
F.
(3)2023年10月26日神舟十七号载人飞船发射成功。某种飞船以联氨 和
和 为动力源,发生反应:
为动力源,发生反应: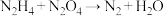 ,反应温度可高达
,反应温度可高达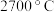 。
。
①配平该方程式_____________ 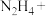 ________
________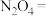 _________
_________ _________
_________ 。
。
②该反应中,氧化产物与还原产物的物质的量之比为_______________ 。
(4)补全并配平下列方程式____________
_______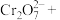 _________
_________ __________
__________ _____________
_____________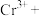
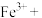 ________
________
(5)试分析: 反应中,被
反应中,被 氧化的
氧化的 的物质的量为
的物质的量为_______________  。
。
(1)某同学设计如下实验研究
 的性质,已知淀粉遇碘会变蓝,能证明
的性质,已知淀粉遇碘会变蓝,能证明 具有还原性的实验是
具有还原性的实验是| 序号 | 实验操作 | 实验现象 | ||
| ① | 向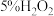 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 |
| ||
| ② | 向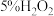 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 )与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
 (填“>”或“<”);当参加反应的
(填“>”或“<”);当参加反应的 和
和 的个数比为
的个数比为 时,该反应的还原产物为
时,该反应的还原产物为aA.
 B.
B. C.
C. D.
D. E.
E. F.
F.
(3)2023年10月26日神舟十七号载人飞船发射成功。某种飞船以联氨
 和
和 为动力源,发生反应:
为动力源,发生反应: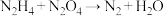 ,反应温度可高达
,反应温度可高达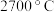 。
。①配平该方程式
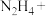 ________
________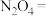 _________
_________ _________
_________ 。
。②该反应中,氧化产物与还原产物的物质的量之比为
(4)补全并配平下列方程式
_______
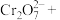 _________
_________ __________
__________ _____________
_____________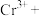
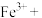 ________
________(5)试分析:
 反应中,被
反应中,被 氧化的
氧化的 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
名校
3 . 氮及其化合物是中学化学重要内容,请回答下列问题:
(1)工商管理条例明文规定:食品生产经营者不得购进、存放、使用亚硝酸盐作为食品添加剂。亚硝酸钠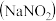 属于
属于 _______  填“氧化物”或“盐”
填“氧化物”或“盐” ,它是一种强氧化剂,与
,它是一种强氧化剂,与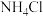 共热生成
共热生成 ,是实验室制
,是实验室制 的方法,写出
的方法,写出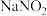 与
与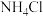 共热发生反应的化学方程式
共热发生反应的化学方程式 _______ 。若有 发生反应,则反应中电子转移的数目为
发生反应,则反应中电子转移的数目为 _______ 。
(2)亚硝酸钠外观与食盐相似,且均有咸味。某课外探究小组欲对亚硝酸钠与氯化钠进行鉴别,其鉴别方法如下:将样品放入稀硫酸与另外一种溶液 溶质为
溶质为 的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液无变化,则可以证明该样品盐为氯化钠。
的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液无变化,则可以证明该样品盐为氯化钠。 与亚硝酸钠发生的反应可表示为
与亚硝酸钠发生的反应可表示为 已配平
已配平 ,则
,则 是
是 _______  填化学式
填化学式 ,该反应的离子方程式为
,该反应的离子方程式为 _______ 。
(3)甲、乙两同学欲用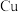 和
和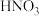 制取等量的
制取等量的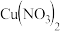 晶体,甲用稀硝酸,乙用浓硝酸。你认为用
晶体,甲用稀硝酸,乙用浓硝酸。你认为用 _______ 硝酸好 填“浓”或“稀”
填“浓”或“稀” ,理由是
,理由是 _______ 。
(1)工商管理条例明文规定:食品生产经营者不得购进、存放、使用亚硝酸盐作为食品添加剂。亚硝酸钠
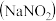 属于
属于  填“氧化物”或“盐”
填“氧化物”或“盐” ,它是一种强氧化剂,与
,它是一种强氧化剂,与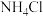 共热生成
共热生成 ,是实验室制
,是实验室制 的方法,写出
的方法,写出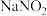 与
与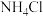 共热发生反应的化学方程式
共热发生反应的化学方程式  发生反应,则反应中电子转移的数目为
发生反应,则反应中电子转移的数目为 (2)亚硝酸钠外观与食盐相似,且均有咸味。某课外探究小组欲对亚硝酸钠与氯化钠进行鉴别,其鉴别方法如下:将样品放入稀硫酸与另外一种溶液
 溶质为
溶质为 的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液无变化,则可以证明该样品盐为氯化钠。
的混合液中,振荡,再滴加淀粉溶液,如果溶液显蓝色,则可以证明该样品盐是亚硝酸钠,如果溶液无变化,则可以证明该样品盐为氯化钠。 与亚硝酸钠发生的反应可表示为
与亚硝酸钠发生的反应可表示为 已配平
已配平 ,则
,则 是
是  填化学式
填化学式 ,该反应的离子方程式为
,该反应的离子方程式为 (3)甲、乙两同学欲用
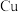 和
和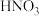 制取等量的
制取等量的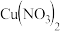 晶体,甲用稀硝酸,乙用浓硝酸。你认为用
晶体,甲用稀硝酸,乙用浓硝酸。你认为用  填“浓”或“稀”
填“浓”或“稀” ,理由是
,理由是
您最近一年使用:0次
2022-05-27更新
|
128次组卷
|
3卷引用:重庆市缙云教育联盟2021-2022学年高一5月质量检测化学试题
解题方法
4 . 如图为化学“五元环”图案,在图案上分别写了Cl2、CO2、Na2O2、Na2CO3、FeCl3五种物质,图中相连的两种物质均可根据某种“分类依据”归属为一类,相交部分A、B、C、D为其相应的“分类依据”的代号。请回答下列问题:

(1)分类依据A、B、C、D中可总结为“两种物质都是盐”的是___________ (填代号)。
(2)写出Na2CO3的电离方程式:___________ 。
(3)潜水艇和消防员的呼吸面具中,Na2O2所发生的主要反应的方程式为:___________ 。
(4) 在烧杯中加入20 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入几滴饱和FeCl3溶液,继续加热至呈红褐色后停止加热。证明有胶体生成的实验操作及现象是___________
(5)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型净水剂,可用FeCl3通过下述途径制取:FeCl3+ NaOH+ NaClO→Na2FeO4+ NaCl+ H2O
①该反应中氧化剂是___________ ,氧化产物为___________ 。
②当有0.3 mol电子转移时,参加反应的n(NaOH)=___________ mol。

(1)分类依据A、B、C、D中可总结为“两种物质都是盐”的是
(2)写出Na2CO3的电离方程式:
(3)潜水艇和消防员的呼吸面具中,Na2O2所发生的主要反应的方程式为:
(4) 在烧杯中加入20 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入几滴饱和FeCl3溶液,继续加热至呈红褐色后停止加热。证明有胶体生成的实验操作及现象是
(5)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型净水剂,可用FeCl3通过下述途径制取:FeCl3+ NaOH+ NaClO→Na2FeO4+ NaCl+ H2O
①该反应中氧化剂是
②当有0.3 mol电子转移时,参加反应的n(NaOH)=
您最近一年使用:0次
解题方法
5 . 氧化还原反应是一类重要的化学反应。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是__ (填1或2)。
(2)写出实验2中发生反应的离子方程式___ 。
(3)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长,则该反应说明氧化性:NaClO___ H2O2(填“>”或“<”),若反应生成11.2L(标况下)O2时,转移电子的数目为___ 。
Ⅱ.聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4含少量碳及二氧化硅)为原料制备的流程如图:
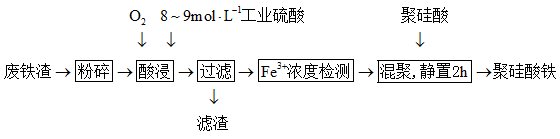
(4)请写出上述流程中“酸浸”时Fe3O4与硫酸反应的离子方程式__ 。
(5)上述流程中“酸浸”时,通入O2的目的是__ 。
(6)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;再用酸性K2Cr2O7标准溶液测定Fe2+的量(Cr2O 被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是__ 。
(7)全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式___ 。
______NaIO3+______NaHSO3+______NaHSO4=_______Na2SO4+_______I2+______H2O
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 实验 | 操作 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | 溶液紫色褪去;有大量气泡产生 |
| 2 | 向5%H2O2溶液先加稀硫酸酸化,再滴加淀粉碘化钾溶液 | 溶液变蓝 |
(2)写出实验2中发生反应的离子方程式
(3)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长,则该反应说明氧化性:NaClO
Ⅱ.聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4含少量碳及二氧化硅)为原料制备的流程如图:

(4)请写出上述流程中“酸浸”时Fe3O4与硫酸反应的离子方程式
(5)上述流程中“酸浸”时,通入O2的目的是
(6)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;再用酸性K2Cr2O7标准溶液测定Fe2+的量(Cr2O
 被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是
被还原为Cr3+),则SnCl2、Fe2+和Cr3+三者中还原性最强的是(7)全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式
______NaIO3+______NaHSO3+______NaHSO4=_______Na2SO4+_______I2+______H2O
您最近一年使用:0次
名校
6 . 草酸与高锰酸钾在酸性条件下能够发生反应: MnO +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
通过下表实验探究外界因素对反应速率的影响。
(1)该反应中氧化剂和还原剂的物质的量之比为___________ 。
(2)其中T1=___________ ;V2=___________ 。
(3)若t1 <8,则由实验可得出的结论是___________ ;忽略溶液体积的变化,利用实验B中的数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___________ 。
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①同学们据此提出以下假设:
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:反应生成的K+或SO 该反应有催化作用
该反应有催化作用
丙同学认为假设3不合理,其理由是___________ 。
②丁同学用如下实验证明假设2:除了酸性高锰酸钾和草酸外,还需要选择的试剂是___________ 。(填化学式)
 +H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)通过下表实验探究外界因素对反应速率的影响。
| 实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
| 酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | |||
| A | 293 | 4 | 0.02 | 4 | 0.1 | 0 | t1 |
| B | T1 | 4 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 4 | 0.02 | V2 | 0.1 | 1 | t2 |
(2)其中T1=
(3)若t1 <8,则由实验可得出的结论是
(4)在实验中,草酸(H2C2O4)溶液与KMnO4酸性溶液反应时,褪色总是先慢后快。
①同学们据此提出以下假设:
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:反应生成的K+或SO
 该反应有催化作用
该反应有催化作用丙同学认为假设3不合理,其理由是
②丁同学用如下实验证明假设2:除了酸性高锰酸钾和草酸外,还需要选择的试剂是
您最近一年使用:0次
2021-10-23更新
|
185次组卷
|
3卷引用:重庆市缙云教育联盟2022-2023学年高二下学期6月期末考试化学试题
7 . Cl2是一种重要的化工原料,结合氯气的相关知识解决下列问题。
(1)运输氯气的钢瓶上应贴的标签为_____________ 。
(2)工业上将氯气通入石灰乳制取漂白粉,写出该反应的化学方程式_________________ 。
(3)漂白粉的有效成分是(填化学式)_____________ 。
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里欲用KMnO4固体来配制500 mL 0.1mol/L的KMnO4溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、__________________ 。
②下列操作会导致实验结果偏小的是___________ (填字母)。
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为_________ mL。(已知MnO4-在此条件被还原为Mn2+)
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2 + 2Br-=2Cl-+ Br2)。

①能证明氯水具有漂白性的是__________ (填“a”、“b”、“c”或“d”),现象是______________ 。
②a中发生反应的离子方程式是____________ 。
(1)运输氯气的钢瓶上应贴的标签为
| A.腐蚀品 | B.爆炸品 | C.有毒品 | D.易燃品 |
(3)漂白粉的有效成分是(填化学式)
(4)实验室可以用KMnO4与浓盐酸在常温下制备Cl2。高锰酸钾溶液常用于物质的定性检验与定量分析。某化学兴趣小组在实验室里欲用KMnO4固体来配制500 mL 0.1mol/L的KMnO4溶液。
①需用的仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
②下列操作会导致实验结果偏小的是
a.转移时没有洗涤烧杯、玻璃棒
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
d.加水定容时俯视刻度线
③用配好的该浓度的KMnO4溶液与300mL 0.2mol/L的KI溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的体积为
(5)氯水中含有多种成分,因而具有很多性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量,已知:Cl2 + 2Br-=2Cl-+ Br2)。

①能证明氯水具有漂白性的是
②a中发生反应的离子方程式是
您最近一年使用:0次
8 . HNO3是极其重要的化工原料。工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的。据此完成下列试题:
(1)假如氨制NO的产率是96%,NO制硝酸的产率是92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为___________ m3(四舍五入保留整数部分)。
(2)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
①设循环操作的次数为n,NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式为________ 。
②一定量的二氧化氮气体要经过_____ 次循环操作,才能使95%的二氧化氮转变为硝酸。
(3)上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:c(H2)<6.6mol/L、c(N2)<10mol/L、c(NH4+)<10mol/L、0.1mol/L<c(NO)<10mol/L、c(NO2)>0.1mol/L。各气相产物成分及含量随HNO3浓度变化曲线如右图所示。

①写出Mg与11mol/L的HNO3反应的化学方程式________________________________ 。
②960gMg与1000L4mol/L的HNO3恰好完全反应,常温常压下收集到244L气体,试通过计算写出反应方程式________________________________________________________ 。
(1)假如氨制NO的产率是96%,NO制硝酸的产率是92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为
(2)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
①设循环操作的次数为n,NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式为
②一定量的二氧化氮气体要经过
(3)上述方法制备的HNO3为稀HNO3,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:c(H2)<6.6mol/L、c(N2)<10mol/L、c(NH4+)<10mol/L、0.1mol/L<c(NO)<10mol/L、c(NO2)>0.1mol/L。各气相产物成分及含量随HNO3浓度变化曲线如右图所示。

①写出Mg与11mol/L的HNO3反应的化学方程式
②960gMg与1000L4mol/L的HNO3恰好完全反应,常温常压下收集到244L气体,试通过计算写出反应方程式
您最近一年使用:0次
名校
解题方法
9 . 铝热反应是铝的一个重要性质,该性质用途十分广泛。 “铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________ (填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________ ,反应的离子方程式为______________________________________ 。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________ (填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:____________________
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为__________________ 。
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________ ;
(4)熔融物中铝元素的物质的量为________ mol。
(5)B点对应的沉淀的物质的量为______ mol,A点对应的氢氧化钠溶液的体积为________ mL。
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
| 沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
(4)熔融物中铝元素的物质的量为
(5)B点对应的沉淀的物质的量为
您最近一年使用:0次
2017-02-23更新
|
289次组卷
|
3卷引用:重庆市北碚区2020届高三上学期第一次诊断性考试理综化学试题
重庆市北碚区2020届高三上学期第一次诊断性考试理综化学试题(已下线)考点15 金属元素及其化合物-2020年高考化学命题预测与模拟试题分类精编2016-2017学年湖北省武汉市第二中学高一上学期期末考试化学试卷
10 . 危化仓库中往往存有钠、钾、液氯、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)钠、钾都为活泼金属,在空气中着火时会剧烈燃烧。若金属Na着火,应用______ 来扑(盖)灭。
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成分是___________ 。(填化学式)
(3)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3═4N2↑+2HNO3+9H2O,则被氧化和被还原的氮元素质量之比为___________ 。
(4)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为___________ mol。
(5)NaCN属于剧毒物质,有一种处理方法其原理为:CN﹣与S2O32﹣反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_____________ 。
(1)钠、钾都为活泼金属,在空气中着火时会剧烈燃烧。若金属Na着火,应用
(2)氯气是一种黄绿色的有毒气体,工业上常用NH3来检验氯气是否发生泄漏,检验时若产生白烟,证明氯气发生了泄漏。则白烟的主要成分是
(3)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3═4N2↑+2HNO3+9H2O,则被氧化和被还原的氮元素质量之比为
(4)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为
(5)NaCN属于剧毒物质,有一种处理方法其原理为:CN﹣与S2O32﹣反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:
您最近一年使用:0次



