名校
解题方法
1 . 已知反应: ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是
 ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是A.转移电子数为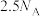 |
B.断裂的 键数为 键数为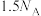 |
| C.还原产物比氧化产物多0.5mol |
D.将生成物配制成1L水溶液,溶液中 |
您最近半年使用:0次
名校
2 . 已知反应: 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 (标准状况)
(标准状况) ,下列叙述错误的是
,下列叙述错误的是
 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 (标准状况)
(标准状况) ,下列叙述错误的是
,下列叙述错误的是A.转移的电子数为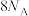 | B.生成的 价层电子对数为 价层电子对数为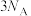 |
C.参加反应的单质硫质量为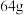 | D.参加反应的 分子数为 分子数为 |
您最近半年使用:0次
名校
3 . 一定条件下, 与
与 在活性
在活性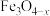 表面转化为
表面转化为 ,其部分反应机理如图所示。下列说法正确的是
,其部分反应机理如图所示。下列说法正确的是
 与
与 在活性
在活性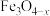 表面转化为
表面转化为 ,其部分反应机理如图所示。下列说法正确的是
,其部分反应机理如图所示。下列说法正确的是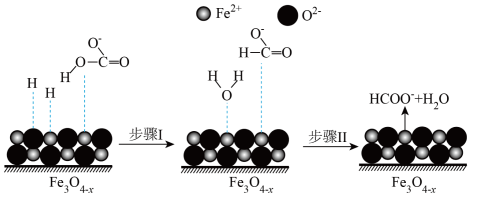
A.步骤Ⅰ中 发生氧化反应 发生氧化反应 | B.生成1mol 理论上转移2mol电子 理论上转移2mol电子 |
C.吸附在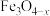 表面的两个氢原子带相同电荷 表面的两个氢原子带相同电荷 | D.整个反应过程中只有极性键的断裂与生成 |
您最近半年使用:0次
解题方法
4 . 科学研究发现某些酶可以促进H+和e-的转移(如下图a、b和c过程),可将海洋中的NO2转化为N2,反应过如图所示。下列说法正确的是
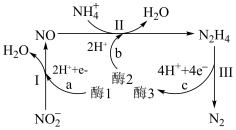
A.过程I的离子方程式为: +2H+ +2H+ NO+H2O NO+H2O |
| B.消耗1molNO,b过程转移2mole- |
| C.高温有利于促进该过程中H+和e-的转移 |
| D.过程I→III的总反应中氧化剂和还原剂的物质的量之比为1∶1 |
您最近半年使用:0次
5 . (I)铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别 胶体和
胶体和 溶液的方法是
溶液的方法是__________ 。
(2)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式__________ ,现象为__________ 。
(3)绿矾( )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
①为防止 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量___________ 。
②甲同学取 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为__________ 。乙同学认为甲同学的实验不够严谨,该组同学在 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是__________ 。
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有 和
和 ,且
,且 。
。
(4)从废液中可回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:___________ (填物质名称)。
②物质X为___________ 。
A. B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。
①对反应后的溶液分析错误的是___________ 。
A.溶液中一定含有
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有 ,则可能有固体析出
,则可能有固体析出
D.溶液若有 剩余,则一定没有固体析出
剩余,则一定没有固体析出
②若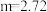 ,则充分反应后得到
,则充分反应后得到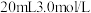 氯化亚铁溶液和
氯化亚铁溶液和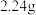 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)鉴别
 胶体和
胶体和 溶液的方法是
溶液的方法是(2)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式(3)绿矾(
 )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。①为防止
 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量②甲同学取
 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有
 和
和 ,且
,且 。
。(4)从废液中可回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案: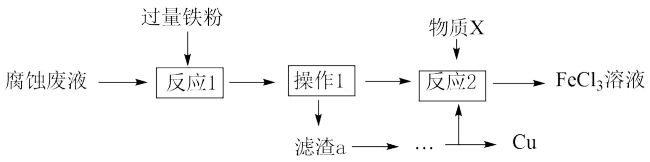
②物质X为
A.
 B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液
 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。①对反应后的溶液分析错误的是
A.溶液中一定含有

B.若有固体剩余,则固体中一定含有铁
C.若溶液中有
 ,则可能有固体析出
,则可能有固体析出D.溶液若有
 剩余,则一定没有固体析出
剩余,则一定没有固体析出②若
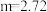 ,则充分反应后得到
,则充分反应后得到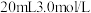 氯化亚铁溶液和
氯化亚铁溶液和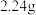 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为
您最近半年使用:0次
名校
6 . 已知 为阿伏加德罗常数的值。下列说法中正确的是
为阿伏加德罗常数的值。下列说法中正确的是
 为阿伏加德罗常数的值。下列说法中正确的是
为阿伏加德罗常数的值。下列说法中正确的是A.标准状况下,33.6LC2H4分子中含有 键数为 键数为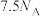 |
B.100g46%的甲酸水溶液中,含有的氧原子数为 |
C.常温下,将5.6g铁放入足量浓H2SO4中,反应转移的电子数为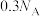 |
D.1LpH=2的H2SO4溶液中H+数目为 |
您最近半年使用:0次
名校
解题方法
7 . 硫铁矿(含 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
(1)硫铁矿中 元素的化合价为
元素的化合价为___________ 。
(2)为了使反应I燃烧得更充分,可以采用的措施是___________ 。
(3)将A通入新制碘水中,发现溶液褪色,发生的离子反应方程式为______________________ 。
(4)下列关于C的说法正确的是___________。
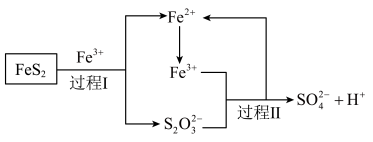
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示: ,转移的电子的物质的量为
,转移的电子的物质的量为___________ 。
②脱硫过程中产生的 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式___________ 。
③从氧化还原角度分析,若要制备 应选择
应选择___________ (填字母)。
A. B.
B. C.
C. D.
D.
 )是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系:
)是一种重要的化学矿物原料,也是工业制硫酸的主要原料,其煅烧过程及产物存在如下转化关系: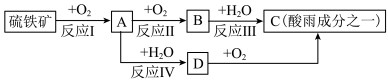
(1)硫铁矿中
 元素的化合价为
元素的化合价为(2)为了使反应I燃烧得更充分,可以采用的措施是
(3)将A通入新制碘水中,发现溶液褪色,发生的离子反应方程式为
(4)下列关于C的说法正确的是___________。
A.酸雨指的是 的雨水 的雨水 |
| B.浓硫酸可以和铁发生反应,不能用钢瓶盛装浓硫酸 |
| C.浓硫酸有强氧化性,稀硫酸没有氧化性 |
| D.稀硫酸长时间放置在空气中浓度会变高,浓硫酸长时间放置在空气中浓度会变低 |
(5)工业上为了防止污染,可以利用氧化亚铁硫杆菌(T.f)对硫铁矿进行催化脱硫,该过程如图所示:
 ,转移的电子的物质的量为
,转移的电子的物质的量为②脱硫过程中产生的
 在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式
在酸性溶液中会形成淡黄色沉淀并产生刺激性气味的气体,写出其离子方程式③从氧化还原角度分析,若要制备
 应选择
应选择A.
 B.
B. C.
C. D.
D.
您最近半年使用:0次
2024-04-05更新
|
568次组卷
|
4卷引用:重庆市第七中学校2023-2024学年高一下学期第一次月考化学试卷
名校
8 . 工业上以侯氏制碱法为基础生产焦亚硫酸钠(Na2S2O5)的工艺流程如图:
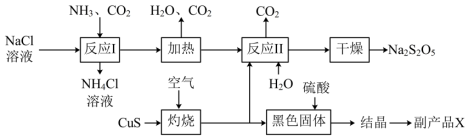
(1)硫元素在周期表中位置_______ 。
(2)反应I的化学方程式为_______ ;在进行反应时,向NaCl溶液中先通入_______ (填“CO2”或“NH3”)。
(3)已知“灼烧”时会生成SO2,则其化学方程式为_______ 。
(4)已知Na2S2O5与稀硫酸反应会生成SO2,则其离子方程式为_______ 。
(5)副产品X化学式为_______ ;该生产中可循环利用的物质为_______ (化学式)。
(6)为了减少产品Na2S2O5中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为_______ 。

(1)硫元素在周期表中位置
(2)反应I的化学方程式为
(3)已知“灼烧”时会生成SO2,则其化学方程式为
(4)已知Na2S2O5与稀硫酸反应会生成SO2,则其离子方程式为
(5)副产品X化学式为
(6)为了减少产品Na2S2O5中的杂质含量,理论上需控制反应II中气体与固体反应物的物质的量之比为
您最近半年使用:0次
名校
解题方法
9 . 我国科研工作者开发了一种空腔串联反应器,为电催化还原 提供了一种可行的转化方案,其原理如图所示,设
提供了一种可行的转化方案,其原理如图所示,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 提供了一种可行的转化方案,其原理如图所示,设
提供了一种可行的转化方案,其原理如图所示,设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A. 中所含中子数为 中所含中子数为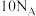 |
B.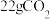 分子中含有 分子中含有 键数为 键数为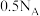 |
C.若途径1所得产物物质的量之比为 ,则形成共价键数目为 ,则形成共价键数目为 |
D.途径2生成标准状况下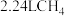 ,反应转移电子数为 ,反应转移电子数为 |
您最近半年使用:0次
解题方法
10 . 在工业生产中要制取某种物质,除了要考虑反应进行的可能性,还要考虑原料来源、成本高低和设备要求等因素,以选取最适当的方法。例如,工业上制取NaOH(a)一般不采用Na2O(b)与H2O(c)反应的方法(Na2O作为原料,来源少、成本高),而主要采用电解饱和食盐水的方法,过去也曾采用Na2CO3(d)与Ca(OH)2(e)反应的方法。回答下列问题:
(1)Na与水反应的离子方程式为______ 。
(2)电解饱和食盐水的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
①该反应中的还原剂为______ 填化学式,下同),被氧化的物质为______ 。
②用双线桥法表示该反应中电子转移的方向和数目:______ 。
③每生成0.2gH2,同时生成Cl2的质量为______ g。
(3)d和e反应可制得a:将Na2CO3溶液加入澄清石灰水中,发生反应的离子方程式为______ 。
(1)Na与水反应的离子方程式为
(2)电解饱和食盐水的化学方程式为2NaCl+2H2O
 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。①该反应中的还原剂为
②用双线桥法表示该反应中电子转移的方向和数目:
③每生成0.2gH2,同时生成Cl2的质量为
(3)d和e反应可制得a:将Na2CO3溶液加入澄清石灰水中,发生反应的离子方程式为
您最近半年使用:0次



