名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: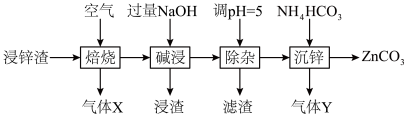
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):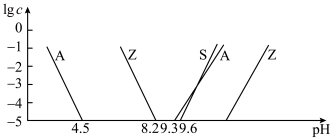
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近半年使用:0次
昨日更新
|
106次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
解题方法
2 . 下列有关 的说法中正确的是
的说法中正确的是
 的说法中正确的是
的说法中正确的是A. 能与水反应生成硝酸,在反应中 能与水反应生成硝酸,在反应中 只是还原剂 只是还原剂 |
B.除去 中混有的 中混有的 ,可将混合气体通过水,将 ,可将混合气体通过水,将 溶解 溶解 |
C. 与溴蒸气的鉴别可用 与溴蒸气的鉴别可用 溶液,溶于 溶液,溶于 溶液得无色溶液的是 溶液得无色溶液的是 ,得橙色溶液的为溴蒸气 ,得橙色溶液的为溴蒸气 |
D.在 与水的反应中氧化剂与还原剂的质量之比为 与水的反应中氧化剂与还原剂的质量之比为 |
您最近半年使用:0次
3 . 对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,下列叙述正确的是
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.被氧化的Cl 原子和被还原的Cl 原子的物质的量之比为5:1 |
| C.Cl2既是氧化剂又是还原剂 |
| D.每生成1moL氧化产物转移6NA个电子 |
您最近半年使用:0次
4 . 草酸是一种二元弱酸,可用作还原剂、沉淀剂等。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。回答下列问题:
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。___________ (写一种即可)。
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为___________ 。该过程中,可能产生新的杂质气体Cl2,其原因是:___________ (用离子方程式回答)。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是___________ 。
②装置D中生成H2C2O4的化学方程式为___________ 。
③从装置D中得到产品,还需经过___________ (填操作名称)、过滤、洗涤及干燥。
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是___________ 。
②产品中H2C2O4·2H2O的质量分数为___________ (列出含 m、c、V 的表达式)。
(1)甲组的同学以电石(主要成分CaC2,少量CaS及Ca3P2杂质等)为原料,并用下图1装置制取C2H2。
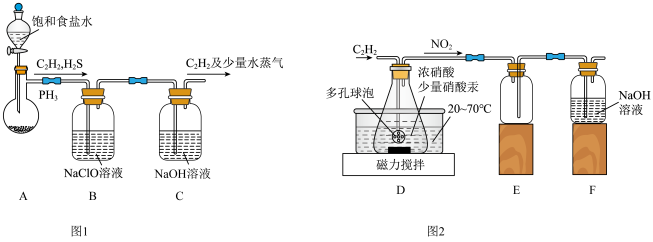
②装置B中,NaClO将H2S、PH3 氧化为硫酸及磷酸,本身被还原为NaCl,其中PH3被氧化的离子方程式为
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化C2H2制取H2C2O4·2H2O。制备装置如上图2所示:
①装置D中多孔球泡的作用是
②装置D中生成H2C2O4的化学方程式为
③从装置D中得到产品,还需经过
(3)丙组设计了测定乙组产品中H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:准确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,再加入少量稀硫酸,然后用c mol·L-1酸性KMnO4标准溶液进行滴定至终点,共消耗标准溶液V mL。
①滴定终点的现象是
②产品中H2C2O4·2H2O的质量分数为
您最近半年使用:0次
5 . 设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.78gNa2S和Na2O2的混合物中含有阴离子的数目为NA |
| B.标准状况下2.24LCl2完全溶于水时,转移电子数为0.1NA |
| C.46gC2H6O分子中含极性键数目一定是7NA |
| D.100g含甲酸46%的水溶液中含氧原子数为2NA |
您最近半年使用:0次
解题方法
6 . 在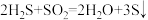 中,氧化剂与还原剂的物质的量之比为
中,氧化剂与还原剂的物质的量之比为
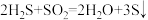 中,氧化剂与还原剂的物质的量之比为
中,氧化剂与还原剂的物质的量之比为| A.2∶1 | B.1∶2 | C.1∶1 | D.16∶17 |
您最近半年使用:0次
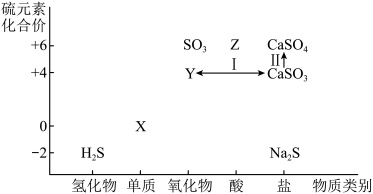
7 . 在化工生产中,硫资源应用广泛,利用含硫物质之间的转化有利于实现硫资源的综合利用。下图为硫及其化合物的“价—类”二维图。
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质有______ ,______ (填化学式,任写两种)。
(2)写出Cu和Z的浓溶液发生反应的化学方程式__________________ 。
(3)将Y通入品红溶液中,可观察到的现象是______________________________ 。
(4)工业上处理废气时,通过步骤IⅡ和步骤w将Y转化为CaSO4再利用。
①实现步骤I的转化所加试剂是______ (写出一种即可)。
②实现步骤Ⅱ的转化可选择______ 试剂(填序号)。
A.O2 B.KI C.H2O2 D.Na2S
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
(6)将H2S与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为______ 。
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的物质有
(2)写出Cu和Z的浓溶液发生反应的化学方程式
(3)将Y通入品红溶液中,可观察到的现象是
(4)工业上处理废气时,通过步骤IⅡ和步骤w将Y转化为CaSO4再利用。
①实现步骤I的转化所加试剂是
②实现步骤Ⅱ的转化可选择
A.O2 B.KI C.H2O2 D.Na2S
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+Na2SO4 | D.SO2+Na2SO4 |
(6)将H2S与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为
您最近半年使用:0次
名校
解题方法
8 . 铁盐与亚铁盐在工业生产和生活中具有重要应用。硫酸亚铁溶液可用于脱除烟气中的二氧化硫等有害气体。  溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
 溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是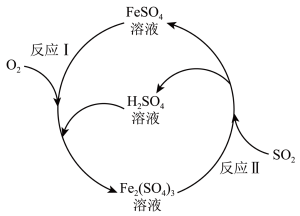
| A.“反应Ⅰ”中氧化剂和还原剂的物质的量之比为4∶1 |
B.“反应Ⅱ”的离子方程式为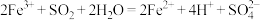 |
C.反应一段时间后,溶液中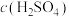 保持不变 保持不变 |
D.反应每脱除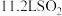 转移电子的物质的量为 转移电子的物质的量为 |
您最近半年使用:0次
2024-04-12更新
|
224次组卷
|
9卷引用:云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高一下学期4月月考化学试题
云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高一下学期4月月考化学试题浙江省杭州市八县区2022-2023学年高一上学期期末检测化学试题浙江省杭州市临平区2022-2023学年高一上学期期末学业水平测试化学试题(已下线)【2023】【高一上】【杭七】【期末考】【高中化学】【廖汨平收集】河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题13-2023新东方高二上期中考化学13河南省名校联盟2023-2024学年高一下学期3月月考化学试题河南省信阳高级中学2023-2024学年高一下学期3月月考化学试题湖南省邵阳市第二中学2023-2024学年高一下学期第一次月考化学试题
9 . 以硫铁矿(主要成分为 ,还有少量
,还有少量 )为原料,制备硫酸亚铁晶体
)为原料,制备硫酸亚铁晶体 和软磁性材料
和软磁性材料 的工艺流程如图:
的工艺流程如图:
(1)焙烧后得到的固体主要成分为 ,写出焙烧过程主要反应的化学方程式
,写出焙烧过程主要反应的化学方程式_________________ 。
(2)试剂 是
是_________________ (填化学式)。
(3)焙烧产生的 会污染环境,可用足量氨水吸收,写出离子方程式
会污染环境,可用足量氨水吸收,写出离子方程式_________________ 。
(4)用如图所示装置可探究 的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通
的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图:_____________ , 图中②的曲线出现骤降,这是因为
图中②的曲线出现骤降,这是因为_____________ (用化学方程式表示)。
(5)取 粗产品
粗产品 ,加水完全溶解,滴加酸化的
,加水完全溶解,滴加酸化的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 (已知
(已知 被还原为
被还原为 ),则
),则 的纯度为
的纯度为_________________ 。
(6)“沉铁”操作时,将提纯后的 溶液与氨水
溶液与氨水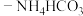 混合溶液反应,生成
混合溶液反应,生成 沉淀,生成
沉淀,生成 沉淀的离子方程式为
沉淀的离子方程式为_________________ 。
 ,还有少量
,还有少量 )为原料,制备硫酸亚铁晶体
)为原料,制备硫酸亚铁晶体 和软磁性材料
和软磁性材料 的工艺流程如图:
的工艺流程如图:
(1)焙烧后得到的固体主要成分为
 ,写出焙烧过程主要反应的化学方程式
,写出焙烧过程主要反应的化学方程式(2)试剂
 是
是(3)焙烧产生的
 会污染环境,可用足量氨水吸收,写出离子方程式
会污染环境,可用足量氨水吸收,写出离子方程式(4)用如图所示装置可探究
 的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通
的性质:在锥形瓶中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图: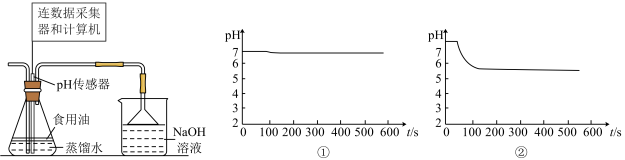
 图中②的曲线出现骤降,这是因为
图中②的曲线出现骤降,这是因为(5)取
 粗产品
粗产品 ,加水完全溶解,滴加酸化的
,加水完全溶解,滴加酸化的 溶液至恰好完全反应,消耗
溶液至恰好完全反应,消耗 溶液
溶液 (已知
(已知 被还原为
被还原为 ),则
),则 的纯度为
的纯度为(6)“沉铁”操作时,将提纯后的
 溶液与氨水
溶液与氨水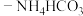 混合溶液反应,生成
混合溶液反应,生成 沉淀,生成
沉淀,生成 沉淀的离子方程式为
沉淀的离子方程式为
您最近半年使用:0次
10 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.标准状况下,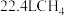 与 与 充分反应,生成的 充分反应,生成的 分子数为 分子数为 |
B. 与 与 的混合气体中含有的质子数为 的混合气体中含有的质子数为 |
C. 正丁烷和 正丁烷和 异丁烷的混合物中共价键数目为 异丁烷的混合物中共价键数目为 |
D.向密闭容器中充入 和 和 ,充分反应时转移电子 ,充分反应时转移电子 |
您最近半年使用:0次



