名校
解题方法
1 . 铁盐与亚铁盐在工业生产和生活中具有重要应用。硫酸亚铁溶液可用于脱除烟气中的二氧化硫等有害气体。  溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
 溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是
溶液催化脱除烟气中 SO2的反应原理如图所示。下列说法正确的是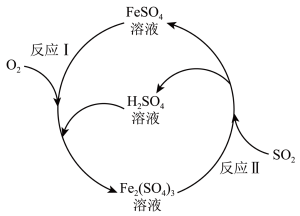
| A.“反应Ⅰ”中氧化剂和还原剂的物质的量之比为4∶1 |
B.“反应Ⅱ”的离子方程式为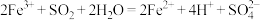 |
C.反应一段时间后,溶液中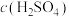 保持不变 保持不变 |
D.反应每脱除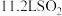 转移电子的物质的量为 转移电子的物质的量为 |
您最近一年使用:0次
2024-04-12更新
|
260次组卷
|
9卷引用:云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高一下学期4月月考化学试题
云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高一下学期4月月考化学试题浙江省杭州市八县区2022-2023学年高一上学期期末检测化学试题浙江省杭州市临平区2022-2023学年高一上学期期末学业水平测试化学试题(已下线)【2023】【高一上】【杭七】【期末考】【高中化学】【廖汨平收集】河北师范大学附属中学2023-2024学年高一上学期12月月考化学试题13-2023新东方高二上期中考化学13河南省名校联盟2023-2024学年高一下学期3月月考化学试题河南省信阳高级中学2023-2024学年高一下学期3月月考化学试题湖南省邵阳市第二中学2023-2024学年高一下学期第一次月考化学试题
名校
2 .  是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是
 是阿伏加德罗常数的值。下列说法正确的是
是阿伏加德罗常数的值。下列说法正确的是A.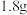 重水 重水 中所含质子数 中所含质子数 |
B.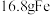 与足量水蒸气反应,转移电子个数为 与足量水蒸气反应,转移电子个数为 |
C. 与沸水充分反应,生成 与沸水充分反应,生成 胶体粒子数 胶体粒子数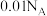 |
D. 在空气中燃烧生成 在空气中燃烧生成 和 和 ,转移电子个数为 ,转移电子个数为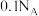 |
您最近一年使用:0次
2024-02-24更新
|
91次组卷
|
2卷引用:云南省红河哈尼族彝族自治州蒙自市第一高级中学2023-2024学年高一下学期4月月考化学试题
解题方法
3 . 氢化钠(NaH)可在野外用作生氢剂。NaH用作生氢剂时的化学反应原理为: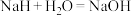
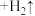 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是
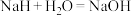
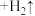 ,下列关于该反应的说法正确的是
,下列关于该反应的说法正确的是| A.该反应属于置换反应 |
| B.NaH为还原剂,NaOH为氧化产物 |
C.每制备1 mol  ,反应转移2 mol ,反应转移2 mol  |
| D.实验室存储氢化钠时应密闭、干燥,与强氧化性物质分开存放 |
您最近一年使用:0次
名校
4 . 根据题给信息,回答相关问题:
(1)FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为___________ 。
(2)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___________ 
(3)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为___________ 。
(4)请配平下列反应的化学方程式:___________
 NaBO2+
NaBO2+ SiO2+
SiO2+ Na+
Na+ H2―→
H2―→ NaBH4+
NaBH4+ Na2SiO3.
Na2SiO3.
(1)FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为
Na2CrO4+Fe2O3+CO2+NaNO2.上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比为(2)在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:

(3)酸性条件下,MnO(OH)2将I-氧化为I2:MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。配平该反应的方程式,其化学计量数依次为
(4)请配平下列反应的化学方程式:
 NaBO2+
NaBO2+ SiO2+
SiO2+ Na+
Na+ H2―→
H2―→ NaBH4+
NaBH4+ Na2SiO3.
Na2SiO3.
您最近一年使用:0次
名校
解题方法
5 . I.按要求填空:
(1)NaHSO4在熔融状态下的电离方程式___________ ;
(2)除去碳酸氢钠固体中的碳酸钠的离子方程式___________ ;
(3)硫酸镁溶液与Ba(OH)2溶液混合的离子方程式___________ ;
(4)KHCO3与NaOH两溶液混合的离子方程式___________ ;
(5)漂白粉失效原理的化学方程式___________ ;
II.储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:
___________ C + ___________ K2Cr2O7 + ___________H2SO4→ ___________CO2↑ + ___________K2SO4 + ___________Cr2(SO4)3 + ___________H2O
(6)①配平上述反应的化学方程式②用单线桥表示电子转移的方向与数目;______
(7)上述反应中若产生0.1mol CO2气体,则转移电子的物质的量是___________ mol。
(1)NaHSO4在熔融状态下的电离方程式
(2)除去碳酸氢钠固体中的碳酸钠的离子方程式
(3)硫酸镁溶液与Ba(OH)2溶液混合的离子方程式
(4)KHCO3与NaOH两溶液混合的离子方程式
(5)漂白粉失效原理的化学方程式
II.储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:
___________ C + ___________ K2Cr2O7 + ___________H2SO4→ ___________CO2↑ + ___________K2SO4 + ___________Cr2(SO4)3 + ___________H2O
(6)①配平上述反应的化学方程式②用单线桥表示电子转移的方向与数目;
(7)上述反应中若产生0.1mol CO2气体,则转移电子的物质的量是
您最近一年使用:0次
名校
解题方法
6 . 已知在碱性溶液中可发生如下反应:2R(OH)3+3ClO-+4OH-=2RO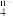 +3Cl-+5H2O。则RO
+3Cl-+5H2O。则RO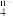 中n的值是
中n的值是
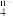 +3Cl-+5H2O。则RO
+3Cl-+5H2O。则RO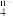 中n的值是
中n的值是| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
名校
7 . 环己酮是重要化工原料,是制造尼龙的主要中间体,也是重要的工业溶剂,实验室利用如下反应原理和实验装置制备环己酮(夹持、加热装置略,C1、C2处有仪器未画出):

环己醇、环己酮和饱和食盐水的部分物理性质见表(括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
实验步骤:
I.实验中通过装置B将酸性Na2Cr2O7溶液分批滴加到盛有30mL环己醇的A中,加入第一批Na2Cr2O7溶液后,待反应物的橙红色消失后再加入第二批……依次进行下去,直至反应结束,控制反应在55~65℃进行。反应结束后,向反应液中加入适量的草酸。
II.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
III.进一步分离提纯得到精环已酮18.0g。
(1)实验装置图中C1处应放置的仪器名称为___________ 。
(2)用蒸馏不能分离环己酮和水的原因是___________ 。
(3)实验过程中Na2Cr2O7溶液分批加入的原因是___________ 。
(4)步骤I加入适量草酸为了将剩余的Na2Cr2O7完全反应,草酸与Na2Cr2O7的物质的量之比为________ 时反应恰好进行完全。
(5)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151-156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水。
上述操作的正确顺序是_______ 序号)。上述操作c中,加入NaCl固体的作用是_________ 。
(6)计算环己酮的产率_________ 。(保留整数)

环己醇、环己酮和饱和食盐水的部分物理性质见表(括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
| 物质 | 密度/(g/cm3) | 沸点/℃ | 部分性质 |
| 环己醇 | 0.90 | 161.1(97.8) | 能溶于水,具有还原性,易被氧化 |
| 环己酮 | 0.88 | 155.6(95) | 微溶于水,遇氧化剂易发生开环反应 |
| 饱和食盐水 | 1.33 | 108.0 |
I.实验中通过装置B将酸性Na2Cr2O7溶液分批滴加到盛有30mL环己醇的A中,加入第一批Na2Cr2O7溶液后,待反应物的橙红色消失后再加入第二批……依次进行下去,直至反应结束,控制反应在55~65℃进行。反应结束后,向反应液中加入适量的草酸。
II.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
III.进一步分离提纯得到精环已酮18.0g。
(1)实验装置图中C1处应放置的仪器名称为
(2)用蒸馏不能分离环己酮和水的原因是
(3)实验过程中Na2Cr2O7溶液分批加入的原因是
(4)步骤I加入适量草酸为了将剩余的Na2Cr2O7完全反应,草酸与Na2Cr2O7的物质的量之比为
(5)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151-156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水。
上述操作的正确顺序是
(6)计算环己酮的产率
您最近一年使用:0次
2023-09-05更新
|
164次组卷
|
2卷引用:云南省蒙自市第一高级中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
8 . 氮氧化物对环境的污染及防治是化学研究的热点之一、请回答下列问题:
I:
(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:___________ 。
(2)用氨可将氮氧化物转化为无毒气体。如,4NH3+6NO 5N2+6H2O,写出氨气转化NO2的化学方程式:
5N2+6H2O,写出氨气转化NO2的化学方程式:___________ ,此反应中氧化产物与还原产物的质量之比为___________ 。
(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:___________ 。
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是___________ 。
II.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

(4)X的化学式为___________ ,Y的化学式为___________ 。
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是___________(填字母)。
(6)将X与SO2混合可发生反应,该反应中氧化产物与还原产物的质量之比为___________ 。
I:
(1)汽车尾气中的CO、NOx在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:
(2)用氨可将氮氧化物转化为无毒气体。如,4NH3+6NO
 5N2+6H2O,写出氨气转化NO2的化学方程式:
5N2+6H2O,写出氨气转化NO2的化学方程式:(3)工业尾气中氮的氧化物常采用碱液吸收法处理。
①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:
②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是
II.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:

(4)X的化学式为
(5)欲制备Na2S2O3,从氧化还原角度分析,合理的是___________(填字母)。
| A.Na2S+S | B.Na2SO3+S | C.Na2SO3+Na2SO4 | D.SO2+Na2SO4 |
您最近一年使用:0次
名校
9 . 植物对氮元素的吸收过程如下,下列说法错误的是
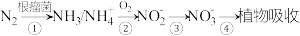
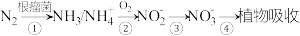
A.NH3 中的键角小于 中的键角 中的键角 |
B. 、 、 中 N 的杂化方式不同 中 N 的杂化方式不同 |
| C.P 原子间难形成三键而 N 原子间可以,是因为 P 的原子半径大于 N,难形成 P-Pπ键 |
D.当有 9.2g  生成时,过程②转移的电子为 1.2mol 生成时,过程②转移的电子为 1.2mol |
您最近一年使用:0次
名校
解题方法
10 . 工业生产中除去电石渣浆(含CaO)中的S2-并制取硫酸盐的一种常用流程如图所示。下列说法正确的是


A.碱性条件下,氧化性:O2<MnO <S2O <S2O |
| B.过程 Ⅰ 中氧化剂和还原剂的物质的量之比为2∶1 |
C.过程 Ⅱ 中,反应的离子方程式为4MnO +2S2-+9H2O=S2O +2S2-+9H2O=S2O +4Mn(OH)2↓+10OH- +4Mn(OH)2↓+10OH- |
D.将1 mol S2-转化为SO 理论上需要O2的体积为22.4 L (标准状况) 理论上需要O2的体积为22.4 L (标准状况) |
您最近一年使用:0次



