解题方法
1 . 我国科研人员研发的海泥细菌电池不仅可以作为海底仪器的水下电源,还可以促进有机污染物(以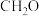 表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是
表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是
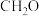 表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是
表示)的分解,其工作原理如图,其中海底沉积层/海水界面可起到质子交换膜的作用,下列理论分析正确的是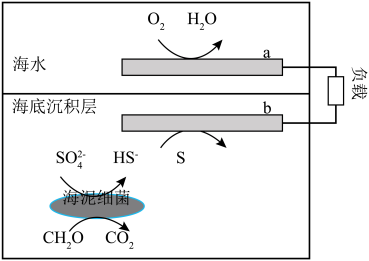
| A.a极为电池负极 |
B.b极的电极反应为 |
C.若b极区生成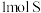 ,则a极区 ,则a极区 增加2mol 增加2mol |
D.外电路通过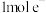 时,至少有 时,至少有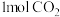 生成 生成 |
您最近半年使用:0次
2 . 在碘水、淀粉、稀 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: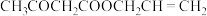
AAAI为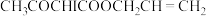
下列说法不正确 的是
 和
和 的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下:
的混合溶液中加入过量乙酰乙酸烯丙酯(AAA),观察到溶液中蓝色与无色交替出现,主要转化如下: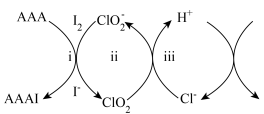
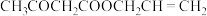
AAAI为
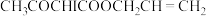
下列说法
| A.i为取代反应 | B.ii的反应为 |
C.iii中,生成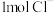 转移 转移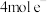 | D.最终溶液呈蓝色 |
您最近半年使用:0次
3 . 已知 是阿伏加德罗常数的值,下列说法中正确的是
是阿伏加德罗常数的值,下列说法中正确的是
 是阿伏加德罗常数的值,下列说法中正确的是
是阿伏加德罗常数的值,下列说法中正确的是A.标准状况下,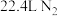 中含有 中含有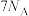 个中子 个中子 |
B.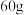 富勒烯(C60)中含有 富勒烯(C60)中含有 个碳原子 个碳原子 |
C. 被还原为 被还原为 转移的电子数为 转移的电子数为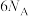 |
D.密闭容器中, 和 和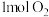 催化反应后分子总数为 催化反应后分子总数为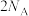 |
您最近半年使用:0次
名校
4 . 在Pt-BaO催化下,NO的“储存-还原”过程如图1所示。其中“还原”过程依次发生反应Ⅰ和反应Ⅱ,各气体的物质的量变化如图2所示。
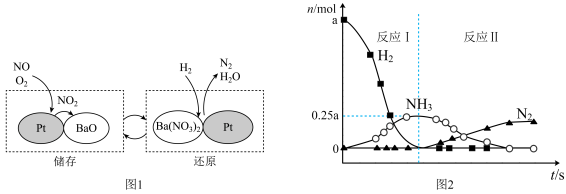
A. 与BaO的反应中, 与BaO的反应中, 既是氧化剂,又是还原剂 既是氧化剂,又是还原剂 |
B.反应Ⅰ为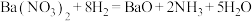 |
C.反应Ⅱ中,最终生成 的物质的量为0.2a mol 的物质的量为0.2a mol |
D.反应Ⅰ和Ⅱ中消耗的 的质量比是3∶5 的质量比是3∶5 |
您最近半年使用:0次
2024-05-03更新
|
337次组卷
|
2卷引用:北京市东城区2024届高三一模化学试题
解题方法
5 . 为吸收工业尾气中的 和
和 ,设计如图流程,同时还能获得连二亚硫酸钠(
,设计如图流程,同时还能获得连二亚硫酸钠( ,其结晶水合物又称保险粉)和
,其结晶水合物又称保险粉)和 产品。(
产品。( 为铈元素)
为铈元素)不正确 的是
 和
和 ,设计如图流程,同时还能获得连二亚硫酸钠(
,设计如图流程,同时还能获得连二亚硫酸钠( ,其结晶水合物又称保险粉)和
,其结晶水合物又称保险粉)和 产品。(
产品。( 为铈元素)
为铈元素)
A.工业尾气中的 和 和 排放到大气中会形成酸雨 排放到大气中会形成酸雨 |
B.装置Ⅱ的作用是吸收 |
C. 从阴极口流出回到装置Ⅱ循环使用 从阴极口流出回到装置Ⅱ循环使用 |
D.装置Ⅳ中氧化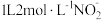 ,至少需要标准状况下 ,至少需要标准状况下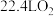 |
您最近半年使用:0次
2024·浙江嘉兴·二模
6 . 高铁酸钠(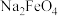 )是一种新型绿色消毒剂,主要用于饮用水处理,制备的一种方法其原理:
)是一种新型绿色消毒剂,主要用于饮用水处理,制备的一种方法其原理: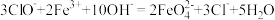 ,下列说法
,下列说法不正确 的是
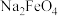 )是一种新型绿色消毒剂,主要用于饮用水处理,制备的一种方法其原理:
)是一种新型绿色消毒剂,主要用于饮用水处理,制备的一种方法其原理: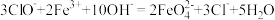 ,下列说法
,下列说法| A. Fe3+是还原剂 | B.H2O既不是还原产物也不是氧化产物 |
C.生成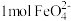 ,转移 ,转移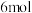 电子 电子 | D.氧化产物与还原产物的物质的量之比为 |
您最近半年使用:0次
7 . 硝酸是重要的化工原料。如图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。_____________ (填序号)。
 .合成氨是一种重要的人工固氮方法
.合成氨是一种重要的人工固氮方法
 .该反应过程中氮元素被氧化
.该反应过程中氮元素被氧化
 .合成的氨气还可以用于化肥工业
.合成的氨气还可以用于化肥工业
 .该反应采用高温、高压等苛刻条件,与
.该反应采用高温、高压等苛刻条件,与 化学性质很稳定有关
化学性质很稳定有关
(2)氨氧化装置中,产生的含氮物质主要为 ,反应的化学方程式为
,反应的化学方程式为_________ 。
(3)聚合、吸收装置中,含氮物质转化的主要反应包括① ;②
;②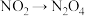 ;③
;③ ,其中属于氧化还原反应的是
,其中属于氧化还原反应的是_________ (填序号)。
(4)吸收装置中,发生的反应为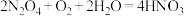 ,若用
,若用 稀硝酸作为吸收液,反应后得到
稀硝酸作为吸收液,反应后得到 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为_________  (写出计算式)。
(写出计算式)。
(5)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:_____________ 。
(6) 催化还原氮氧化物
催化还原氮氧化物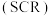 技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示:
技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示: 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为_________ 。
(7)据报道,意大利科学家获得了极具研究价值的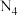 ,其分子结构如图所示。已知:Ⅰ.断裂
,其分子结构如图所示。已知:Ⅰ.断裂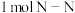 键吸收
键吸收 热量,形成
热量,形成 键放出
键放出 热量
热量
Ⅱ.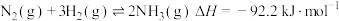
写出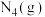 和
和 反应合成
反应合成 的热化学方程式
的热化学方程式_____________________________ 。

 .合成氨是一种重要的人工固氮方法
.合成氨是一种重要的人工固氮方法 .该反应过程中氮元素被氧化
.该反应过程中氮元素被氧化 .合成的氨气还可以用于化肥工业
.合成的氨气还可以用于化肥工业 .该反应采用高温、高压等苛刻条件,与
.该反应采用高温、高压等苛刻条件,与 化学性质很稳定有关
化学性质很稳定有关(2)氨氧化装置中,产生的含氮物质主要为
 ,反应的化学方程式为
,反应的化学方程式为(3)聚合、吸收装置中,含氮物质转化的主要反应包括①
 ;②
;②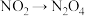 ;③
;③ ,其中属于氧化还原反应的是
,其中属于氧化还原反应的是(4)吸收装置中,发生的反应为
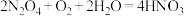 ,若用
,若用 稀硝酸作为吸收液,反应后得到
稀硝酸作为吸收液,反应后得到 的浓硝酸,则理论上吸收装置中需消耗的
的浓硝酸,则理论上吸收装置中需消耗的 的物质的量为
的物质的量为 (写出计算式)。
(写出计算式)。(5)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:
(6)
 催化还原氮氧化物
催化还原氮氧化物 技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示:
技术是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如图所示: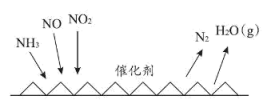
 和
和 物质的量之比为
物质的量之比为 ,则总反应的化学方程式为
,则总反应的化学方程式为(7)据报道,意大利科学家获得了极具研究价值的
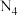 ,其分子结构如图所示。已知:Ⅰ.断裂
,其分子结构如图所示。已知:Ⅰ.断裂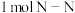 键吸收
键吸收 热量,形成
热量,形成 键放出
键放出 热量
热量Ⅱ.
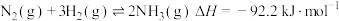
写出
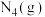 和
和 反应合成
反应合成 的热化学方程式
的热化学方程式
您最近半年使用:0次
名校
8 . 化工厂用浓氨水检验氯气管道是否漏气,利用的反应如下: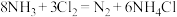
(1)作还原剂的物质是_________ ,氯元素的化合价_________ (填“升高”或“降低”)。
(2)若反应中每生成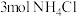 ,则消耗
,则消耗 的物质的量至少为
的物质的量至少为_________  ,转移电子的物质的量为
,转移电子的物质的量为_________  。
。
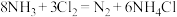
(1)作还原剂的物质是
(2)若反应中每生成
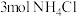 ,则消耗
,则消耗 的物质的量至少为
的物质的量至少为 ,转移电子的物质的量为
,转移电子的物质的量为 。
。
您最近半年使用:0次
名校
解题方法
9 . 为治理汽车尾气中的 和
和 对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应:
对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应: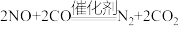 。
。
(1)作还原剂的物质是___________ 。氮元素的化合价___________ (填“升高”或“降低”)。
(2)若反应中消耗了4mol ,则生成
,则生成 的体积(标准状况)为
的体积(标准状况)为___________ L,转移电子的物质的量为___________ mol。
 和
和 对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应:
对环境的污染,可在汽车排气管上安装催化转化器,发生如下反应: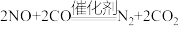 。
。(1)作还原剂的物质是
(2)若反应中消耗了4mol
 ,则生成
,则生成 的体积(标准状况)为
的体积(标准状况)为
您最近半年使用:0次
名校
10 . 硫化氢(H2S)是一种有毒气体,高于200℃分解,溶于水显弱酸性,脱除H2S的方法很多。
(1)Na2CO3吸收H2S。含H2S的气体与饱和Na2CO3溶液在吸收塔内逆流接触,生成两种酸式盐。该反应的离子方程式为___________ 。
(2)干法脱硫技术。
①铁系脱硫剂:活性氧化铁(Fe2O3•H2O)是经典而有效的脱硫剂,脱硫反应:Fe2O3•H2O+H2S→FeS+S+H2O,再生反应:FeS+H2O+O2→Fe2O3•H2O+S(脱硫反应和再生反应均未配平)。
a.Fe2O3•H2O在该反应中的作用可描述为___________ 。
b.若处理标况下4.48LH2S时,理论上消耗O2的物质的量为___________ 。
②锌系脱硫剂:550℃时,将H2S和还原性气体H2按一定比例混合,以一定的流速通过装有锌的复合金属脱硫剂(ZnFe2O4)的反应器,脱硫过程中,ZnFe2O4与H2S、H2反应生成了ZnS、FeS和H2O,其化学方程式为___________ 。
(3)生物脱硫技术。
天然气是一种重要的化工原料和燃料,常含有少量H2S。H2S与碱反应转化为HS‒,在脱氮硫杆菌参与下,HS‒被NO 氧化为SO
氧化为SO 、NO
、NO 被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO
被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO 的物质的量为
的物质的量为___________ mol。
(1)Na2CO3吸收H2S。含H2S的气体与饱和Na2CO3溶液在吸收塔内逆流接触,生成两种酸式盐。该反应的离子方程式为
(2)干法脱硫技术。
①铁系脱硫剂:活性氧化铁(Fe2O3•H2O)是经典而有效的脱硫剂,脱硫反应:Fe2O3•H2O+H2S→FeS+S+H2O,再生反应:FeS+H2O+O2→Fe2O3•H2O+S(脱硫反应和再生反应均未配平)。
a.Fe2O3•H2O在该反应中的作用可描述为
b.若处理标况下4.48LH2S时,理论上消耗O2的物质的量为
②锌系脱硫剂:550℃时,将H2S和还原性气体H2按一定比例混合,以一定的流速通过装有锌的复合金属脱硫剂(ZnFe2O4)的反应器,脱硫过程中,ZnFe2O4与H2S、H2反应生成了ZnS、FeS和H2O,其化学方程式为
(3)生物脱硫技术。
天然气是一种重要的化工原料和燃料,常含有少量H2S。H2S与碱反应转化为HS‒,在脱氮硫杆菌参与下,HS‒被NO
 氧化为SO
氧化为SO 、NO
、NO 被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO
被还原为N2。当33.6m3(标准状况)某燃气(H2S的体积分数为0.2%)脱硫时,消耗NO 的物质的量为
的物质的量为
您最近半年使用:0次



