1 . 已知KClO3+6HCl=KCl+3Cl2↑+3H2O,下列说法不正确 的是
| A.KClO3是氧化剂 | B.Cl2既是氧化产物,也是还原产物 |
| C.该反应中,HCl体现还原性和酸性 | D.氧化剂、还原剂物质的量之比为1:6 |
您最近一年使用:0次
解题方法
2 . 煤的气化是煤炭综合利用的重要途径之一,主要反应为C+H2O(g)  CO+H2。
CO+H2。
(1)该反应中,化合价升高的元素是___________ (填元素符号),氧化剂是___________ (填化学式),氧化产物是___________ (填化学式)。
(2)若消耗了1 mol C,则生成CO的体积约是___________ L(标准状况),转移电子的物质的量为___________ mol。
 CO+H2。
CO+H2。(1)该反应中,化合价升高的元素是
(2)若消耗了1 mol C,则生成CO的体积约是
您最近一年使用:0次
解题方法
3 . 实验室中可用该反应吸收氯气:3Cl2+6KOH=5KCl+ KClO3+3H2O,此反应中氧化剂与还原剂的物质的量之比为
| A.1 :1 | B.3 :2 | C.1 :5 | D.5 :1 |
您最近一年使用:0次
4 . 氨是一种重要的化工原料。氨催化氧化制硝酸过程中涉及如下反应。

(1)作为氧化剂的物质是___________ 。
(2)氮元素的化合价___________ (填“升高”或“降低”)。
(3) 发生
发生___________ (填“氧化”或“还原”)反应。
(4)若反应中消耗了 ,则生成NO的物质的量为
,则生成NO的物质的量为___________ mol,转移电子的物质的量为___________ mol。

(1)作为氧化剂的物质是
(2)氮元素的化合价
(3)
 发生
发生(4)若反应中消耗了
 ,则生成NO的物质的量为
,则生成NO的物质的量为
您最近一年使用:0次
5 . 我国科学家用CO2人工合成淀粉时,第一步需要将CO2转化为甲醇,反应的化学方程式为: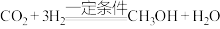 。
。
(1)做还原剂的物质是____________ ,碳元素的化合价____________ (填“升高”或“降低”)。
(2)反应中每生成1个CH3OH,消耗CO2____________ 个,转移电子____________ 个。
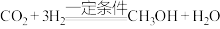 。
。(1)做还原剂的物质是
(2)反应中每生成1个CH3OH,消耗CO2
您最近一年使用:0次
名校
6 . 关于 的下列叙述中不正确的是
的下列叙述中不正确的是
 的下列叙述中不正确的是
的下列叙述中不正确的是A. 是极性分子 是极性分子 | B.同时含有离子键和非极性共价键 |
| C.同时含有极性键和非极性键 | D.1mol 完全分解,转移1mol电子 完全分解,转移1mol电子 |
您最近一年使用:0次
7 .  光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子(
光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子( )作还原剂,价带上的光生空穴
)作还原剂,价带上的光生空穴 作氧化剂,下列说法
作氧化剂,下列说法不正确 的是

 光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子(
光催化反应机理如图所示,当催化剂受到能量大于禁带宽度的光照时,价带上的电子被激发,跃迁到导带,同时形成空穴。导带上的光生电子( )作还原剂,价带上的光生空穴
)作还原剂,价带上的光生空穴 作氧化剂,下列说法
作氧化剂,下列说法
A.在价带上 被氧化 被氧化 | B.推测 起催化作用 起催化作用 |
| C.反应过程中光能转化为化学能 | D. 生成 生成 得 得 |
您最近一年使用:0次
名校
8 . 有 存在时,活性炭吸附脱除
存在时,活性炭吸附脱除 的反应方程式为
的反应方程式为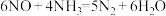 。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附
。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附 和
和 的机理如下图所示。下列说法
的机理如下图所示。下列说法不正确 的是
 存在时,活性炭吸附脱除
存在时,活性炭吸附脱除 的反应方程式为
的反应方程式为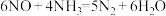 。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附
。研究发现:活性炭的表面含有羧基等含氧官能团,活性炭含氧官能团化学吸附 和
和 的机理如下图所示。下列说法
的机理如下图所示。下列说法
A. 和 和 中心原子的杂化方式相同 中心原子的杂化方式相同 |
B.吸附时, 中的 中的 原子与羧基中的 原子与羧基中的 原子发生作用 原子发生作用 |
C.室温时,脱除30g 转移电子数约为 转移电子数约为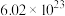 个 个 |
D.含氧官能团化学吸附 、 、 的连接方式与 的连接方式与 、 、 、 、 和 和 的电负性有关 的电负性有关 |
您最近一年使用:0次
2024-03-06更新
|
386次组卷
|
2卷引用:北京交通大学附属中学2023-2024学年高三下学期开学考化学试题
名校
9 . 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
I.电解水制备法 ),同时产生的氢原子会重组成
),同时产生的氢原子会重组成 。该过程如图所示:
。该过程如图所示:
(1)基态铜原子的价层电子轨道表示式为___________ 。
(2)已知:i.醛极易被氧化;ii.电解反应越难发生,电解所需电压越高
①在碱性条件下电解水制氢时,阳极发生的电极反应为___________ 。
②推测醛氧化制氢所需电压比电解水制氢___________ (填“低”、“高”或“相同”)。
③补全醛催化氧化时,阳极的电极反应式:___________ 。
 □
□ □
□
(3)上述电解装置工作时,每转移1 mol电子时,生成 的物质的量为
的物质的量为___________ 。
Ⅱ.甲烷水蒸气催化重整法
恒温恒压下甲烷和水蒸气的反应为: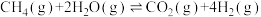

(4)达到平衡后通入氮气,分析 平衡转化率的变化及原因
平衡转化率的变化及原因___________ 。
(5)反应的过程中发生副反应
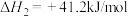 ,将
,将 混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是
混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是___________ 。
I.电解水制备法

 ),同时产生的氢原子会重组成
),同时产生的氢原子会重组成 。该过程如图所示:
。该过程如图所示:(1)基态铜原子的价层电子轨道表示式为
(2)已知:i.醛极易被氧化;ii.电解反应越难发生,电解所需电压越高
①在碱性条件下电解水制氢时,阳极发生的电极反应为
②推测醛氧化制氢所需电压比电解水制氢
③补全醛催化氧化时,阳极的电极反应式:
 □
□ □
□
(3)上述电解装置工作时,每转移1 mol电子时,生成
 的物质的量为
的物质的量为Ⅱ.甲烷水蒸气催化重整法
恒温恒压下甲烷和水蒸气的反应为:
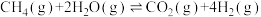

(4)达到平衡后通入氮气,分析
 平衡转化率的变化及原因
平衡转化率的变化及原因(5)反应的过程中发生副反应

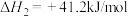 ,将
,将 混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是
混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是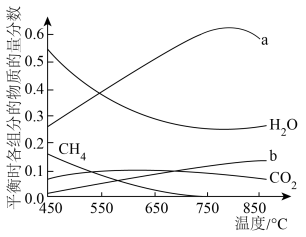
您最近一年使用:0次
2024-03-03更新
|
119次组卷
|
2卷引用: 北京市第十二中学2023-2024学年高二下学期开学考试化学试题
名校
解题方法
10 . 研究小组制备次氯酸钠(NaClO)、探究其性质并测定其物质的量浓度。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为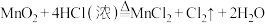 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为_________ 。
(2)B中饱和NaCl溶液的作用是________ 。
(3)C为NaClO制备装置,反应的离子方程式为_______ 。
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于________ ,可能与某些酸反应。小组同学将红色纸条浸入NaClO溶液后,纸条褪色,向溶液中通入 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成_______ (写化学式)。
(5)NaClO具有氧化性,预测依据是_______ 。小组同学向NaClO溶液中加入过量的KI溶液,加入适量稀硫酸,加入淀粉,溶液变蓝,无黄绿色气体产生。该反应的离子方程式为_______ 。
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制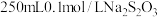 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。
(6)计算需要 固体的质量是
固体的质量是_____ g。
(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和_______ 。
(8)下列情况中,会使所配溶液浓度偏小的是___________ (填字母)。
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。
(9)计算NaClO溶液的物质的量浓度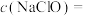
______ mol/L。
I.制备NaClO
实验装置如下图:

(1)A为氯气发生装置,反应为
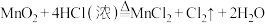 ,氧化剂与还原剂物质的量之比为
,氧化剂与还原剂物质的量之比为(2)B中饱和NaCl溶液的作用是
(3)C为NaClO制备装置,反应的离子方程式为
Ⅱ.探究NaClO的性质
(4)从物质类别看,NaClO属于
 后,褪色更加明显,说明NaClO与
后,褪色更加明显,说明NaClO与 和
和 生成
生成(5)NaClO具有氧化性,预测依据是
Ⅲ.测定NaClO溶液的物质的量浓度
步骤i:配制
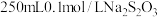 (摩尔质量为158g/mol)标准溶液。
(摩尔质量为158g/mol)标准溶液。(6)计算需要
 固体的质量是
固体的质量是(7)用到的仪器有:天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和
(8)下列情况中,会使所配溶液浓度偏小的是
a.配制溶液所用的容器中有蒸馏水 b.转移时,未洗涤烧杯和玻璃棒
c.定容时,眼睛仰视刻度线 d.摇匀后发现凹液面最低处低于刻度线
步骤ii:用
 标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成
标准溶液通过实验测得250mLNaClO溶液与足量KI反应生成 的物质的量为0.05mol。
的物质的量为0.05mol。(9)计算NaClO溶液的物质的量浓度
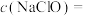
您最近一年使用:0次



