名校
解题方法
1 . 在一定条件下,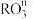 和
和 可发生如下反应:
可发生如下反应: ,从而可知在
,从而可知在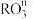 中,元素R的化合价是
中,元素R的化合价是
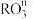 和
和 可发生如下反应:
可发生如下反应: ,从而可知在
,从而可知在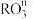 中,元素R的化合价是
中,元素R的化合价是| A.+7价 | B.+4价 | C.+5价 | D.+6价 |
您最近一年使用:0次
2023-12-23更新
|
406次组卷
|
153卷引用:北京市第二十二中学2019-2020学年高一上学期期中考试化学试题
北京市第二十二中学2019-2020学年高一上学期期中考试化学试题(已下线)2010年辽宁省沈阳四校联合体高一上学期期中考试化学卷(已下线)2010年黑龙江牡丹江一中高一上学期期中考试化学试卷(已下线)2010年江苏省海安县南莫中学高一上学期期中考试化学试卷(已下线)2011-2012年浙江省金华一中高一上学期期中考试化学试卷(已下线)2011-2012年黑龙江哈九中高一上学期期中考试化学试卷(已下线)2011-2012学年辽宁省沈阳同泽女中高一上学期期中考试化学试卷(已下线)2011-2012学年山东省微山一中高一上学期期中考试化学试卷(已下线)2011-2012学年山东济宁梁山二中高一12月月考化学试卷(已下线)2011-2012学年武汉二中高一上学期期中考试化学试卷(已下线)2012届陕西省西安市第一中学高三上学期期中考试化学试卷(已下线)2011-2012学年黑龙江省绥棱县第一中学高一上学期期末考试化学试卷(已下线)2011-2012学年河北省衡水中学高一下学期期末考试化学试卷(已下线)2012-2013学年江西省白鹭洲中学高一第一次月考化学试卷(已下线)2012-2013学年安徽六安新安中学高一上学期期中考试化学试卷(已下线)2012-2013学年河北省石家庄市第一中学高一上学期期中考试化学试卷(已下线)2013-2014学年广西北海市合浦县高一上学期期中考试化学试卷(已下线)2013-2014学年安徽省合肥一中高一上学期期中考试化学试卷(已下线)2013-2014学年重庆市重庆一中高一上学期期中考试化学试卷(已下线)2013-2014安徽省合肥一中高一上学期期中考试化学试卷(已下线)2014-2015河北保定某重点中学同步作业(必修1苏教版)2.2.3离子反应(已下线)2014-2015学年度河南省许昌市五校高一上期第一次联考化学试卷2014-2015辽宁省大连市高一上学期期末考试化学试卷2014-2015学年山东济南外国语学校高一上期中化学试卷2015-2016学年广东省广州培正中学高一上学期期中测试化学试卷2015-2016学年福建厦门双十中学高一上期中考试化学试卷2015-2016学年浙江省杭州二中高一上期末化学试卷2015-2016学年福建省莆田八中高一上学期第二次月考化学试卷2016-2017学年云南省云天化中学高一9月月考化学卷2016-2017学年黑龙江哈尔滨六中高一上期中化学试卷2016-2017学年江西省上高二中高一上月考二化学卷2016-2017学年新疆生产建设兵团二中高一上期中化学卷2017届陕西省黄陵中学高三上学期第三次质检化学试卷2016-2017学年辽宁省六校协作体高一下学期期初化学试卷辽宁省葫芦岛市六校协作体2016-2017学年高一下学期期初考试化学试题安徽省蚌埠市第二中学2017-2018学年高二上学期开学考试化学试题山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题河北省阜城中学2017-2018学年高一上学期第四次月考化学试题江西省抚州市临川实验学校2017-2018学年高一上学期期中考试化学试题高中化学人教版 必修1 第二章 化学物质及其变化 3.氧化还原反应 氧化还原反应安徽省濉溪县临涣中学2017-2018学年高一上学期第二次月考化学试题浙江省定海一中2017-2018学年高一第一学期期中考试化学试卷贵州省六盘水盘县四中2017-2018学年高一下学期期末考试化学试题【全国百强校】云南省云天化中学2018-2019学年高一上学期期中考试化学试题贵州省正安县一中2018-2019学年高一上学期期中考试化学试题【全国百强校】山东省菏泽第一中学八一路校区2018-2019学年高一上学期12月月考化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题江西省南康中学2017-2018学年高一上学期期中考试化学试题吉林省乾安县七中2017-2018学年高一上学期期中考试化学试卷吉林省吉林地区普通高中友好学校联合体第三十一届2019-2020学年高一上学期期中考试化学试题内蒙古自治区乌兰察布市集宁一中2019-2020学年高一上学期期中考试化学试题广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题四川省雅安中学2019-2020学年高一上学期期中考试化学试题广西壮族自治区百色市田阳高中2019-2020学年高一上学期期中考试化学试题河南省漯河市实验高中2019-2020学年高一上学期期中考试化学试题宁夏青铜峡市高级中学2019-2020学年高一上学期期中考试化学试题江西省南昌市新建县第一中学2020届高三上学期第一次月考化学试题(共建部)黑龙江省大庆市第四中学2019-2020学年高一上学期第二次月考化学试题河南省驻马店市正阳县高级中学2019-2020学年高一上学期第三次素质检测化学试题云南省马关县第二中学2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷青海省西宁市第十四中学2019-2020学年高二上学期期末考试化学试题贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高三上学期期末考试化学试题福建省福州市福建师范大学附属中学2017-2018学年高一下学期期中考试化学试题河北省石家庄市第二中学2018-2019学年高一上学期期末考试化学试题辽宁省营口市第二高级中学2019-2020学年高一上学期第一次月考化学试题(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)衔接点08 氧化还原反应的一般规律-2020年【衔接教材·暑假作业】初高中衔接化学山西省朔州市怀仁市第一中学云东校区2019-2020学年高一期末考试化学试题(已下线)3.2.3 离子反应练习(2)——《高中新教材同步备课》(苏教版 必修第一册)(已下线)第2章 总结与检测(2)——《高中新教材同步备课》(鲁科版 必修第一册)河南省平顶山市舞钢市第一高级中学2021届高三9月月考化学试题吉林省白城市洮南市第一中学2021届高三上学期第一次月考化学试题江苏省南京外国语学校2018-2019学年高一上学期期中考试化学试题黑龙江省绥化市安达市第七中学2020-2021学年高一上学期9月月考化学试题河南省新乡市2020-2021学年高一阶段测试化学试题山西省运城市新绛中学、河津中学等校2020-2021学年高一上学期10月联考化学试题广西玉林师院附中、玉林市育才中学、玉林十一中、玉林市田家炳中学2019-2020学年高一上学期期中考试化学试题(已下线)【浙江新东方】21(已下线)【浙江新东方】14(已下线)【浙江新东方】15江苏省南京师范大学附属中学2020-2021学年高一上学期期中考试化学试题湖南省长沙市南雅中学2020—2021学年高一上学期第一次月考化学试题湖北省荆门市沙洋县沙洋中学2020-2021学年高一上学期10月月考化学试题湖南省常德市第一中学2020-2021学年高一上学期期中考试化学试题安徽省合肥瑶海区合肥市第十一中学2020-2021学年高一上学期期中考试化学试题吉林省榆树市第一高级中学2021届高三上学期第三次模拟考试化学试题吉林省大安市第六中学2020-2021学年高一上学期第二次月考化学试题甘肃省镇原县第二中学2020-2021学年高一上学期期中考试化学试题江苏省苏州市西安交通大学苏州附属中学2020-2021学年高一上学期期中考试化学试卷黑龙江省伊春市伊美区第二中学2020-2021学年高一上学期第三次月考化学试题吉林省长春市第一五一中学2020-2021学年高一上学期期中考试化学试题河北师范大学附属实验中学2020~2021学年高一上学期10月月考化学试题北京师范大学附属中学2021-2022学年高一上学期期中考试化学试题湖北省巴东一中2020-2021学年高一上学期第三次月考化学试题北京市丰台区丰台第二中学2022-2023学年上学期高三10月月考化学试题湖南省邵阳市武冈市2020-2021学年高一上学期期中考试化学试题北京市第一七一中学2022-2023学年高一上学期期中考试化学试题北京市第三十五中学2021-2022学年高一上学期期中考试化学试题北京市第一六一中学2023-2024学年高一上学期期中考试化学试题甘肃省张掖市2020-2021学年高一上学期期末学业水平质量检测化学试题陕西省宝鸡市渭滨区2020-2021学年高一上学期期末考试化学试题(已下线)衔接点08 氧化还原反应的一般规律-2021年初升高化学无忧衔接(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接山西省运城市稷山中学2022届高三上学期月考(一)化学试题吉林省白城市第一中学2021-2022学年高一上学期第一次阶段考试化学试题陕西省榆林市绥德中学2020-2021学年高一下学期第一次阶段性测试化学试卷黑龙江省双鸭山市第一中学2021-2022学年高一上学期第一次月考化学试题广东省名校2021-2022学年高一上学期第一次月考化学试卷广西桂林市第十八中学2021-2022学年高一上学期开学考试化学试题河北省石家庄市师范大学附属实验中学2021-2022高一上学期10月月考化学试卷宁夏银川唐徕回民中学2021-2022学年高一11月月考化学试题陕西省西安市第一中学2022届高三上学期期中考试化学试题江西省吉安市遂川中学2021-2022学年高一上学期第一次月考化学(B卷)试题湖南省长郡中学2021-2022学年高一上学期期末考试化学试题(已下线)衔接点13 氧化还原反应的规律和表示方法-2022年初升高化学无忧衔接?吉林省长春市东北师范大学附属中学2022-2023学年高一上学期阶段考试化学试题新疆生产建设兵团第一师高级中学2022-2023学年高一上学期第一次月考化学试题黑龙江省鸡西市英桥高级中学2021-2022学年高二下学期期末考试化学试题湖北省襄阳四中2021-2022学年高一上学期10月考试化学试题陕西省西安市铁一中2022-2023学年高一上学期第一次月考化学试题辽宁省锦州市渤海大学附属高级中学2022-2023学年高一上学期期中考试化学试题安徽省六安中学2021-2022学年高一上学期期中考试化学试题云南省昆明市禄劝彝族苗族自治县第一中学2021-2022学年高一网络班10月月考化学试题安徽省阜阳第一中学2022-2023学年高一上学期第三次月考化学试题河北省唐山市乐亭第二中学2022-2023学年高一上学期期末考试化学试题重庆实验外国语学校2022-2023学年高一上学期1月期末考试化学试题(已下线)第二章 物质的量化学实验基本技能 第8练 化学计算的常用方法福建省莆田锦江中学2022-2023学年高一上学期期末质检化学试题广东省河源市龙川县第一中学2022-2023学年高一上学期期末考试化学试题云南省玉溪第一中学2022-2023学年高一上学期第一月考化学试题 微专题(四) 氧化还原反应的简单规律及应用甘肃省天水市甘谷县2023-2024学年高三上学期第一次检测化学试题河南省河南中原名校联考2023-2024学年高一上学期9月月考化学试题广西贵港市名校2023-2024学年高一上学期入学联考化学试题陕西省西安高新第一中学2023-2024学年高一上学期第一次月考化学试题辽宁省鞍山市普通高中2023-2024学年高一上学期10月月考化学(A卷)试题新疆乌鲁木齐第八中学2023-2024学年高一上学期第一次月考化学试题云南省昆明市第八中学2023-2024学年高一上学期9月月考化学试卷题吉林省长春市新解放学校2022-2023学年高一上学期11月期中化学试题湖南省株洲市第二中学2023-2024学年高一上学期第一次适应性检测化学试题 天津市双菱中学2023-2024学年高一上学期期中考试化学试卷湖南省洞口县第九中学2023-2024学年高一上学期第一次月考化学试题辽宁省大连保税区第一高级中学2023-2024学年高一上学期10月月考化学(A)试题江西省景德镇市乐平市第三中学2023-2024学年高一上学期10月月考化学试题湖南省岳阳县第一中学2023-2024学年高一上学期第一次月考化学试题 辽宁省阜新市第二高级中学2023-2024学年高一上学期第一次考试化学试卷河南省濮阳市第一高级中学2023-2024学年高一上学期第一次质量检测化学试题四川省内江市威远中学2023-2024学年高一上学期期中考试化学试题黑龙江省实验中学2023-2024学年高一上学期期中测试化学试题河南省开封市五县联考2023-2024学年高一上学期12月月考化学试题湖南省永州市祁阳县第四中学2023-2024学年高一上学期期中考试化学试题四川省泸州市泸县第五中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
2 . 根据如图所示的转化关系判断,下列说法正确的是(反应条件已略去)


A.生成等质量 时,①和②反应消耗 时,①和②反应消耗 |
B.反应③和④消耗等量的Al时,生成的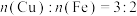 |
| C.反应③中氧化剂与还原剂的物质的量之比为2∶3 |
D.反应⑤的离子方程式为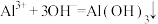 |
您最近一年使用:0次
2023-11-29更新
|
149次组卷
|
8卷引用:北京市石景山区2018届高三第一学期期末考试化学试题
名校
解题方法
3 . 已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0 kJ/mol。以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如下:
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
过程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2 kJ/mol
过程Ⅱ:…
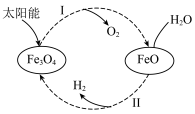
| A.过程Ⅰ中每消耗232 g Fe3O4转移2 mol电子 |
| B.过程Ⅱ的热化学方程式为3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=+128.9 kJ/mol |
| C.过程Ⅰ、Ⅱ中能量转化的形式依次是太阳能→化学能→热能 |
| D.铁氧化合物循环制H2具有成本低、产物易分离等优点 |
您最近一年使用:0次
2023-09-19更新
|
359次组卷
|
25卷引用:【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题
【区级联考】北京市石景山区2019届高三第一学期期末考试化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题10-2020年北京新高考化学模拟试题辽宁省锦州市滨海实验中学2019-2020学年高三上学期期末考试化学试题海南省海南中学2019-2020学年高二上学期期末考试化学试题(已下线)专题九 化学能与热能(提分特训)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训甘肃省天水市甘谷第一中学2019-2020学年高二下学期开学考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第1节综合训练高中必刷题高二选择性必修1第一章 化学反应的热效应 第二节 反应热的计算 第二节综合训练河北省沧州市泊头市第一中学2020-2021学年高二上学期第一次月考化学试题山东省德州市夏津第一中学2020-2021学年高二上学期9月月考化学试题辽源市第五中学2019-2020学年高一下学期第二次月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题河北省沧州市黄骅中学2020-2021学年高二上学期第三次月考化学试题河南省鹤壁市高级中学2020-2021学年高二上学期尖子生联赛调研二化学试题河北省安平中学2020-2021学年高一下学期第四次月考(期末)化学试题(已下线)模块七 化学反应与能量(模块检测)-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第一单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)贵州省黔西南州赛文高级中学 2021-2022学年高二上学期期中考试化学试题河北省沧州市泊头市第一中学2021-2022学年高二上学期第一次月考化学试题天津市第二中学2022-2023学年高二上学期期中检测化学试题(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)题型98 结合反应能量图示或物质循环图示书写热化学方程式山东省烟台市招远第一中学2022-2023学年高一下学期期中考试化学(等级考)试题(已下线)章末综合评价(六)河南省洛阳市宜阳县第一高级中学清北园2023-2024学年高一上学期第七次能力达标测试化学试卷
4 . 被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O=NaBO2+4H2↑。下列说法中,正确的是
| A.NaBH4既是氧化剂又是还原剂 | B.NaBH4是氧化剂,H2O是还原剂 |
| C.硼元素被氧化,氢元素被还原 | D.被氧化的与被还原的元素质量比为1∶1 |
您最近一年使用:0次
2023-09-12更新
|
320次组卷
|
81卷引用:北京市首都师范大学附属中学2018-2019学年高一上学期期中考试化学试题
北京市首都师范大学附属中学2018-2019学年高一上学期期中考试化学试题(已下线)2010年江苏省灌南县第二高级中学高二下学期期末考试化学试题(已下线)2010年福建省福州三中高三上学期第一次月考化学试题(已下线)2010-2011学年浙江省宁波市高一下学期期末化学试卷(已下线)2012届山东省济南一中高三上学期期末检测化学试卷(已下线)2011-2012学年广东省中山市高一上学期期末统一考试化学试卷(已下线)2013届河北保定唐县一中高三下第二次摸底考试化学试卷(已下线)2014高考名师推荐化学氧化还原概念(已下线)2015届福建省四地六校高三上学期第一次月考化学试卷(已下线)2015届辽宁省沈阳铁路实验中学高一上学期期中考试化学试卷(已下线)2015届山西省忻州第一中学高三上学期期中考试化学试卷2014-2015学年江西省赣州中学高一上学期期中考试化学试卷2015-2016学年辽宁实验中学分校高一上12月月考化学卷2015-2016学年山东省济宁市高一上学期期末化学试卷2016-2017学年福建省厦门一中高一上期中化学卷2016-2017学年云南省云天化中学高一上学期期末考试化学试卷湖南省衡阳县第一中学2018届高三上学期第二次月考化学试题安徽省淮北市第一中学2017-2018学年高一上学期期中考试化学试题辽宁省大连市普兰店区第二中学2017-2018学年高一上学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】河北省保定市蠡县中学2018-2019学年高一上学期9月月考化学试题黑龙江省哈尔滨师范大学青冈实验中学校2016-2017学年高二下学期期末考试化学试题【全国百强校】江苏省南京市南京师范大学附属中学2017-2018学年高一上学期期中考试化学试题新疆维吾尔自治区喀什地区二中2019届高三上学期9月月考化学试题1新疆维吾尔自治区喀什地区二中2019届高三上学期9月月考化学试题2湖南省醴陵市第一中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (题型专练)【全国百强校】山西省实验中学2018-2019学年高一上学期12月月考化学试题【全国百强校】湖南省长沙市雅礼中学2018-2019学年高一第一学期12月月考化学试题内蒙古通辽实验中学2018-2019学年高一上学期12月月考化学试题(已下线)【新东方】高中化学5004华南师范大学附中2019-2020学年高一上学期期中考试化学试题河北省魏县第五中学2019-2020学年高一上学期第二次月考化学试题云南省昆明市第三中学2019-2020学年高一上学期期中考试化学试题江西省南昌市新建县第一中学2019-2020学年高一上学期期末考试(共建部)化学试题山东省济南市历城第二中学2019-2020学年高一上学期期末考试化学试题甘肃省天水市武山一中2019-2020学年高一12月月考化学试题四川省南充市阆中中学2020届高三化学选择题专项训练(2)浙江省温州市2019-2020学年高一上学期期末考试化学试题(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训安徽省定远县民族中学2019-2020学年高二6月月考化学试题(已下线)第一章 总结与检测(测)——2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)人教版(2019)高一必修第一册第一章 物质及其变化 第三节 氧化还原反应 课时2 氧化剂和还原剂黑龙江省哈尔滨师范大学青冈实验中学校2020-2021学年高一(英才、卓越)10月月考化学试题湖南省娄底市2020-2021学年高二上学期期中考试化学试题高一必修第一册(苏教2019) 模块综合测评吉林省白城市洮南一中2020-2021学年高一上学期期中考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一12月月考化学试题浙江省瑞安中学2020-2021学年高一上学期10月月考化学试题吉林省延边第二中学2020-2021学年高一上学期第一次考试月考化学试题 北京市昌平区第一中学 2023-2024学年高一上学期期中考试化学试题江西省上饶市2020-2021学年高一上学期期末教学质量测试化学试题重庆市铁路中学2020-2021学年高一上学期1月月考化学试题(已下线)【浙江新东方】高中化学20210304-021山西省晋城市(高平一中、阳城一中、高平实验中学)2020-2021学年高一下学期开学考试化学试题河南省宏力学校2020-2021学年高一上学期期末考试化学试题湖北省武汉市蔡甸区汉阳一中2021-2022学年高一上学期9月月考化学试题辽宁省朝阳市凌源市2021-2022学年高一上学期第一次联考化学试题辽宁省庄河市高级中学2021-2022学年高一10月月考化学试题安徽省定远县炉桥中学2021-2022学年高二上学期10月教学质量检测化学试题四川省绵阳东辰国际学校2021-2022学年高一上学期第一次月考试化学试题江西省新余四中2021-2022学年高一上学期励志班阶段考试化学试题天津市河北区2021-2022学年高一上学期期末质量检测化学试题黑龙江省大庆市肇州县第二中学2021-2022学年高一下学期第一次月考化学试题河南省温县第一高级中学2022-2023学年高二上学期第二次月考化学试题天津市第二十五中学2022-2023学年高一上学期第一次阶段检测化学试题新疆阿克苏地区阿瓦提县第四中学2022-2023学年高一上学期第二次诊断性测试化学试题广东省佛山市三水中学2022-2023学年高一上学期第一次检测(10月份)化学试题宁夏银川市景博中学2022-2023学年高二上学期期中考试化学试题内蒙古自治区呼伦贝尔市鄂温克族自治旗第三中学2021-2022学年高一上学期第一次月考化学试题西藏林芝市第二高级中学2021-2022学年高三上学期第二次月考理综化学试题湖北省武汉市第四中学2021-2022学年高一上学期10月月考化学试题湖北省武汉中学2021-2022高一上学期10月月考化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题上海市行知中学2022-2023学年高二下学期3月月考化学试题云南省峨山彝族自治县第一中学2022-2023学年高一下学期期末考试化学试题河北省石家庄市新乐市第一中学2023-2024学年高三上学期开学测试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高一上学期期中考试化学试题四川省遂宁市射洪中学校2023-2024学年高一上学期11月期中化学试题甘肃省兰州市第五十五中学2023-2024学年高一下学期开学测试化学试卷云南省大理市下关第一中学2023-2024学年高一下学期开学化学试题
5 . 化学与人类生产、生活密切相关,按要求回答下列问题。
(1)工业上制造光导纤维的基本原料是_______ (填化学式)。
(2)钠的化合物中,可用作潜水艇中供氧剂的是_______ ,其与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
(4)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是_______ (填化学式)。
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备: (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目_______ 。若反应中共转移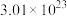 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为_______ L(标准状况下)。
(1)工业上制造光导纤维的基本原料是
(2)钠的化合物中,可用作潜水艇中供氧剂的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
A. | B. | C.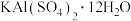 | D. |
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备:
 (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目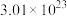 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为
您最近一年使用:0次
2023-07-31更新
|
361次组卷
|
4卷引用:陕西省汉中市2020-2021学年高一上学期期末考试化学试题
陕西省汉中市2020-2021学年高一上学期期末考试化学试题(已下线)结构与性质(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
名校
6 . 铜银合金在现代工业中有广泛应用。从铜银合金切割废料(不含其它金属)中回收银并制备铜化工产品的工艺如图。
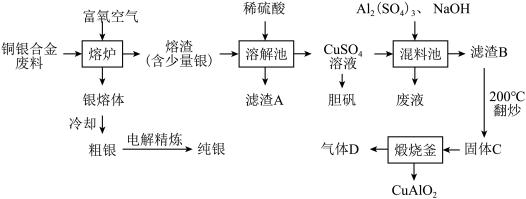
(1)向熔炉中通入适量富氧空气的目的是:___________ 。
(2)滤渣A溶于稀硝酸时产生无色气体,该反应的离子方程式为___________ 。
(3)在混料池中,将三种原料按一定的物质的量之比混合均匀,煮沸,过滤。将滤渣B在200℃下翻炒至质量不再变化,得到固体C.C只含CuO、Al2O3,物质的量之比为2:1。在惰性气体保护下,将C在煅烧釜中高温灼烧,得到CuAlO2.该反应的方程式为___________ 。
(4)若溶解所得溶液中含有1molCuSO4,则混料时应加入___________ molNaOH。
(5)冷却银熔体得到的粗银可使用电解法精炼,精炼池中阳极的电极反应为___________ 。
(6)该工艺中,可循环利用的物质为___________ 。

(1)向熔炉中通入适量富氧空气的目的是:
(2)滤渣A溶于稀硝酸时产生无色气体,该反应的离子方程式为
(3)在混料池中,将三种原料按一定的物质的量之比混合均匀,煮沸,过滤。将滤渣B在200℃下翻炒至质量不再变化,得到固体C.C只含CuO、Al2O3,物质的量之比为2:1。在惰性气体保护下,将C在煅烧釜中高温灼烧,得到CuAlO2.该反应的方程式为
(4)若溶解所得溶液中含有1molCuSO4,则混料时应加入
(5)冷却银熔体得到的粗银可使用电解法精炼,精炼池中阳极的电极反应为
(6)该工艺中,可循环利用的物质为
您最近一年使用:0次
2023-04-26更新
|
114次组卷
|
2卷引用:北京市中国人民大学附属中学2019-2020学年高三下学期月考化学试题
名校
7 . 正极材料为LiCoO2的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为_______ 。
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能_______ 。
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为_______ 。
②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_______ (填化学式),在350~400℃范围内,剩余固体的成分为_______ (填化学式)。

(1)橄榄石型LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
①共沉淀反应除了得到LiFePO4外,还有另外一种酸式盐产物,请写出共沉淀的化学方程式为
②高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善诚信后的LiFePO4的导电性能外,还能
(2)废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂。

①在上述溶解过程中,S2O
 被氧化成SO
被氧化成SO ,LiCoO2在溶解过程中反应的化学方程式为
,LiCoO2在溶解过程中反应的化学方程式为②已知Co的氧化物与Fe的氧化物类似。Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为

您最近一年使用:0次
2023-04-26更新
|
178次组卷
|
2卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
名校
8 . 向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式_______ (如果系数是1,不用填写):

(2)整个过程中的还原剂是_______ 。
(3)把KI换成KBr,则CCl4层变为_______ 色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是_______ 。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)500kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2_______ L(标准状况,保留2位小数)。
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式

(2)整个过程中的还原剂是
(3)把KI换成KBr,则CCl4层变为
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)500kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2
您最近一年使用:0次
2023-04-26更新
|
295次组卷
|
3卷引用:北京市中国人民大学附属中学2020届高三化学质检试题
9 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+aNa2O2═2Na2FeO4+bX+2Na2SO4+cO2↑
该反应中物质X应是___________ ,b与c的关系是___________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1molFeO 转移
转移___________ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为___________ mol。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+aNa2O2═2Na2FeO4+bX+2Na2SO4+cO2↑
该反应中物质X应是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1molFeO
 转移
转移
您最近一年使用:0次
10 . 氮化铝广泛用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应如下方法合成:Al2O3+N2+3C 2AlN+3CO。对该反应,下列叙述正确的是
2AlN+3CO。对该反应,下列叙述正确的是
 2AlN+3CO。对该反应,下列叙述正确的是
2AlN+3CO。对该反应,下列叙述正确的是| A.AlN的摩尔质量为41g |
| B.N2是还原剂,Al2O3是氧化剂 |
| C.AlN中氮元素的化合价为+3 |
| D.每生成1molAlN需转移3mol电子 |
您最近一年使用:0次
2023-04-26更新
|
319次组卷
|
4卷引用:北京市中国人民大学附属中学2018-2019学年高一上学期期中考试化学试题
北京市中国人民大学附属中学2018-2019学年高一上学期期中考试化学试题北京汇文中学2023-2024学年高一上学期期中考试化学试题(已下线)第11讲 氧化还原反应的配平及应用-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)第10讲 氧化还原反应的基本概念-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)



