名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: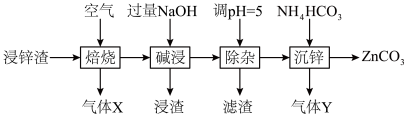
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):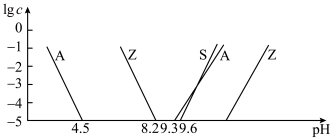
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
207次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
2 . 实验室以含钴废料(主要成分是CoO、Co2O3,含少量Fe2O3、Al2O3等杂质)为原料制备CoCO3的流程如图所示。
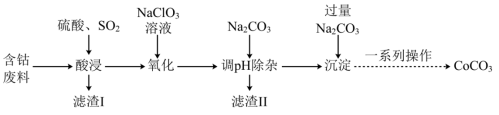
已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
回答下列问题:
(1)基态钴原子的价层电子排布式为_______ ,在“酸浸”之前,先要对含钴废料进行粉碎处理,其目的是_______ 。
(2)“酸浸”时需通入SO2,其中SO2作______ (填“氧化剂”或“还原剂”),由于“酸浸”时,溶液中会产生Fe3+,写出SO2与Fe3+反应的离子方程式:______ 。
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为______ 。
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为______ 至______ 。(加入NaClO3和Na2CO3时,溶液的体积变化忽略)
(5)“滤渣II”的主要成分为______ 。
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有_______ 。
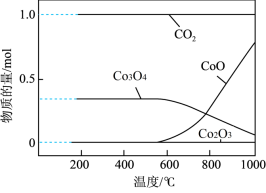
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为_______ 。

已知:①“酸浸”后过滤得到的滤液中含有Co2+、Fe2+、Al3+等。
②有关沉淀数据如表(完全沉淀时金属离子浓度≤1×10-5mol/L):
| 沉淀 | Al(OH)3 | Fe(OH)3 | Co(OH)2 |
| 恰好完全沉淀时的pH | 5.2 | 2.8 | 9.4 |
(1)基态钴原子的价层电子排布式为
(2)“酸浸”时需通入SO2,其中SO2作
(3)“氧化”流程中,氧化剂与还原剂的物质的量之比为
(4)常温下,若浸取液中c(Co2+)=0.1mol/L,则“调pH除杂”时需调节溶液pH的范围为
(5)“滤渣II”的主要成分为
(6)“一系列操作”为过滤、洗涤、干燥,其中过滤所需要的硅酸盐材质的仪器有
(7)将得到的CoCO3固体在空气中加热,反应温度对反应产物的影响如图所示,则500~1000℃时,发生主要反应的化学方程式为

您最近一年使用:0次
名校
3 . 黄铁矿的主要成分是FeS2 (Fe为 价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO
价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO +16H+。下列说法中正确的是
+16H+。下列说法中正确的是
 价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO
价),利用Fe2(SO4)3溶液可以浸取黄铁矿中的Fe元素,浸取反应的离子方程式为14Fe3++FeS2+8H2O=15Fe2++2SO +16H+。下列说法中正确的是
+16H+。下列说法中正确的是| A.反应中氧化产物和还原产物的物质的量之比为2∶15 |
| B.FeS2是反应中的氧化剂,发生还原反应 |
C.由反应可知氧化性:SO >Fe3+ >Fe3+ |
D.每生成1mol SO ,反应中转移的电子是7mol ,反应中转移的电子是7mol |
您最近一年使用:0次
2024-02-24更新
|
263次组卷
|
3卷引用:云南师范大学附属中学2023-2024学年高一下学期第一次月考化学试题
名校
4 . 工业生产中除去电石渣浆(含 )中的
)中的 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
 )中的
)中的 并制取硫酸盐的一种常用流程如图所示。下列说法正确的是
并制取硫酸盐的一种常用流程如图所示。下列说法正确的是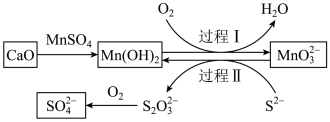
A.碱性条件下,氧化性: |
B.过程Ⅱ中,反应的离子方程式为 |
C.将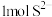 转化为 转化为 理论上需要 理论上需要 的体积为 的体积为 (标准状况) (标准状况) |
| D.该过程中涉及的化学反应均是氧化还原反应 |
您最近一年使用:0次
2024-01-14更新
|
914次组卷
|
2卷引用:云南师范大学附属中学2023-2024学年高一上学期1月教学测评期末化学试题
名校
5 . 钼系催化剂主要用于石油炼制和化学工业中。从废催化剂(主要成分为MoS、 和
和 )中提取比较贵重的金属钒和钼,工艺流程如下:
)中提取比较贵重的金属钒和钼,工艺流程如下:

回答下列问题:
(1)“焙烧”时需对废催化剂进行粉碎,目的是___________ 。
(2)“焙烧”过程中MoS、 和
和 均转化为对应的钠盐,写出MoS转化为
均转化为对应的钠盐,写出MoS转化为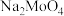 的化学方程式
的化学方程式___________ 。
(3)“滤渣”的化学式为___________ 。滤液①的主要成分为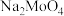 、
、___________ 。“沉铝”过程反应的离子方程式为___________
(4)“沉钼”的离子方程式为___________ 。
(5)高温用 还原
还原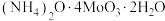 得钼金属,氧化剂与还原剂物质的量之比为
得钼金属,氧化剂与还原剂物质的量之比为___________ 。
 和
和 )中提取比较贵重的金属钒和钼,工艺流程如下:
)中提取比较贵重的金属钒和钼,工艺流程如下:
回答下列问题:
(1)“焙烧”时需对废催化剂进行粉碎,目的是
(2)“焙烧”过程中MoS、
 和
和 均转化为对应的钠盐,写出MoS转化为
均转化为对应的钠盐,写出MoS转化为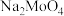 的化学方程式
的化学方程式(3)“滤渣”的化学式为
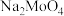 、
、(4)“沉钼”的离子方程式为
(5)高温用
 还原
还原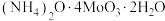 得钼金属,氧化剂与还原剂物质的量之比为
得钼金属,氧化剂与还原剂物质的量之比为
您最近一年使用:0次
2023-12-16更新
|
95次组卷
|
2卷引用:云南省保山市腾冲市2022-2023学年高二上学期期中教育教学质量监测化学试卷
名校
6 . 环己酮是重要化工原料,是制造尼龙的主要中间体,也是重要的工业溶剂,实验室利用如下反应原理和实验装置制备环己酮(夹持、加热装置略,C1、C2处有仪器未画出):

环己醇、环己酮和饱和食盐水的部分物理性质见表(括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
实验步骤:
I.实验中通过装置B将酸性Na2Cr2O7溶液分批滴加到盛有30mL环己醇的A中,加入第一批Na2Cr2O7溶液后,待反应物的橙红色消失后再加入第二批……依次进行下去,直至反应结束,控制反应在55~65℃进行。反应结束后,向反应液中加入适量的草酸。
II.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
III.进一步分离提纯得到精环已酮18.0g。
(1)实验装置图中C1处应放置的仪器名称为___________ 。
(2)用蒸馏不能分离环己酮和水的原因是___________ 。
(3)实验过程中Na2Cr2O7溶液分批加入的原因是___________ 。
(4)步骤I加入适量草酸为了将剩余的Na2Cr2O7完全反应,草酸与Na2Cr2O7的物质的量之比为________ 时反应恰好进行完全。
(5)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151-156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水。
上述操作的正确顺序是_______ 序号)。上述操作c中,加入NaCl固体的作用是_________ 。
(6)计算环己酮的产率_________ 。(保留整数)

环己醇、环己酮和饱和食盐水的部分物理性质见表(括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点)
| 物质 | 密度/(g/cm3) | 沸点/℃ | 部分性质 |
| 环己醇 | 0.90 | 161.1(97.8) | 能溶于水,具有还原性,易被氧化 |
| 环己酮 | 0.88 | 155.6(95) | 微溶于水,遇氧化剂易发生开环反应 |
| 饱和食盐水 | 1.33 | 108.0 |
I.实验中通过装置B将酸性Na2Cr2O7溶液分批滴加到盛有30mL环己醇的A中,加入第一批Na2Cr2O7溶液后,待反应物的橙红色消失后再加入第二批……依次进行下去,直至反应结束,控制反应在55~65℃进行。反应结束后,向反应液中加入适量的草酸。
II.反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
III.进一步分离提纯得到精环已酮18.0g。
(1)实验装置图中C1处应放置的仪器名称为
(2)用蒸馏不能分离环己酮和水的原因是
(3)实验过程中Na2Cr2O7溶液分批加入的原因是
(4)步骤I加入适量草酸为了将剩余的Na2Cr2O7完全反应,草酸与Na2Cr2O7的物质的量之比为
(5)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151-156℃馏分,得到精品
b.过滤
c.在收集到的粗品中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水。
上述操作的正确顺序是
(6)计算环己酮的产率
您最近一年使用:0次
2023-09-05更新
|
162次组卷
|
2卷引用:云南省蒙自市第一高级中学2023-2024学年高二上学期11月期中化学试题
7 . 4.35g铜镁合金完全溶于一定浓度的硝酸,产生4480mL的 和1120mL的NO气体(标准状况下),反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀最大质量为
和1120mL的NO气体(标准状况下),反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀最大质量为
 和1120mL的NO气体(标准状况下),反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀最大质量为
和1120mL的NO气体(标准状况下),反应后的溶液中加入足量氢氧化钠溶液,生成的沉淀最大质量为| A.20.60g | B.10.30g | C.15.50g | D.31.00g |
您最近一年使用:0次
名校
解题方法
8 . 将56gFe溶于一定体积的稀硝酸中,Fe完全溶解后,溶液质量增重35g,如只产生NO气体,下列说法中正确的是
| A.反应后的溶液中,n(Fe2+)=0.9mol |
| B.Fe失去电子的物质的量为3mol |
| C.反应后的溶液中可能存在过量的硝酸 |
| D.上述反应初始时,n(HNO3)=4mol |
您最近一年使用:0次
2023-06-03更新
|
282次组卷
|
2卷引用:云南省云南师范大学实验中学2023-2024学年高一下学期三月月考化学试题
名校
解题方法
9 . 苯甲酸是一种重要的化工产品,在25℃和95℃下在水中的溶解度分别为0.3 g和6.9 g。实验室制备苯甲酸并测定其纯度的步骤如下:
I.苯甲酸的制备
量取一定量的甲苯和足量
 溶液发生反应:
溶液发生反应: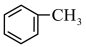 +2KMnO4
+2KMnO4
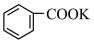 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
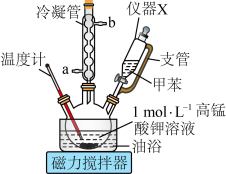
(1)仪器X的名称为_______ ,冷凝管的出水口为_______ (填“a”或“b”)。
(2)三颈烧瓶中反应基本完成的现象为_______ ,用油浴加热的优点是_______ 。
(3)“滤渣”的主要成分为_______ (填化学式);每得到1 mol滤渣,理论上转移的电子的物质的量为_______ mol。
(4)酸化时,_______ (填“能”或“不能”)用冰醋酸代替浓硫酸,理由是_______ 。
II.纯度测定
(5)称取0.10 g样品,溶于15 mL NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为_______ ,若第二次滴定过程中,滴定管起始有气泡,滴定终点时气泡消失,则导致所测得样品中苯甲酸的纯度_______ (填“偏高”、“偏低”或“不变”)。
I.苯甲酸的制备
量取一定量的甲苯和足量

 溶液发生反应:
溶液发生反应: +2KMnO4
+2KMnO4
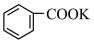 +KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
+KOH+3MnO2↓+H2O,装置如图所示。待甲苯完全反应后趁热过滤,用少量热水洗涤滤渣,合并滤液和洗涤液,然后放在冷水浴中冷却,用浓硫酸酸化使溶液由强碱性变为强酸性,至苯甲酸全部析出,过滤得到粗产品。
(1)仪器X的名称为
(2)三颈烧瓶中反应基本完成的现象为
(3)“滤渣”的主要成分为
(4)酸化时,
II.纯度测定
(5)称取0.10 g样品,溶于15 mL
 NaOH溶液中,加入2滴酚酞作指示剂,用
NaOH溶液中,加入2滴酚酞作指示剂,用 盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用
盐酸滴定至红色恰好消失,加入20 mL乙醚,再加入10滴溴酚蓝作指示剂,摇匀,用 盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
盐酸滴定,边滴边将水层和乙醚层充分摇匀使生成的苯甲酸及时被乙醚溶解,滴定至终点时,消耗8.0 mL盐酸,则苯甲酸的纯度为
您最近一年使用:0次
2023-01-14更新
|
174次组卷
|
3卷引用:云南省开远市第一中学校2022-2023学年高二下学期4月月考化学试题
10 . 回答下列问题:
(1)实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为2KMnO4 K2MnO4+MnO2+O2↑,其中还原产物是
K2MnO4+MnO2+O2↑,其中还原产物是_____ (填元素符号),该反应每生成0.1个O2时转移_____ 个电子。
(2)反应方程式:K2Cr2O7+14HCl 2KCl+2CrCl3+3Cl2↑+7H2O中还原剂是
2KCl+2CrCl3+3Cl2↑+7H2O中还原剂是______ ,氧化产物是______ 。
(3)下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
根据以上三个反应,回答下列有关问题:
I.反应②的离子方程式为______ 。
II.反应①中,氧化产物与还原产物的质量比为______ 。
III.已知反应④:4HCl+O2 2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为______ 。
IV.配平______KMnO4+______KNO2+______——______MnSO4+______K2SO4+______KNO3+______H2O______
(1)实验室制备氧气可以用加热高锰酸钾的方法实现,其发生的反应为2KMnO4
 K2MnO4+MnO2+O2↑,其中还原产物是
K2MnO4+MnO2+O2↑,其中还原产物是(2)反应方程式:K2Cr2O7+14HCl
 2KCl+2CrCl3+3Cl2↑+7H2O中还原剂是
2KCl+2CrCl3+3Cl2↑+7H2O中还原剂是(3)下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
根据以上三个反应,回答下列有关问题:
I.反应②的离子方程式为
II.反应①中,氧化产物与还原产物的质量比为
III.已知反应④:4HCl+O2
 2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为IV.配平______KMnO4+______KNO2+______——______MnSO4+______K2SO4+______KNO3+______H2O
您最近一年使用:0次
2023-01-04更新
|
521次组卷
|
2卷引用:云南省曲靖市第一中学2022-2023学年高一上学期第一次检测化学试题



