1 . Ⅰ.下面两个方法都可以用来制氯气:①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2
MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2 2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
(1)反应①的离子方程式为___________ 。
(2)浓盐酸在反应①中表现出来的性质是___________。
(3)若要制得相同质量的氯气,反应①②所消耗的HCl的质量之比为___________ 。
(4)由上述3个反应发生的条件可推知MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为___________ 。
Ⅱ.某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。___________ (填名称)。
(6)装置③中现象是___________ ,装置④中有一处错误,更正为___________ 。
(7)装置⑦是用于氯气的尾气处理,防止污染空气,发生反应的化学方程式为___________ 。
 MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2
MnCl2+Cl2↑+2H2O;②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。③4HCl+O2 2Cl2+2H2O(g),根据以上两个反应,回答下列问题:
2Cl2+2H2O(g),根据以上两个反应,回答下列问题:(1)反应①的离子方程式为
(2)浓盐酸在反应①中表现出来的性质是___________。
| A.只有还原性 | B.只有氧化性 | C.只有酸性 | D.既表还原性和又表酸性 |
(3)若要制得相同质量的氯气,反应①②所消耗的HCl的质量之比为
(4)由上述3个反应发生的条件可推知MnO2、KMnO4、O2三种物质氧化性由强到弱的顺序为
Ⅱ.某同学欲利用浓盐酸、MnO2、Fe等试剂制取无水氯化铁、收集一定量的氯气并验证其某些性质,实验装置如图所示(制气装置省略)。
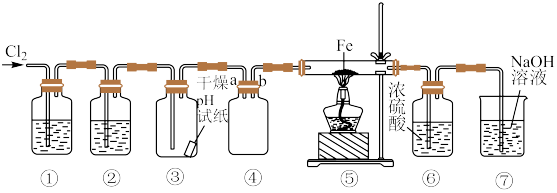
(6)装置③中现象是
(7)装置⑦是用于氯气的尾气处理,防止污染空气,发生反应的化学方程式为
您最近一年使用:0次
2 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以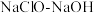 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(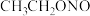 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以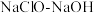 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(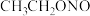 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入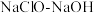 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成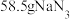 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次
3 . 工业上处理含铬( )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:
Ⅰ. 还原法:含铬酸性废水
还原法:含铬酸性废水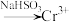 (含
(含 等)
等)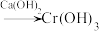 沉淀(含
沉淀(含 等沉淀)
等沉淀)
Ⅱ.电解法:含铬酸性废水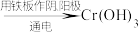 沉淀[含
沉淀[含 等沉淀]
等沉淀]
下列说法错误的是
 )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:Ⅰ.
 还原法:含铬酸性废水
还原法:含铬酸性废水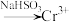 (含
(含 等)
等)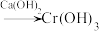 沉淀(含
沉淀(含 等沉淀)
等沉淀)Ⅱ.电解法:含铬酸性废水
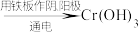 沉淀[含
沉淀[含 等沉淀]
等沉淀]下列说法错误的是
A. 和 和 中的S原子都采用 中的S原子都采用 杂化 杂化 |
B.Ⅰ和Ⅱ中,等量的 发生还原反应时消耗的 发生还原反应时消耗的 的量不同 的量不同 |
C.Ⅰ中参加反应的 |
D.Ⅱ中处理含 的废水转移6mol电子 的废水转移6mol电子 |
您最近一年使用:0次
2024·湖南长沙·三模
名校
4 . 钒是重要的战略资源,以硫酸工业产生的废钒催化剂为原料(含V2O5、VOSO4、K2SO4、SiO2以及少量的Fe2O3等),综合回收利用钒、硅、钾实现变废为宝、保护环境的目的,回收工艺流程如下: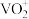 、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
(1)“水浸”前,通常需要将催化剂粉碎,其目的是___________ 。
(2)“滤渣2”转化为Na2SiO3的化学方程式是___________ 。
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是___________ 。
②过程中除了有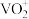 被还原成VO2+,还涉及的反应离子方程式为
被还原成VO2+,还涉及的反应离子方程式为___________ 。
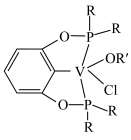
③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供___________ (选填“孤对电子”或“空轨道”)。 2H++VOR(有机层),“反萃取”应选择在
2H++VOR(有机层),“反萃取”应选择在___________ 环境中进行(选填“酸性”、“中性”或“碱性”)。
(5)加氨水生成VO(OH)2沉淀,若经焙烧得到1molV2O5产品,则消耗空气中O2______ mol。
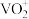 、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。
、VO2+存在,pH增大时VO2+可转化为VO(OH)2沉淀。(1)“水浸”前,通常需要将催化剂粉碎,其目的是
(2)“滤渣2”转化为Na2SiO3的化学方程式是
(3)“还原酸浸”时:
①硫酸的用量会影响钒的浸出率,pH需保持在1.2以下的原因是
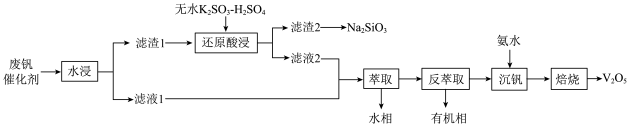
②过程中除了有
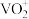 被还原成VO2+,还涉及的反应离子方程式为
被还原成VO2+,还涉及的反应离子方程式为③若以磷酸为介质处理废催化剂,可以提高钒的浸出率。一种钒磷配合物的结构如图所示,形成配位键时V提供
 2H++VOR(有机层),“反萃取”应选择在
2H++VOR(有机层),“反萃取”应选择在(5)加氨水生成VO(OH)2沉淀,若经焙烧得到1molV2O5产品,则消耗空气中O2
您最近一年使用:0次
5 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①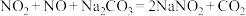 ;
;
②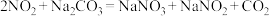 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
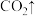 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
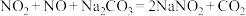 ;
;②
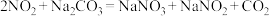 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近一年使用:0次
名校
解题方法
6 . I.氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式___________ 。
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为___________ 。
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是___________ ,其中 H2S在该反应中___________ (填序号)。
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是___________ (填“还原性”或“氧化性”)。
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:___________ 。
(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式___________ 。
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是___________ 。
(8)比较④与⑨的简单气态氢化物的稳定性___________ >___________ (填化学式)。
(9)由下列元素形成的化合物中含有离子键的是___________。
(10)写出⑤在空气中燃烧产物的电子式:___________ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式
(2)火药是中国的四大发明之一,永远值得中华儿女骄傲。黑火药在发生爆炸时,发生如下反应2KNO3+3C+S=K2S+N2↑+3CO2↑,则生成1molN2反应过程中转移电子的数目为
(3)中国古代著作中有“银针验毒”的记录,其原理为4Ag+2H2S+O2=2X+2H2O,则X的化学式是
A.作氧化剂 B.作还原剂 C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(4)砒霜(As2O3)与Zn可以发生如下反应As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O,其中氢元素的化合价未发生改变。在上述反应中As2O3,显示出来的性质是
II.元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分,数字①~⑨代表九种常见的短周期元素,请按题目要求回答下列问题:

(6)在①~⑨元素中,原子半径最大的元素,其某种氧化物可用于呼吸面具中氧气来源,请写出该物质与二氧化碳反应化学方程式
(7)写出⑤、⑦两种元素所形成的最高价氧化物对应的水化物反应的离子方程式是
(8)比较④与⑨的简单气态氢化物的稳定性
(9)由下列元素形成的化合物中含有离子键的是___________。
| A.①③ | B.②③ | C.①④ | D.⑥⑨ |
您最近一年使用:0次
解题方法
7 . 今年春晚长沙分会场的焰火璀璨夺目,燃放烟花时发生反应: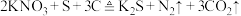 ,同时在火药中会加入
,同时在火药中会加入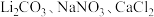 等物质。下列说法正确的是
等物质。下列说法正确的是
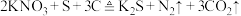 ,同时在火药中会加入
,同时在火药中会加入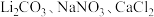 等物质。下列说法正确的是
等物质。下列说法正确的是A.该反应中,氧化产物与还原产物物质的量之比为 |
B.每生成 ,被S氧化的C的物质的量为 ,被S氧化的C的物质的量为 |
C.火药中的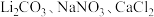 均不参与化学反应 均不参与化学反应 |
| D.燃放烟花对环境没有污染 |
您最近一年使用:0次
8 . 高锰酸钾在工业中广泛用作氧化剂。以软锰矿(主要成分是 ,含有
,含有 和
和 等杂质)为原料制备高锰酸钾的工艺流程如图所示:
等杂质)为原料制备高锰酸钾的工艺流程如图所示:
①“焙烧”中有 生成。
生成。
②20℃时各物质的溶解度如下表。
下列说法错误的是
 ,含有
,含有 和
和 等杂质)为原料制备高锰酸钾的工艺流程如图所示:
等杂质)为原料制备高锰酸钾的工艺流程如图所示: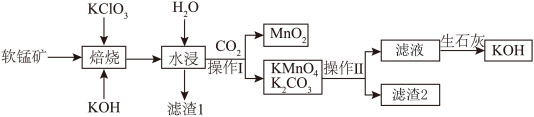
①“焙烧”中有
 生成。
生成。②20℃时各物质的溶解度如下表。
| 物质 |  |  |  |
| 溶解度/g | 6.38 | 111 | 11.1 |
A.“焙烧”时,主要反应的化学方程式为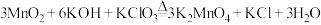 |
B.操作Ⅰ,若通入4mol  时,理论上转移电子数为2 时,理论上转移电子数为2 |
C.“焙烧”时加入的KOH应适量,否则制得的 中混有含Si元素的杂质 中混有含Si元素的杂质 |
D.操作Ⅱ为蒸发浓缩、冷却结晶、过滤,滤渣2的主要成分为 |
您最近一年使用:0次
9 . 基态锇原子(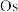 )的价电子排布式为
)的价电子排布式为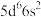 。氧化物
。氧化物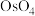 常作烯烃醇化的氧化剂,其重要的氮基锇酸盐有
常作烯烃醇化的氧化剂,其重要的氮基锇酸盐有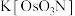 。有关反应如下:
。有关反应如下:
反应I:
反应Ⅱ:
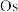 )的价电子排布式为
)的价电子排布式为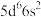 。氧化物
。氧化物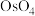 常作烯烃醇化的氧化剂,其重要的氮基锇酸盐有
常作烯烃醇化的氧化剂,其重要的氮基锇酸盐有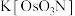 。有关反应如下:
。有关反应如下:反应I:

反应Ⅱ:

反应IⅢ:
A. 的立体异构分子中不存在手性分子 的立体异构分子中不存在手性分子 |
B.反应I中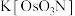 的 的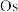 的化合价为+8 的化合价为+8 |
| C.反应Ⅱ中氧化产物与还原产物的物质的量之比为1∶1 |
D.由反应Ⅲ可推测氧化性: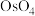 强于酸性 强于酸性 溶液 溶液 |
您最近一年使用:0次
解题方法
10 .  是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是

 是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是
是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是
A.每个 晶胞中 晶胞中 个数为x 个数为x |
B.每个 晶胞中0价Cu原子个数为 晶胞中0价Cu原子个数为 |
C.每个 晶胞完全转化为 晶胞完全转化为 晶胞,转移电子数为2 晶胞,转移电子数为2 |
D.当 转化为 转化为 时,每转移 时,每转移 电子,产生 电子,产生 原子 原子 |
您最近一年使用:0次



