名校
1 . 铜是使用广泛的一种金属。下图是某高砷银铜精矿制取铜、银的工艺。该矿石的主要成分是CuS,还含有Ag、As、Ca、Si、Al等的化合物。
①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
② 。
。
③萃取原理 。
。
回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式___________ 。
(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是___________ 。
(3)写出氨浸铜反应的离子方程式___________ 。氨铵比1:1时氨浸铜效果最好,此时溶液pH=___________ 。
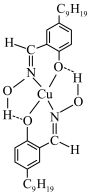
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为___________ ,萃取时萃取剂分子中___________ 键断裂。___________ 。
(6)浸银液含 ,还原时氧化产物为
,还原时氧化产物为 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为___________ 。

①As2O3剧毒、沸点457℃,可由硫化物氧化得到。
②
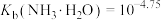 。
。③萃取原理
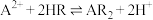 。
。回答下列问题:
(1)焙烧时温度保持500℃,CuS转化为CuO,As2S和CaO、O2作用转化为
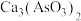 、CaSO4,写出As2S3反应的化学方程式
、CaSO4,写出As2S3反应的化学方程式(2)如果矿石中不含CaO,焙烧时需要添加CaO(或CaCO3),不添加可能的后果是
(3)写出氨浸铜反应的离子方程式
(4)如图为萃取剂和Cu2+形成的配离子的结构简式,该配合物中配位原子为
(6)浸银液含
 ,还原时氧化产物为
,还原时氧化产物为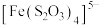 ,氧化剂和还原剂的物质的量之比为
,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
2024-04-21更新
|
201次组卷
|
2卷引用:山西省平遥中学2023-2024学年高三二模考试化学试题
解题方法
2 . 钯(Pd)是航天、航空等高科技领域不可缺少的关键材料。一种从铂钯精矿[含有Pt、Pd、Au、Cu、Bi]中分离提取钯的工艺流程如图所示:
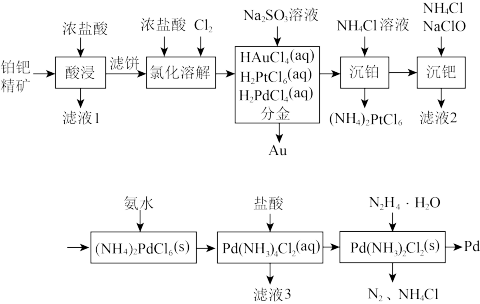
(1)“滤液1”中含有 和
和 ,
, 中Cu的化合价为
中Cu的化合价为________ ;Bi与As在周期表中位于同一主族,基态As原子的简化电子排布式为________ 。
(2)“氯化溶解”时氯气的作用是_________ 。
(3)“分金”时, 的氧化性
的氧化性____ (填“大于”或“小于”) ,理由是
,理由是_____ 。
(4)“沉铂”时发生反应的化学方程式为_________ 。
(5)“沉钯”时反应的化学方程式为___________ 。“滤液3”可以进入到________ 中循环利用。
(6) (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为________ 。

(1)“滤液1”中含有
 和
和 ,
, 中Cu的化合价为
中Cu的化合价为(2)“氯化溶解”时氯气的作用是
(3)“分金”时,
 的氧化性
的氧化性 ,理由是
,理由是(4)“沉铂”时发生反应的化学方程式为
(5)“沉钯”时反应的化学方程式为
(6)
 (水合肼)将
(水合肼)将 还原为金属钯时,还原剂与氧化剂的物质的量之比为
还原为金属钯时,还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
2024-04-09更新
|
277次组卷
|
3卷引用:山西省晋中市2024届高三第二次优生测试理综合化学试题-
3 . 目前支原体肺炎流行,及时消毒有利于降低感染几率。常用的消毒剂有双氧水、医用酒精以及含氯消毒剂等,其中含氯消毒剂的家族最庞大、应用最广泛。
(1)次氯酸钠( )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为___________ 。
(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是___________ ,若生成标况下44.8L的 ,转移电子的数目为
,转移电子的数目为___________ 。
(3)如果在不同温度、浓度的条件下, 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,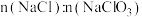 为
为___________ ,整个过程,参加反应所需 与氯气的物质的量之比为
与氯气的物质的量之比为___________ 。
若将 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:
(4) 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法___________ 。
A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
亚氯酸钠( )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。 在发生器中发生
在发生器中发生________ (氧化或还原)反应,该反应的还原产物为_________ ,吸收塔中温度不宜过高,否则会导致 产率下降,原因是
产率下降,原因是___________ 。
(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为___________ 。(保留两位小数)。
(1)次氯酸钠(
 )为“84”消毒液的有效成分,常温下用烧碱溶液吸收
)为“84”消毒液的有效成分,常温下用烧碱溶液吸收 可制备“84”消毒液,反应的化学方程式为
可制备“84”消毒液,反应的化学方程式为(2)但在巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿,一种可能原因是
 与
与 反应产生
反应产生 促进藻类快速生长,该反应中氧化剂是
促进藻类快速生长,该反应中氧化剂是 ,转移电子的数目为
,转移电子的数目为(3)如果在不同温度、浓度的条件下,
 与
与 溶液的反应,可以生成
溶液的反应,可以生成 或
或 。现将氯气缓缓通入冷
。现将氯气缓缓通入冷 溶液,当溶液中含有的
溶液,当溶液中含有的 与
与 的物质的量为1:1时,
的物质的量为1:1时,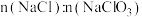 为
为 与氯气的物质的量之比为
与氯气的物质的量之比为若将
 通入含amol
通入含amol 的溶液中,发生上述过程,回答下列问题:
的溶液中,发生上述过程,回答下列问题:(4)
 与
与 的物质的量之和可能为
的物质的量之和可能为 amol,该说法
amol,该说法A.正确 B.错误
(5)反应中转移电子的物质的量可能为___________。
A. amol amol | B. amol amol | C. amol amol | D.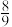 amol amol |
亚氯酸钠(
 )为便携式消毒除菌卡的主要活性成分,一种制备
)为便携式消毒除菌卡的主要活性成分,一种制备 粗产品的工艺流程如下图,已知,纯
粗产品的工艺流程如下图,已知,纯 易分解爆炸,一般用空气稀释到10%以下。
易分解爆炸,一般用空气稀释到10%以下。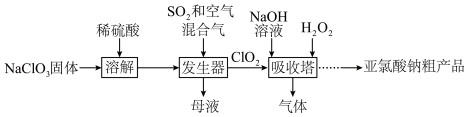
 在发生器中发生
在发生器中发生 产率下降,原因是
产率下降,原因是(7)“有效氯含量”的定义是:每克含氯消毒剂的氧化能力(即得电子数)相当于多少克
 的氧化能力(氯元素均被还原至
的氧化能力(氯元素均被还原至 价),则亚氯酸钠
价),则亚氯酸钠 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
2024-02-02更新
|
0次组卷
|
2卷引用:山西省运城市景胜中学2023-2024学年高一下学期3月月考化学试题
11-12高三上·山西·单元测试
名校
解题方法
4 . 向含有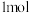
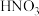 和
和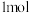
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有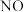 )。下列有关判断不正确的是
)。下列有关判断不正确的是
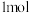
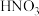 和
和
 的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有
的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有 )。下列有关判断不正确的是
)。下列有关判断不正确的是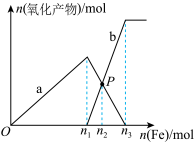
A.a表示 的关系曲线 的关系曲线 |
B. =0.75 =0.75 |
C.P点时,n(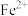 )=0.5625mol )=0.5625mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4g |
您最近一年使用:0次
2024-01-10更新
|
797次组卷
|
16卷引用:2011-2012学年山西省高三上学期第二次阶段性测试化学试卷
(已下线)2011-2012学年山西省高三上学期第二次阶段性测试化学试卷2016届浙江省杭州高级中学高三上学期月考(三)化学试卷【全国百强校】安徽省合肥市第六中学2018-2019学年高一下学期开学考试化学试题(已下线)2019年8月11日《每日一题》2020年高考一轮复习—— 每周一测(已下线)专题3.3 铁及其重要化合物(练)——2020年高考化学一轮复习讲练测人教版2019必修第二册 第五章 本章复习提升湖南省长沙市第一中学2019-2020学年高一上学期第二次阶段性检测(月考)化学试题辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题河南省商丘市第一高级中学2021-2022学年高一下学期期中考试化学试题陕西省西安中学 2023 届高三上学期第二次质量检测化学试题西安市第八十三中学2022-2023学年高一下学期第一次月考化学试题辽宁省重点高中沈阳市郊联体2023-2024学年高一上学期期末考试化学试题新疆乌鲁木齐市新疆生产建设兵团第二中学2023-2024学年高一上学期期末考试化学试卷 (已下线)热点02 氮及其化合物浙江省杭州市源清中学2023-2024学年高一上学期期末考试化学试题黑龙江省双鸭山市第一中学2023-2024学年高一下学期4月月考化学试题
名校
5 . 维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
,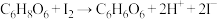 。
。
【实验用品】 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用___________ (填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。
①上述氧化还原滴定法应用___________ 作指示剂,滴定终点的现象为___________ 。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有___________ 。
(3)库仑滴定法:取(1)中配制好的待测溶液 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中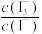 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到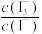 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为___________ 。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为___________ 。(用含 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为___________ 。这部分非电解生成的 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量___________ 。(填“偏大”或“偏小”)。
 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】
 ,
,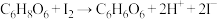 。
。【实验用品】
 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。【实验步骤】
(1)配制待测溶液:称取新鲜水果样品
 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(2)氧化还原滴定法:取(1)中配制好的待测溶液
 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。①上述氧化还原滴定法应用
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有
(3)库仑滴定法:取(1)中配制好的待测溶液
 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中
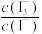 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到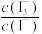 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
①库仑仪工作时电解池的阳极反应式为
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为
 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。③测定过程中,需控制电解质溶液
 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量
您最近一年使用:0次
2023-12-11更新
|
105次组卷
|
3卷引用:山西省朔州市怀仁市2023-2024学年高二上学期1月期末化学试题
名校
6 . 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。则下列说法中不正确的是(已知:还原性:I->Fe2+>Br-)
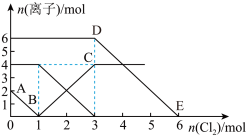

| A.DE线段的反应方程式:2Br-+Cl2=Br2+2Cl- |
| B.原混合溶液中FeBr2的物质的量为3mol |
| C.线段AB表示Fe2+被氯气氧化 |
| D.原溶液中:n(Fe2+):n (I-):n (Br-)=2:1:3 |
您最近一年使用:0次
2023-11-26更新
|
539次组卷
|
3卷引用:山西省实验中学2023-2024学年高一上学期期中考试化学试题
山西省实验中学2023-2024学年高一上学期期中考试化学试题山西省实验中学2023-2024学年高一上学期期中考试化学试题(已下线)寒假作业05 氯及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
名校
7 . 向一定量铁的氧化物 (铁只有+2、+3价)中,加入
(铁只有+2、+3价)中,加入 稀盐酸,恰好使固体完全溶解,再向所得溶液中通入标准状况下
稀盐酸,恰好使固体完全溶解,再向所得溶液中通入标准状况下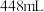 氯气,恰好能使溶液中的
氯气,恰好能使溶液中的 完全转化为
完全转化为 (发生的反应为
(发生的反应为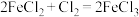 ),则
),则 为
为
 (铁只有+2、+3价)中,加入
(铁只有+2、+3价)中,加入 稀盐酸,恰好使固体完全溶解,再向所得溶液中通入标准状况下
稀盐酸,恰好使固体完全溶解,再向所得溶液中通入标准状况下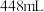 氯气,恰好能使溶液中的
氯气,恰好能使溶液中的 完全转化为
完全转化为 (发生的反应为
(发生的反应为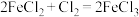 ),则
),则 为
为A. | B. | C.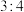 | D.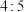 |
您最近一年使用:0次
2023-11-22更新
|
857次组卷
|
5卷引用:山西省部分学校2023-2024学年高一上学期11月期中联合考试化学试题
山西省部分学校2023-2024学年高一上学期11月期中联合考试化学试题(已下线)寒假作业08 金属材料-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)天津市第一中学2023-2024学年高一上学期月考(第三章单元测验1)化学试题安徽省六安第一中学2023-2024学年高一上学期期末考试化学试题江西省宜春市宜丰中学2023-2024学年高一上学期1月期末化学试题
名校
8 .  有高毒性,在溶液中以
有高毒性,在溶液中以 或
或 的形式存在,不同
的形式存在,不同 条件下两者可相互转化(
条件下两者可相互转化( )。常用还原法、微生物电化学法、沉淀法处理含
)。常用还原法、微生物电化学法、沉淀法处理含 的废水。
的废水。
(1)向废水中加入 或
或 等还原剂可将
等还原剂可将 还原为低毒性
还原为低毒性 ,再调节溶液
,再调节溶液 使
使 转化为
转化为 沉淀除去。
沉淀除去。
①酸性废水中 将
将 还原为
还原为 的离子方程式为
的离子方程式为___________ 。
②其他条件相同,在不改变所加铁屑总量的情况下,加入烟道灰(细小的活性炭),可增大 的去除率,其原因是
的去除率,其原因是___________ 。
(2)利用微生物电化学法可有效处理含有机物和 的酸性废水,其工作原理如图所示。
的酸性废水,其工作原理如图所示。
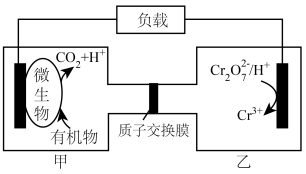
①若废水中的有机物是 ,则甲池中电极反应式为
,则甲池中电极反应式为___________ 。
②甲池产生 (标准状况)
(标准状况) 时,理论上乙池中
时,理论上乙池中 的物质的量减少
的物质的量减少___________ 。
(3)已知 易溶于水,
易溶于水, 难溶于水。利用沉淀法有效去除酸性废水中
难溶于水。利用沉淀法有效去除酸性废水中 的实验操作为
的实验操作为___________ 。
 有高毒性,在溶液中以
有高毒性,在溶液中以 或
或 的形式存在,不同
的形式存在,不同 条件下两者可相互转化(
条件下两者可相互转化( )。常用还原法、微生物电化学法、沉淀法处理含
)。常用还原法、微生物电化学法、沉淀法处理含 的废水。
的废水。(1)向废水中加入
 或
或 等还原剂可将
等还原剂可将 还原为低毒性
还原为低毒性 ,再调节溶液
,再调节溶液 使
使 转化为
转化为 沉淀除去。
沉淀除去。①酸性废水中
 将
将 还原为
还原为 的离子方程式为
的离子方程式为②其他条件相同,在不改变所加铁屑总量的情况下,加入烟道灰(细小的活性炭),可增大
 的去除率,其原因是
的去除率,其原因是(2)利用微生物电化学法可有效处理含有机物和
 的酸性废水,其工作原理如图所示。
的酸性废水,其工作原理如图所示。
①若废水中的有机物是
 ,则甲池中电极反应式为
,则甲池中电极反应式为②甲池产生
 (标准状况)
(标准状况) 时,理论上乙池中
时,理论上乙池中 的物质的量减少
的物质的量减少(3)已知
 易溶于水,
易溶于水, 难溶于水。利用沉淀法有效去除酸性废水中
难溶于水。利用沉淀法有效去除酸性废水中 的实验操作为
的实验操作为
您最近一年使用:0次
2023-11-19更新
|
288次组卷
|
3卷引用:山西省晋城市第一中学校2023-2024学年高二上学期第五次调研考试化学试题
9 . 氮元素在地球上含量丰富,氮及其化合物在工农业生产和生活中有着重要作用,氮氧化物也是主要的大气污染物。
(1)含有NO和 的工业尾气可以利用NaOH溶液吸收处理。主要反应为
的工业尾气可以利用NaOH溶液吸收处理。主要反应为 、
、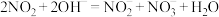 。
。
①下列措施不能提高尾气中NO和 去除率的有
去除率的有___________ (填标号)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气的过程中定期补加适量NaOH溶液
②若将2.24L(已换算成标准状况下的体积)由NO和 组成的混合气体通入
组成的混合气体通入 溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和
溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和 的物质的量之比为
的物质的量之比为___________ 。
(2)用NaClO溶液也可以吸收工业尾气中的NO。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 和
和 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高,其原因是___________ 。
(3)以亚硝酸钠( )溶液为研究对象,探究
)溶液为研究对象,探究 的性质。现取三份
的性质。现取三份 溶液,分别进行以下实验:
溶液,分别进行以下实验:
(1)含有NO和
 的工业尾气可以利用NaOH溶液吸收处理。主要反应为
的工业尾气可以利用NaOH溶液吸收处理。主要反应为 、
、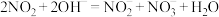 。
。①下列措施不能提高尾气中NO和
 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气的过程中定期补加适量NaOH溶液
②若将2.24L(已换算成标准状况下的体积)由NO和
 组成的混合气体通入
组成的混合气体通入 溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和
溶液中,充分反应(气体完全被吸收),吸收后的溶液经浓缩、结晶、过滤、洗涤、干燥后,得到晶体7.22g,则原混合气体中NO和 的物质的量之比为
的物质的量之比为(2)用NaClO溶液也可以吸收工业尾气中的NO。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
 和
和 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高,其原因是
(3)以亚硝酸钠(
 )溶液为研究对象,探究
)溶液为研究对象,探究 的性质。现取三份
的性质。现取三份 溶液,分别进行以下实验:
溶液,分别进行以下实验:
| 操作和现象 | 结论 |
| 实验1:滴加稀硫酸,产生红综色气体。 | 写出产生此现象的离子方程式:① | |
实验2:滴入 溶液,开始仍为紫红色,再向溶液中滴加稀硫酸后,紫色褪去。 溶液,开始仍为紫红色,再向溶液中滴加稀硫酸后,紫色褪去。 | 写出产生此观象的离子方程式:② | |
实验3:滴入5滴 溶液再加入 溶液再加入 溶液和足量HCl,振荡,产生白色沉淀。 溶液和足量HCl,振荡,产生白色沉淀。 | 可推断 ,具有③ ,具有③ |
您最近一年使用:0次
2023-11-15更新
|
163次组卷
|
2卷引用:山西省吕梁市联考2023-2024学年高三上学期阶段性测试化学试题
名校
10 . 38.4gCu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到 和
和 的混合溶液,反应过程及有关数据如图所示。
的混合溶液,反应过程及有关数据如图所示。
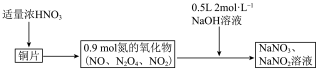
下列有关该过程的判断不正确的是
 和
和 的混合溶液,反应过程及有关数据如图所示。
的混合溶液,反应过程及有关数据如图所示。
下列有关该过程的判断不正确的是
A.0.9 mol混合气体中NO、 、 、 的物质的量分别是0.1 mol、0.7 mol、0.1 mol 的物质的量分别是0.1 mol、0.7 mol、0.1 mol |
B.生成0.2 mol  和0.8 mol 和0.8 mol  |
| C.若浓硝酸体积为200 mL,则其物质的量浓度为11 mol/L |
D.欲使上述0.9 mol氮的氧化物完全被水吸收,理论上至少需要通入标准状况下的 体积为6.72 L 体积为6.72 L |
您最近一年使用:0次




