1 . 向200mL稀 与稀
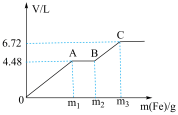
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
 与稀
与稀 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况下)之间的关系如图所示,且曲线中每一段只对应一个反应。下列说法错误的是
A.混合溶液中 的物质的量浓度为1 mol/L 的物质的量浓度为1 mol/L |
| B.若向铜粉中加入100mL上述混合溶液,最多能溶解19.2g铜 |
C.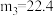 |
D.每一阶段反应转移电子数目之比为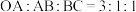 |
您最近一年使用:0次
名校
解题方法
2 . 白磷(P4)有毒,实验时若皮肤接触到白磷,应立即用稀CuSO4溶液清洗,发生两个反应:
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
| A.在反应①和②中,P4只作还原剂 |
| B.反应①中氧化产物与还原产物的个数之比为5∶2 |
| C.皮肤接触到白磷,用稀CuSO4溶液清洗后,应再使用NaOH溶液清洗 |
| D.若P4反应完全且转化为H3PO4的转化率是80%,理论上反应①和②消耗P4的个数之比为14∶11 |
您最近一年使用:0次
2022-11-09更新
|
1313次组卷
|
4卷引用:山西省实验中学2023-2024学年高一上学期第一次月考化学试题
名校
解题方法
3 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
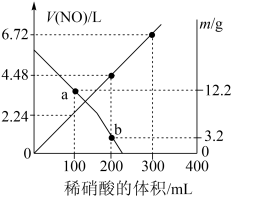

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3563次组卷
|
14卷引用:山西省长治市2021-2022学年高一下学期期末联合考化学试题
山西省长治市2021-2022学年高一下学期期末联合考化学试题湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
名校
4 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况)NO2与NO的混合气体,这些气体与一定体积的O2混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入100mL4mol·L-1NaOH溶液,Cu2+恰好沉淀完全。下列说法正确的是
| A.此反应过程中转移了0.5mol的电子 |
| B.消耗氧气的体积为1.12L(标准状况) |
| C.参加反应的HNO3是0.45mol |
| D.混合气体中含2.24L(标准状况)NO |
您最近一年使用:0次
2020-07-22更新
|
2939次组卷
|
11卷引用:山西省实验中学2020-2021学年高一下学期第一次月考化学试题
山西省实验中学2020-2021学年高一下学期第一次月考化学试题辽宁省大连市旅顺口区2019-2020学年高一下学期期末考试化学试题辽宁省大连市2019-2020学年高一下学期期末考试化学试题重庆市缙云教育联盟2020-2021学年高一9月月考化学试题辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题辽宁省部分中学2019-2020高一下学期期末考试化学试题黑龙江省鹤岗市第一中学2021-2022学年高一下学期4月月考化学试题云南省曲靖市第一中学2022-2023学年高一下学期期末考试化学试题安徽省铜陵市第一中学2022-2023 学年高一下学期期中教学质量检测化学试题云南省开远市第一中学校2022-2023学年高一下学期期末考试化学试题重庆市万州第二高级中学2023-2024学年高一下学期3月月考试题 化学试题
名校
5 . 从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________ , 被氧化的N原子的物质的量为__________ 。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________ 、_________ 、_________ 。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为
您最近一年使用:0次
2017-12-06更新
|
1325次组卷
|
2卷引用:山西大学附属中学2017-2018学年高一上学期11月期中考试化学试题
名校
6 . 将一定量的Cl2通入体积为40mL、浓度为7.5mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO3-物质的量0.03mol,下列说法不正确的是
| A.该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3—+5H2O |
| B.该反应中,氧化剂与还原剂物质的量之比为5:3 |
| C.上述苛性钾溶液中含有0.3mol的KOH |
| D.反应后生成的ClO-和ClO3-两种离子在一定条件下均有氧化性 |
您最近一年使用:0次
2016-12-09更新
|
2571次组卷
|
5卷引用:山西省实验中学2018届高三上学期第一次月考化学试题
名校
7 . 在100mL密度为1.2g/mL稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属完全溶解(假设还原产物只有NO),向反应后溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀质量比原金属质量增加5.1g。则下列叙述不正确的是
| A.当金属全部溶解时收集到NO气体的体积为2.24L(标准状况) |
| B.当生成沉淀的量最多时,消耗NaOH溶液体积最小为100mL |
| C.原稀硝酸的物质的量浓度一定为4 mol/L |
| D.参加反应金属总质量(m)为9.6g>m>3.6g |
您最近一年使用:0次
2016-12-09更新
|
2942次组卷
|
11卷引用:2015届山西省临汾一中等四校高三第二次联考化学试卷
2015届山西省临汾一中等四校高三第二次联考化学试卷2015届陕西省西工大附中高三下学期三模考试化学试卷2016届湖南省长沙市明德中学高三上学期第三次月考化学试卷2016届湖南省益阳市箴言中学高三上学期第三次模拟化学试卷2016届河北省保定市高三上学期摸底考试化学试卷2015-2016学年浙江省宁波市北仑中学高二下学期期中考试化学试卷湖南省长沙市明德中学2016届高三上学期第三次月考化学试题湖南省长沙市一中2019-2020学年高一上学期期末考试化学试题黑龙江省大庆实验中学2019-2020学年高一下学期第一次阶段考试化学试题四川省乐山市第四中学2019-2020学年高一下学期期中考试化学试题陕西西北工业大学附属中学2022-2023学年高一下学期期中考试化学试题



