1 . (I)铁是人类较早使用的金属之一。运用所学知识,回答下列问题。
(1)鉴别 胶体和
胶体和 溶液的方法是
溶液的方法是__________ 。
(2)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式__________ ,现象为__________ 。
(3)绿矾( )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
①为防止 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量___________ 。
②甲同学取 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为__________ 。乙同学认为甲同学的实验不够严谨,该组同学在 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是__________ 。
(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有 和
和 ,且
,且 。
。
(4)从废液中可回收铜,并获得 溶液,设计如下方案:
溶液,设计如下方案:___________ (填物质名称)。
②物质X为___________ 。
A. B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。
①对反应后的溶液分析错误的是___________ 。
A.溶液中一定含有
B.若有固体剩余,则固体中一定含有铁
C.若溶液中有 ,则可能有固体析出
,则可能有固体析出
D.溶液若有 剩余,则一定没有固体析出
剩余,则一定没有固体析出
②若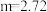 ,则充分反应后得到
,则充分反应后得到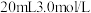 氯化亚铁溶液和
氯化亚铁溶液和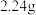 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为___________ 。
(1)鉴别
 胶体和
胶体和 溶液的方法是
溶液的方法是(2)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色沉淀
,溶液中白色沉淀 更易被
更易被 氧化,请写出反应的化学方程式
氧化,请写出反应的化学方程式(3)绿矾(
 )是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。
)是治疗缺铁性贫血药品的主要成分,也是中学化学一种常见的化学试剂。亚铁盐在空气中容易被氧化而变质。①为防止
 溶液变质,应在溶液中加入少量
溶液变质,应在溶液中加入少量②甲同学取
 稀硫酸酸化
稀硫酸酸化 溶液,加入几滴双氧水后,再加入1滴
溶液,加入几滴双氧水后,再加入1滴 溶液,溶液变红,说明
溶液,溶液变红,说明 可将
可将 氧化。
氧化。 溶液与双氧水反应的离子方程式为
溶液与双氧水反应的离子方程式为 用稀
用稀 酸化的
酸化的 溶液中先加入
溶液中先加入 煤油,再于液面下依次加入几滴双氧水和1滴
煤油,再于液面下依次加入几滴双氧水和1滴 溶液,溶液变红,煤油的作用是
溶液,溶液变红,煤油的作用是(II)氯化铁溶液可用于腐蚀印刷电路板上的铜,某腐蚀后的废液中含有
 和
和 ,且
,且 。
。(4)从废液中可回收铜,并获得
 溶液,设计如下方案:
溶液,设计如下方案: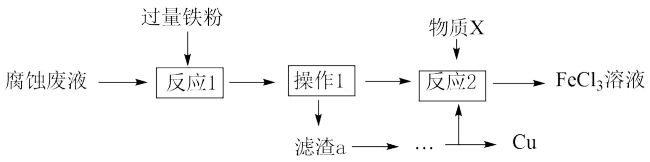
②物质X为
A.
 B.酸性
B.酸性 溶液 C.
溶液 C.
(5)取该废液
 并加入
并加入 铁粉,充分反应。
铁粉,充分反应。①对反应后的溶液分析错误的是
A.溶液中一定含有

B.若有固体剩余,则固体中一定含有铁
C.若溶液中有
 ,则可能有固体析出
,则可能有固体析出D.溶液若有
 剩余,则一定没有固体析出
剩余,则一定没有固体析出②若
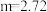 ,则充分反应后得到
,则充分反应后得到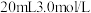 氯化亚铁溶液和
氯化亚铁溶液和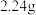 固体混合物。则原废液中
固体混合物。则原废液中 的物质的量浓度为
的物质的量浓度为
您最近一年使用:0次
解题方法
2 . 在工业生产中要制取某种物质,除了要考虑反应进行的可能性,还要考虑原料来源、成本高低和设备要求等因素,以选取最适当的方法。例如,工业上制取NaOH(a)一般不采用Na2O(b)与H2O(c)反应的方法(Na2O作为原料,来源少、成本高),而主要采用电解饱和食盐水的方法,过去也曾采用Na2CO3(d)与Ca(OH)2(e)反应的方法。回答下列问题:
(1)Na与水反应的离子方程式为______ 。
(2)电解饱和食盐水的化学方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
①该反应中的还原剂为______ 填化学式,下同),被氧化的物质为______ 。
②用双线桥法表示该反应中电子转移的方向和数目:______ 。
③每生成0.2gH2,同时生成Cl2的质量为______ g。
(3)d和e反应可制得a:将Na2CO3溶液加入澄清石灰水中,发生反应的离子方程式为______ 。
(1)Na与水反应的离子方程式为
(2)电解饱和食盐水的化学方程式为2NaCl+2H2O
 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。①该反应中的还原剂为
②用双线桥法表示该反应中电子转移的方向和数目:
③每生成0.2gH2,同时生成Cl2的质量为
(3)d和e反应可制得a:将Na2CO3溶液加入澄清石灰水中,发生反应的离子方程式为
您最近一年使用:0次
3 . 回答下列问题:
(1)①H2+CuO Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有______ (填序号)。
(2)用双线桥法表示下述反应的电子转移的方向和数目______ 。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为______ 。
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)______ 。
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)______ 。
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。______ 。
(1)①H2+CuO
 Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有(2)用双线桥法表示下述反应的电子转移的方向和数目
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。
您最近一年使用:0次
4 .  (
( 为
为 价)是重要的储氢材料,可与水发生反应:
价)是重要的储氢材料,可与水发生反应: 。下列说法中正确的是
。下列说法中正确的是
 (
( 为
为 价)是重要的储氢材料,可与水发生反应:
价)是重要的储氢材料,可与水发生反应: 。下列说法中正确的是
。下列说法中正确的是| A.该反应属于复分解反应 | B.还原产物与氧化产物的个数比为 |
C. 既是氧化剂又是还原剂 既是氧化剂又是还原剂 | D.反应中每生成1个氢分子,则转移1个电子 |
您最近一年使用:0次
5 . 高铁酸钠(Na2FeO4)具有强氧化性,是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的原理可用离子方程式(未配平)表示为:ClO-+Fe3++X FeO
FeO +Cl-+H2O,下列判断正确的是
+Cl-+H2O,下列判断正确的是
 FeO
FeO +Cl-+H2O,下列判断正确的是
+Cl-+H2O,下列判断正确的是| A.X为H+ | B.氧化剂与还原剂的物质的量之比为3:2 |
| C.反应中ClO-被氧化 | D.FeO 是还原产物 是还原产物 |
您最近一年使用:0次
名校
解题方法
6 . 实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl NaCl+N2↑+2H2O,下列关于该反应的说法正确的是
NaCl+N2↑+2H2O,下列关于该反应的说法正确的是
 NaCl+N2↑+2H2O,下列关于该反应的说法正确的是
NaCl+N2↑+2H2O,下列关于该反应的说法正确的是| A.NaNO2是还原剂 | B.每生成1个N2分子时,转移电子的个数为6 |
| C.NH4Cl中的氮元素被还原 | D.N2既是氧化产物,又是还原产物 |
您最近一年使用:0次
名校
解题方法
7 . 已知反应:6HCl(浓)+KClO3=KCl+3Cl2↑+3H2O,下列说法正确的是
| A.浓盐酸全部表现还原性 |
| B.生成3molCl2转移的电子数为6NA |
| C.氧化产物和还原产物的个数比为5:1 |
| D.可以利用氯气的漂白性漂白发黄的衣服 |
您最近一年使用:0次
8 . 对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
| A.FeS2只作还原剂 |
| B.每生成1mol Cu2S转移的电子数14mol |
| C.被氧化的硫与被还原的铜的物质的量比为3∶14 |
D.1mol硫酸铜可以氧化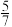 mol的硫 mol的硫 |
您最近一年使用:0次
名校
解题方法
9 . 氧化还原反应在工农业生产、日常生活中具有广泛用途。
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中不易吸收的Fe3+转变为易吸收的Fe2+,故维生素C具有___________ 性(填“氧化”或“还原”,下同),在反应过程中维生素C发生___________ 反应。
(2)黑火药是我国古代的四大发明之一,爆炸时的反应为:
①配平上述反应。________
②该反应中还原剂是___________ ,还原产物是___________ ,生成1molN2转移电子的物质的量为___________ 。
(3)高温下铝粉和氧化铁的反应可以用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后将钢轨牢牢地焊接在一起。该反应的化学方程式为___________ ,其中被还原的物质是___________ (填化学式)。
(1)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中不易吸收的Fe3+转变为易吸收的Fe2+,故维生素C具有
(2)黑火药是我国古代的四大发明之一,爆炸时的反应为:

①配平上述反应。
②该反应中还原剂是
(3)高温下铝粉和氧化铁的反应可以用来焊接钢轨。其原理是:该反应放出大量的热,置换出的铁呈熔融态。熔融的铁流入钢轨的裂缝里,冷却后将钢轨牢牢地焊接在一起。该反应的化学方程式为
您最近一年使用:0次
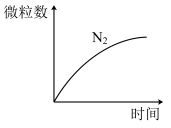
10 . 某离子反应方程式中的微粒有 、
、 、
、 、
、 、
、 、
、 ,反应发生时
,反应发生时 的数目随时间的变化曲线如图所示,下列说法正确的是
的数目随时间的变化曲线如图所示,下列说法正确的是
 、
、 、
、 、
、 、
、 、
、 ,反应发生时
,反应发生时 的数目随时间的变化曲线如图所示,下列说法正确的是
的数目随时间的变化曲线如图所示,下列说法正确的是
A. 发生还原反应 发生还原反应 |
B.该反应中 为氧化产物 为氧化产物 |
| C.反应后溶液的碱性减弱 |
| D.每消耗1个还原剂微粒,转移6个电子 |
您最近一年使用:0次
2024-01-22更新
|
66次组卷
|
2卷引用:重庆市西南大学附中2023-2024学年高一上学期定时检测(二)化学试题



