1 . 我国长征系列运载火箭的第一、第二级发动机,使用的燃料是偏二甲肼( )和四氧化二氮(
)和四氧化二氮( ),燃烧产物绿色无污染。燃烧的化学反应方程式:
),燃烧产物绿色无污染。燃烧的化学反应方程式: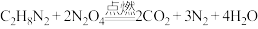 。
。
(1)上述反应中,氧化剂是___________ ;若有30g的 参加反应,需要
参加反应,需要 的物质的量为
的物质的量为___________ mol。
(2) 为
为___________ 色气体。若用 代替
代替 也能与
也能与 发生类似的反应,写出该反应的化学方程式:
发生类似的反应,写出该反应的化学方程式:___________ 。
 )和四氧化二氮(
)和四氧化二氮( ),燃烧产物绿色无污染。燃烧的化学反应方程式:
),燃烧产物绿色无污染。燃烧的化学反应方程式: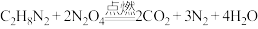 。
。(1)上述反应中,氧化剂是
 参加反应,需要
参加反应,需要 的物质的量为
的物质的量为(2)
 为
为 代替
代替 也能与
也能与 发生类似的反应,写出该反应的化学方程式:
发生类似的反应,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 根据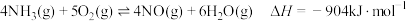 ,下列说法
,下列说法不正确 的是
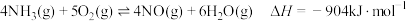 ,下列说法
,下列说法A.反应的 |
B.有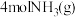 和 和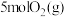 在反应器中充分反应,能放出 在反应器中充分反应,能放出 热量 热量 |
C.断裂1mol 键的同时,断裂 键的同时,断裂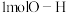 键,说明该反应达到平衡状态 键,说明该反应达到平衡状态 |
D.每消耗 转移电子的数目约为 转移电子的数目约为 |
您最近一年使用:0次
3 . 已知A为淡黄色固体,C是无色无味气体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,J为84消毒液有效成分,F为红褐色沉淀。
注:磁性氧化铁中含有Fe3+、Fe2+,其个数之比为2∶1。
I.请回答:
(1)A中阴阳离子个数比是___________ 。
(2)写出D→E先后加入足量盐酸、再与足量M反应发生的离子方程式___________ 、___________ 。
II.高铁酸钠(Na2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于饮用水的处理,可由J、B、F反应制得。
(3)Na2FeO4属于___________ (填字母)。
A.钠盐 B.酸式盐 C.铁盐 D.强电解质 E.弱电解质
(4)高铁酸钠溶液杀菌后可得到氢氧化铁胶体,进而起到净水作用,当有0.5mol Na2FeO4参与杀菌消毒并完全反应时,转移的电子数为___________ 。
(5)下列关于氢氧化铁胶体的说法中正确的是___________ (填字母)。
A.氢氧化铁胶体带正电荷,可以发生电泳现象
B.向氢氧化铁胶体中逐滴滴加稀硫酸,可观察到先出现红褐色沉淀,后沉淀消失
C.实验室制备氢氧化铁胶体的化学方程式为:FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
D.1mol Na2FeO4完全转化为Fe(OH)3胶体后,含有的胶体粒子数目为NA
E.氢氧化铁胶粒不可以通过滤纸,但可通过半透膜,此为渗析的原理
注:磁性氧化铁中含有Fe3+、Fe2+,其个数之比为2∶1。
I.请回答:
(1)A中阴阳离子个数比是
(2)写出D→E先后加入足量盐酸、再与足量M反应发生的离子方程式
II.高铁酸钠(Na2FeO4)是一种高效多功能的新型非氯绿色消毒剂,主要用于饮用水的处理,可由J、B、F反应制得。
(3)Na2FeO4属于
A.钠盐 B.酸式盐 C.铁盐 D.强电解质 E.弱电解质
(4)高铁酸钠溶液杀菌后可得到氢氧化铁胶体,进而起到净水作用,当有0.5mol Na2FeO4参与杀菌消毒并完全反应时,转移的电子数为
(5)下列关于氢氧化铁胶体的说法中正确的是
A.氢氧化铁胶体带正电荷,可以发生电泳现象
B.向氢氧化铁胶体中逐滴滴加稀硫酸,可观察到先出现红褐色沉淀,后沉淀消失
C.实验室制备氢氧化铁胶体的化学方程式为:FeCl3+3H2O
 Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HClD.1mol Na2FeO4完全转化为Fe(OH)3胶体后,含有的胶体粒子数目为NA
E.氢氧化铁胶粒不可以通过滤纸,但可通过半透膜,此为渗析的原理
您最近一年使用:0次
解题方法
4 . 利用烟气中的SO2可回收废水中的I-,实现碘单质的再生,其反应原理如图所示。下列说法正确的是
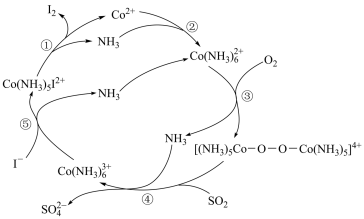

A.1mol SO 中含有电子的数目为48NA 中含有电子的数目为48NA |
| B.NH3溶于水能导电,NH3属于电解质 |
| C.反应①~⑤中均属于氧化还原反应 |
D.总反应离子方程式为: |
您最近一年使用:0次
5 . 反应8NH33Cl2N26NH4Cl,下列说法正确的是
| A.Cl2 发生氧化反应 |
| B.NH3 既是氧化剂又是还原剂 |
| C.每生成22.4L N2,转移的电子数为6NA |
| D.被氧化的NH3与被还原的Cl2的化学计量数之比为 2∶3 |
您最近一年使用:0次
解题方法
6 .  是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:

(1) 的名称是
的名称是___________ ,若A是一种纯净物,则A的化学式为___________ 。
(2)“还原1”中应充分搅拌,好处是___________ ,反应中消耗的氧化剂与还原剂物质的量之比为___________ ,“还原2”反应的离子方程式为___________ 。
 是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
(1)
 的名称是
的名称是(2)“还原1”中应充分搅拌,好处是
您最近一年使用:0次
7 . 固体化合物X由四种元素组成,某学习小组开展如下探究实验。下列说法错误的是
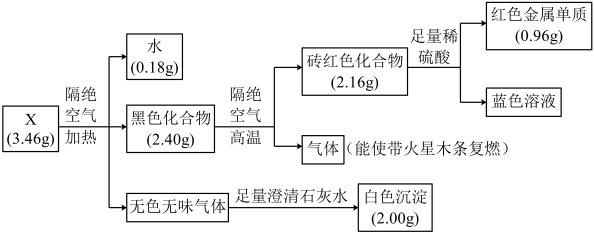
| A.固体化合物X中的金属元素位于周期表第四周期第ⅠB族 |
| B.固体化合物X为Cu2(OH)2CO3 |
| C.黑色化合物隔绝空气分解的过程中,生成1 mol砖红色化合物,转移2 mol电子 |
| D.蓝色溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可制得胆矾晶体 |
您最近一年使用:0次
8 . I.物质的量的计算与氧化还原反应在日常生活和工业生产中有重要应用。
(1)含2.6个电子的Al的质量为___________ g。
(2)32gCH3OH完全燃烧产生标准状况下的CO2的体积为___________ L。
(3)等质量的CO2和H2O含有的原子数之比为___________ ,氧原子数之比为___________ 。
Ⅱ.K2Cr2O7是火柴工业用作制造火柴头的原料之一
已知反应:
(4)该反应中被氧化的元素是___________ (填写化学式,下同),还原产物是___________ 。
(5)该反应中氧化剂与还原剂的微粒个数比为___________ 。
Ⅲ.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准
……
(6)K2FeO4中铁元素的化合价为___________ 。
(7)下列关于K2FeO4的说法中,正确的是___________ 。
a.是强氧化性的盐 b.固体保存需要防潮
b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(8)工业制备K2FeO4需要在碱性环境下进行,现提供反应体系中7种物质,Fe(NO3)3、Cl2、H2O、KOH、K2FeO4、KCl、KNO3
①将K2FeO4与水反应的化学方程式补充完整并配平:__________
___________ +___________
+___________ =___________
=___________ (胶体)+___________+___________KOH
(胶体)+___________+___________KOH
②该反应消耗1mol K2FeO4时,转移的电子数为___________ 个。
(9)消毒净化198L水,按照卫生标准投入K2FeO4,则K2FeO4与水充分反应后产生的KOH质量为___________ 。
(1)含2.6个电子的Al的质量为
(2)32gCH3OH完全燃烧产生标准状况下的CO2的体积为
(3)等质量的CO2和H2O含有的原子数之比为
Ⅱ.K2Cr2O7是火柴工业用作制造火柴头的原料之一
已知反应:

(4)该反应中被氧化的元素是
(5)该反应中氧化剂与还原剂的微粒个数比为
Ⅲ.阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
【用量】消毒净化1L水投放5mgK2FeO4即可达到卫生标准
……
(6)K2FeO4中铁元素的化合价为
(7)下列关于K2FeO4的说法中,正确的是
a.是强氧化性的盐
 b.固体保存需要防潮
b.固体保存需要防潮c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(8)工业制备K2FeO4需要在碱性环境下进行,现提供反应体系中7种物质,Fe(NO3)3、Cl2、H2O、KOH、K2FeO4、KCl、KNO3
①将K2FeO4与水反应的化学方程式补充完整并配平:
___________
 +___________
+___________ =___________
=___________ (胶体)+___________+___________KOH
(胶体)+___________+___________KOH②该反应消耗1mol K2FeO4时,转移的电子数为
(9)消毒净化198L水,按照卫生标准投入K2FeO4,则K2FeO4与水充分反应后产生的KOH质量为
您最近一年使用:0次
9 . 对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4(FeS2中S为-1价),正确 的是
| A.FeS2既不是氧化剂,又不是还原剂 |
| B.Cu2S既是氧化产物,又是还原产物 |
C.被CuSO4氧化的硫占全部被氧化的硫的 |
| D.被氧化的硫和被还原的硫个数比是7∶3 |
您最近一年使用:0次
名校
10 . 建筑工地常用的 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:__NaNO2+__HI →__NO↑+__I2+__NaI+ __H2O
能发生如下反应:__NaNO2+__HI →__NO↑+__I2+__NaI+ __H2O
(1)配平上述化学方程式,并用双线桥表示电子转移情况____ 。
(2)上述反应的氧化剂是____ ;若有1mol的还原剂被氧化,则反应中转移电子的数目是_______ 。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别 和
和 ,可选用的物质有:①水、②淀粉-碘化钾试纸、③淀粉、④白酒、⑤食醋,选取上述物质进行实验,下列组合合适的是______(填字母)。
,可选用的物质有:①水、②淀粉-碘化钾试纸、③淀粉、④白酒、⑤食醋,选取上述物质进行实验,下列组合合适的是______(填字母)。
(4)某厂废液中,含有2%~5%的 ,直接排放会造成污染,使用
,直接排放会造成污染,使用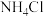 处理,能使
处理,能使 转化为不引起二次污染的
转化为不引起二次污染的 ,反应的化学方程式为
,反应的化学方程式为______ 。
(5)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。ClO2处理含CN-废水的离子方程式为______ 。
 因外观和食盐相似,又有咸味,容易使人误食中毒。已知
因外观和食盐相似,又有咸味,容易使人误食中毒。已知 能发生如下反应:__NaNO2+__HI →__NO↑+__I2+__NaI+ __H2O
能发生如下反应:__NaNO2+__HI →__NO↑+__I2+__NaI+ __H2O(1)配平上述化学方程式,并用双线桥表示电子转移情况
(2)上述反应的氧化剂是
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别
 和
和 ,可选用的物质有:①水、②淀粉-碘化钾试纸、③淀粉、④白酒、⑤食醋,选取上述物质进行实验,下列组合合适的是______(填字母)。
,可选用的物质有:①水、②淀粉-碘化钾试纸、③淀粉、④白酒、⑤食醋,选取上述物质进行实验,下列组合合适的是______(填字母)。| A.③⑤ | B.②④ | C.②⑤ | D.①②③⑤ |
 ,直接排放会造成污染,使用
,直接排放会造成污染,使用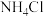 处理,能使
处理,能使 转化为不引起二次污染的
转化为不引起二次污染的 ,反应的化学方程式为
,反应的化学方程式为(5)以过氧化氢作还原剂,在硫酸介质中还原NaClO3制备ClO2,并将制得的ClO2处理含CN-废水。ClO2处理含CN-废水的离子方程式为
您最近一年使用:0次



