1 . 二硫化钼(MoS2,其中Mo的化合价为+4)被誉为“固体润滑剂之王”,利用低品质的辉钼矿(含MoS2、SiO2以及CuFeS2等杂质)制备高纯二硫化钼的一种生产工艺如下:
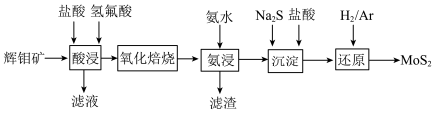
回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为___________ 。
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为________ 。
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是_________ ,“氨浸”后生成( NH4)2MoO4反应的化学方程式为___________ 。
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为_________________ 。
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数 为
为__________ 。
(6)钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为____________ [忽略溶液体积变化。已知:259℃,Ksp( BaMoO4)=4.0×10-8,Ksp(BaSO4)=1.1×10-10]。

回答下列问题:
(1)“酸浸”中加入氢氟酸是为了除去杂质SiO2,该反应的化学方程式为
(2)在“氧化焙烧”过程中主要是将MoS2转化为MoO3,在该反应中氧化剂与还原剂的物质的量之比为
(3)若氧化焙烧产物产生烧结现象,在“氨浸”前还需进行粉碎处理,其目的是
(4)向“氨浸”后的滤液中加入Na2S后,钼酸铵转化为硫代钼酸铵[(NH4)2MoS4],加入盐酸后,(NH4)2MoS4与盐酸反应生成MoS3沉淀,沉淀反应的离子方程式为
(5)高纯MoS2中仍然会存在极微量的非整比晶体MoS2.8等杂质,在该杂质中为保持电中性,Mo元素有+4、+6两种价态,则MoS2中Mo4+所占Mo元素的物质的量分数
 为
为(6)钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统金属缓蚀剂,可以由MoS2制备。在制备过程中需加入Ba(OH)2固体除去SO42-,若溶液中c(MoO42-)=0.4 mol/L,c(SO42-)=0. 05 mol/L,常温下,当BaMoO4即将开始沉淀时,SO42-的去除率为
您最近一年使用:0次
2019-12-06更新
|
562次组卷
|
8卷引用:四川省南充高级中学2020届高三2月线上月考化学试题
名校
解题方法
2 . 氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是___ 。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是___ (填元素名称),氧化剂是___ (填化学式)。
②配平该方程式:__ NH3+__ Cl2—__ N2+__ HCl
③根据上述反应,工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是___ ,产生该现象的反应方程式为___ 。
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为___ 。
②反应II属于___ 反应。(填四种基本反应类型之一)。
③若要制得a个氯气分子,则整个反应中转移电子的个数为___ 个。
(1)下列表述中没有氧化还原反应发生的是
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2—N2+HCl
①该反应中被氧化的元素是
②配平该方程式:
③根据上述反应,工业生产中常用喷洒氨水的方法来检查是否有Cl2泄漏,若Cl2有泄漏,可以观察到的现象是
(3)“地康法”制氯气的反应原理图示如下:

①反应I的化学方程式为
②反应II属于
③若要制得a个氯气分子,则整个反应中转移电子的个数为
您最近一年使用:0次
2019-12-05更新
|
128次组卷
|
2卷引用:四川省宜宾市第四中学校2022-2023学年高一上学期期中考试化学试题
名校
解题方法
3 . 3.2g铜与过量硝酸(8mol·L-1、30mL)充分反应,硝酸的还原产物为二氧化氮和一氧化氮,反应后溶液中含amol氢离子,则此时溶液中所含硝酸根离子的物质的量为( )
| A.(0.2+a)mol | B.(0.1+a)mol |
| C.(0.05+a)mol | D.amol |
您最近一年使用:0次
2019-12-05更新
|
1314次组卷
|
24卷引用:四川省仁寿第一中学校南校区2019-2020学年高一下学期开学考试化学试题
四川省仁寿第一中学校南校区2019-2020学年高一下学期开学考试化学试题(已下线)2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(已下线)2013届福建省清流一中高三第三阶段考试化学试卷2014-2015海南省海南中学高一上学期期末化学试卷2016届甘肃会宁第一中学高三上第三次月考理化学试卷2015-2016学年山东省淄博市高青一中高一下4月月考化学试卷2015-2016学年山东省淄博市高青一中高一4月月考化学试卷2015-2016学年内蒙古杭锦后旗奋斗中学高一下期中化学卷人教版化学必修一.4.4氨 硝酸 硫酸同步测试卷浙江省台州市书生中学2019-2020学年高二年级上学期第一次月考化学试题鲁科版必修一2019—2020学年第三章检测试题云南省昭通市彝良县一中2019—2020学年高一上学期期末考试化学试题2020年春季鲁教版高中化学必修1第3章《自然界中的元素》测试卷2020届高三化学无机化学二轮专题复习——铜的性质【选择精编26题】广西壮族自治区南宁市第二十六中学2019-2020学年高一下学期3月线上考试化学试题重庆市黔江新华中学校2019-2020高一下学期期中考试化学试题(已下线)考点16 常见非金属元素单质及其重要化合物4——氮-2020年【衔接教材·暑假作业】新高三一轮复习化学(已下线)第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)湖北省武汉市外国语学校2019-2020学年高一下学期期中考试化学试题河北省张家口市宣化第一中学2020-2021学年高一下学期期中考试化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期期中考试化学试题北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷山西省大同市第一中学2022-2023学年高一下学期3月考试化学试题 吉林省实验中学2023-2024学年高一上学期12月期中化学试题
解题方法
4 . Ⅰ.已知铜在常温下能被稀HNO3溶解。反应方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO ↑+4H2O
(1)请将上述反应改成离子方程式____ 。
(2)用双线桥法表示电子得失的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。___
(3若生成896mL的NO(标准状况下),则该过程中转移的电子数目是___ 。
(4)氧化剂与氧化产物的物质的量比为___ 。
Ⅱ.某反应体系有反应物和生成物共7种物质:C、H2SO4、K2CrO4、K2SO4、CO2、Cr2(SO4)3和H2O。已知该反应中发生如下过程:C→CO2。该反应的化学方程式:___ 。
(1)请将上述反应改成离子方程式
(2)用双线桥法表示电子得失的方向和数目:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。
(3若生成896mL的NO(标准状况下),则该过程中转移的电子数目是
(4)氧化剂与氧化产物的物质的量比为
Ⅱ.某反应体系有反应物和生成物共7种物质:C、H2SO4、K2CrO4、K2SO4、CO2、Cr2(SO4)3和H2O。已知该反应中发生如下过程:C→CO2。该反应的化学方程式:
您最近一年使用:0次
名校
5 . ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 =2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法正确的是( )
| A.KClO3在反应中得到电子 | B.ClO2是氧化产物 |
| C.H2C2O4在反应中被还原 | D.1mol KClO3参加反应有2 mol电子转移 |
您最近一年使用:0次
2019-12-02更新
|
1826次组卷
|
74卷引用:四川省成都市蒲江县蒲江中学2020-2021学年高二上学期开学考试化学试题
四川省成都市蒲江县蒲江中学2020-2021学年高二上学期开学考试化学试题(已下线)四川省南江中学2022-2023学年高二上学期10月诊断月考化学试题(已下线)2010年江西省修水一中高三上学期第一次月考化学试题(已下线)2010年广东省广州市白云中学高一上学期第二次月考化学试卷(已下线)2011-2012年黑龙江哈九中高一上学期期中考试化学试卷(已下线)2012届湖南省醴陵四中高三上学期期中考试化学试卷(已下线)2011-2012学年吉林省长春二中高一上学期期末考试化学试卷(已下线)2011-2012学年贵州省遵义四中高一上学期期末检测化学试卷(已下线)2012-2013学年辽宁朝阳县柳城高级中学高一上学期期末考试化学试卷(已下线)2012届西北师大附中高三第一学期期中考试化学试卷(已下线)2013-2014学年福建省长乐第一中学高一上学期第二次月考化学试卷(已下线)2015届黑龙江省双鸭山市第一中学高一上学期期中考试化学试卷(已下线)2014秋广东省揭阳市一中高二第一学期期中考试化学试卷2014-2015湖南省浏阳一中等三校高一12月联考化学试卷2014-2015学年湖北省襄阳市四校高一上学期期中联考化学试卷2014-2015山西省忻州市第一中学高一上学期期末考试化学试卷2015-2016学年黑龙江哈尔滨六中高一上期中测试化学试卷2015-2016河北石家庄第一中学高一上期中考试化学试卷2015-2016学年浙江省绍兴一中高一上期中测试化学试卷陕西省咸阳市西藏民族学院附属中学2015-2016学年高一上期末化学卷2015-2016学年宁夏六盘山高级中学高一上学期期末化学试卷2015-2016学年江苏省徐州市沛县中学高二下第二次质量检测化学试卷2016-2017学年河北省石家庄市一中高一上期中化学试卷2017届内蒙古准格尔旗世纪中学高三上月考二化学卷2016-2017陕西西安长安区一中重点班高一12月考化学卷2016-2017学年黑龙江哈尔滨六中高一上期末化学卷2016-2017学年江苏省启东中学高一下学期第一次月考化学试卷山东省淄博市第七中学2016-2017学年高一6月月考化学试题山东省平阴市第二中学2016-2017高一下学期(6月)月调研化学试卷内蒙古杭锦后旗奋斗中学2017-2018学年高一上学期第二次月考化学试题湖北省黄冈市麻城二中2017-2018学年高一第二次(12月)月考化学试题河南省洛阳名校2017-2018学年高一上学期第二次联考化学试题湖南省醴陵市第一中学2017-2018学年高一上学期第二次月考(12月)化学试题黑龙江省哈尔滨市第六中学2017-2018学年高一上学期期末考试化学试题内蒙古杭锦后旗奋斗中学2017-2018学年高一上学期期末考试化学试题内蒙古北京八中乌兰察布分校2017-2018学年高一上学期期末考试化学试题【全国市级联考】湖南省五市十校2018年上学期高一期中考试化学试题【全国校级联考】辽宁省葫芦岛市普通高中2017-2018学年高一教学质量监测(期末)化学试题云南省沾益县第四中学2017-2018学年高一上学期期末考试化学试题山东省微山县第二中学2018-2019学年高一上学期第三学段教学质量监测化学试题河南省商城县上石桥高级中学2018-2019学年高二上学期12月月考化学试题甘肃省武威市第五中学2018-2019学年高一上学期期末考试化学试题【全国百强校】黑龙江省大庆实验中学2018-2019学年高一上学期期末考试化学试题【全国百强校】湖北省沙市中学2018-2019学年高一上学期期末考试化学试题甘肃省武威第十八中学2018-2019学年高一下学期第一次月考化学试题广东省湛江市2018-2019学年高一化学(人教版)第一学期期末调研化学试题安徽省阜阳颍上一中2018-2019学年高一上学期期末考试化学试题河南省洛阳市2019-2020学年高一上学期期中考试化学试题黑龙江省海林市朝鲜族中学2019-2020学年高一上学期期中考试化学试题湖南省益阳市第六中学2018-2019学年高二下学期期中考试化学(理)试题浙江省金华市东阳中学2019-2020学年高一上学期期中考试化学试题西藏自治区拉萨市那曲第二高级中学2018-2019学年高一上学期期末考试化学试题2019年广东省深圳市高三第一次质量检测化学试题宁夏吴忠中学2019-2020学年高一上学期期末考试化学试题湖北省沙市中学2019-2020学年高一上学期期末考试化学试题云南省楚雄市楚雄实验中学2019--2020学年高一上学期期末检测化学试题天津市耀华中学2019-2020学年度高一上学期期末考试化学试题云南省昆明市官渡区2018-2019学年高一上学期期末学业水平检测化学试题吉林省长春市第二十九中学2019-2020学年高二下学期第三次月考化学试题广东省湛江市2018-2019学年高一上学期期末考试化学试题 河南省漯河市临颍县南街高级中学2020-2021学年高一10月质量检测化学试题天津市耀华中学2019-2020学年高一下学期期末化学试题(已下线)【南昌新东方】7. 2020 高一上 南昌一中 期中 刘惠文 余贞梅(已下线)【浙江新东方】【2020】【高一上】【期中】【hd-lp414】【化学】新疆维吾尔自治区阿克苏地区库车市第一中学2021届高三上学期期中考试化学试题浙江省温州中学2020-2021学年高一上学期期中考试化学试题广东省普宁市2020-2021学年高一上学期期末质量测试化学试题(已下线)【浙江新东方】【2021.4.27】【宁波】【高一上】【高中化学】【00149】新疆乌鲁木齐市第二十中学2020-2021学年高一上学期期末考试化学试题广东省揭阳市第一中学2017-2018学年高一上学期期中考试化学试题安徽省合肥市庐江县2021-2022学年高一上学期期末考试化学试题湖南省长沙市第一中学2022-2023学年高一上学期入学考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题山东省淄博第七中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
6 . 一定条件下,钠与氢气化合生成氢化钠(NaH),该化合物能与水反应生成氢氧化钠和氢气。下列关于氢化钠与水反应的说法不正确的是( )
| A.氢化钠是还原剂,水是氧化剂 | B.氢气既是氧化产物又是还原产物 |
| C.2mol氢化钠反应时可生成1mol氢气 | D.反应中1 mol水可得到1mol电子 |
您最近一年使用:0次
2019-11-25更新
|
364次组卷
|
5卷引用:四川省眉山市仁寿第一中学北校区2021-2022学年高一上学期半期化学试题
名校
解题方法
7 . 将8.0 g铁粉加入到100 mL 2.0 mol/L FeCl3溶液中,发生反应为Fe+2Fe3+=3Fe2+,反应后过滤、洗涤、烘干得固体质量为m。下列说法不正确的是( )
| A.m=2.4g | B.Fe3+在反应中做氧化剂,失去0.2mol电子 |
| C.该反应是化合反应 | D.反应后溶液中n(Fe2+)=0.3 mol |
您最近一年使用:0次
2019-11-25更新
|
106次组卷
|
4卷引用:四川省巴中市巴州区2019-2020学年高一上学期期中考试化学试题
解题方法
8 . 在中学化学中,KMnO4是常见的氧化剂之一。某实验小组收集整理了相关知识:
(1) KMnO4中Mn的化合价为_______ 。
(2) 实验室中可以加热分解KMnO4制取O2,其反应方程式为_______________ 。
(3) 实验中常在KMnO4溶液中加入适量稀硫酸,增加KMnO4的氧化性,但不宜用盐酸酸化,因为浓度较大时,KMnO4可能将Cl-氧化成Cl2,该反应中氧化剂和还原剂的物质的量之比为:____________ ,比较以下两种物质的氧化性:KMnO4_____________ 于Cl2(填“强”或“弱”)
(4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将H2C2O4溶液滴入硫酸酸化的KMnO4溶液,当KMnO4被完全还原时,溶液颜色由_______ 变成无色,同时有无色气体生成。该反应化学方程式为:_____________________ 。
(5)某同学将KMnO4溶液加入H2O2溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生,且出现黑色沉淀。该沉淀化学式为____________________
(1) KMnO4中Mn的化合价为
(2) 实验室中可以加热分解KMnO4制取O2,其反应方程式为
(3) 实验中常在KMnO4溶液中加入适量稀硫酸,增加KMnO4的氧化性,但不宜用盐酸酸化,因为浓度较大时,KMnO4可能将Cl-氧化成Cl2,该反应中氧化剂和还原剂的物质的量之比为:
(4) H2C2O4(草酸)是生物体的一种代谢产物,生活中常用作还原剂、除锈剂,将H2C2O4溶液滴入硫酸酸化的KMnO4溶液,当KMnO4被完全还原时,溶液颜色由
(5)某同学将KMnO4溶液加入H2O2溶液,却忘记了滴入稀硫酸,片刻后,有气泡产生,且出现黑色沉淀。该沉淀化学式为
您最近一年使用:0次
名校
9 . 某一反应体系中有反应物和生成物共5种物质:H2S+HNO3→S+NO+H2O;下列说法中正确的是( )
| A.该反应中的还原产物是S |
| B.若反应过程中转移了0.3 mol 电子,则氧化产物的质量9.6g |
| C.氧化剂与还原剂的物质的量之比为2∶3 |
| D.反应后溶液的酸性明显增强 |
您最近一年使用:0次
2019-11-24更新
|
218次组卷
|
3卷引用:四川省南充高级中学2019-2020学年高一12月月考化学试题
名校
10 . 三氟化氮(NF3)是无色无味气体,它可由氟与氨直接反应得到。4NH3+3F2 NF3+3NH4F,下列关于NF3的叙述不正确的是( )
NF3+3NH4F,下列关于NF3的叙述不正确的是( )
 NF3+3NH4F,下列关于NF3的叙述不正确的是( )
NF3+3NH4F,下列关于NF3的叙述不正确的是( )| A.该反应中NH3为还原剂 | B.在NF3中N的价态为-3价 |
| C.该反应电子转移为6e- | D.该反应氧化产物只有NF3 |
您最近一年使用:0次



