23-24高三上·安徽六安·阶段练习
名校
1 . 四氯化碳主要用作优良的溶剂、干洗剂、灭火剂、制冷剂、香料的浸出剂以及农药等,也可用于有机合成,工业上可用二硫化碳与氯气反应制取四氯化碳。某化学小组用下图实验装置模拟工业制备四氯化碳。

已知:① 可与溴水反应生成硫酸和氢溴酸;
可与溴水反应生成硫酸和氢溴酸;
② 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
③硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6 g/cm
的沸点76.8℃、密度1.6 g/cm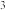 。
。
(1)A装置中盛放 的仪器名称为
的仪器名称为___________ 导管K的作用为___________ 。
(2)上述装置的连接顺序为
a→___________→___________→___________→___________→___________→___________→___________→___________→______________________
(3)反应结束后关闭 ,
, ,此时F装置的作用为
,此时F装置的作用为___________ 。
(4)装置B中若1 mol 完全反应,转移的电子数目为
完全反应,转移的电子数目为___________ 。
(5)反应结束先过滤除去固体催化剂,再经过___________ (填操作名称)可得到 。
。
(6)若用 提取碘水中的碘单质,振荡静置后的现象为
提取碘水中的碘单质,振荡静置后的现象为___________ 。

已知:①
 可与溴水反应生成硫酸和氢溴酸;
可与溴水反应生成硫酸和氢溴酸;②
 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;③硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6 g/cm
的沸点76.8℃、密度1.6 g/cm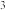 。
。(1)A装置中盛放
 的仪器名称为
的仪器名称为(2)上述装置的连接顺序为
a→___________→___________→___________→___________→___________→___________→___________→___________→___________
(3)反应结束后关闭
 ,
, ,此时F装置的作用为
,此时F装置的作用为(4)装置B中若1 mol
 完全反应,转移的电子数目为
完全反应,转移的电子数目为(5)反应结束先过滤除去固体催化剂,再经过
 。
。(6)若用
 提取碘水中的碘单质,振荡静置后的现象为
提取碘水中的碘单质,振荡静置后的现象为
您最近一年使用:0次
名校
解题方法
2 . ClO2又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。
(1)仪器a的名称为_______ 。
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为_______ 。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的_______ 性。若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______ 。
(4)D装置的作用是_______ 。
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的_______ 倍(结果保留两位小数)。
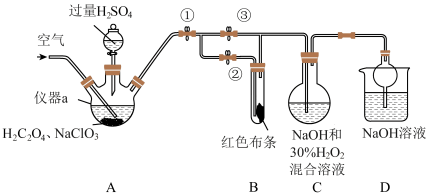
(1)仪器a的名称为
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的
(4)D装置的作用是
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的
您最近一年使用:0次
2023-10-04更新
|
230次组卷
|
2卷引用:四川省德阳市外国语学校2023-2024学年高一上学期期末模拟考试化学试题
名校
解题方法
3 . 科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。某化学小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。
请回答下列问题:
I.氯气的制备(装置如图所示)
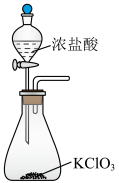
(1)制取氯气的化学方程式为___________ 。
II.漂白粉的制备(装置如图所示)
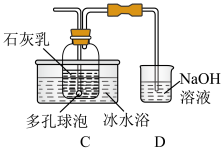
查阅资料可知:
①氯气与碱反应放出热量;②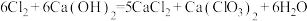 。
。
(2)装置C中发生反应的化学方程式为___________ 。
(3)多孔球泡的作用是___________ ,使用冰水浴的目的是___________ 。
(4)测定装置C中 物质的量浓度的方法如下:
物质的量浓度的方法如下:
取C中溶液10.0 mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应: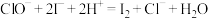 。用0.1000 mol⋅L
。用0.1000 mol⋅L
 标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴
标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴 标准溶液时,其现象为
标准溶液时,其现象为___________ 达到滴定终点,此时消耗 溶液的体积为20.00 mL(已知:
溶液的体积为20.00 mL(已知: )。该漂白粉溶液中
)。该漂白粉溶液中 的物质的量浓度为
的物质的量浓度为___________ mol·L (保留2位小数)。
(保留2位小数)。
请回答下列问题:
I.氯气的制备(装置如图所示)

(1)制取氯气的化学方程式为
II.漂白粉的制备(装置如图所示)

查阅资料可知:
①氯气与碱反应放出热量;②
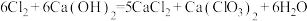 。
。(2)装置C中发生反应的化学方程式为
(3)多孔球泡的作用是
(4)测定装置C中
 物质的量浓度的方法如下:
物质的量浓度的方法如下:取C中溶液10.0 mL于锥形瓶中,加入硫酸酸化,加入过量KI溶液,盖紧瓶塞并在暗处充分发生反应:
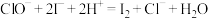 。用0.1000 mol⋅L
。用0.1000 mol⋅L
 标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴
标准溶液滴定该锥形瓶中的溶液,滴入2~3滴淀粉指示剂,当加入最后一滴 标准溶液时,其现象为
标准溶液时,其现象为 溶液的体积为20.00 mL(已知:
溶液的体积为20.00 mL(已知: )。该漂白粉溶液中
)。该漂白粉溶液中 的物质的量浓度为
的物质的量浓度为 (保留2位小数)。
(保留2位小数)。
您最近一年使用:0次
名校
4 . 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。完成下列问题:
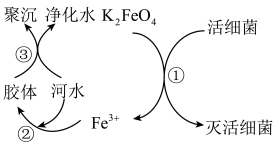
(1)K2FeO4的电离方程式______ 。过程①中K2FeO4表现了______ (填“氧化”或“还原”)性。
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有______ 、______ (填两个)。
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO______ K2FeO4。
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用单线桥法 表示电子转移的方向和数目说明______ ;
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:
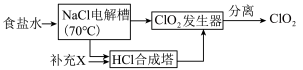
(4)该工艺中,需要补充的物质X为______ (填化学式,下同)。
(5)能参与循环的物质是______ 。
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:
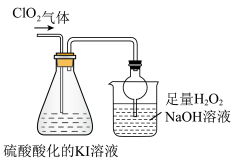
(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是______ 。
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是______ 。
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:______ 。
②请设计实验证明你的假设(仅用离子方程式表示):______ 。

(1)K2FeO4的电离方程式
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用
世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O
 NaClO3+3H2↑
NaClO3+3H2↑发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

(4)该工艺中,需要补充的物质X为
(5)能参与循环的物质是
已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

(6)锥形瓶内ClO2进气导管不伸入液面以下,原因是
(7)烧杯内液体用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2:1,则还原产物的化学式是
反应后向锥形瓶中加入少量四氯化碳,溶液上下分层,下层为紫红色
已知:I2+Na2S=2NaI+S
(8)若将锥形瓶内溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:
②请设计实验证明你的假设(仅用离子方程式表示):
您最近一年使用:0次
2023-03-04更新
|
302次组卷
|
2卷引用:四川师范大学附属中学2022-2023学年高一下学期半期考试化学试题
名校
解题方法
5 . 某学习小组的同学用MnO2和浓盐酸反应来制备纯净的氯气并验证其有无漂白性,设计装置如图:

(1)A装置中反应的化学方程式:____________________________ ;D装置中现象:___________________ ;该套装置存在的缺陷:_________________________________ 。
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是_______________________ (用离子方程式表示)。
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了_______________ 。当混合液中Cl-和ClO 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为__________________ 。
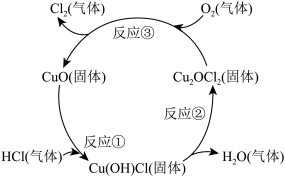
(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是___________ ,CuO的作用是_____________ ,写出总反应的化学方程式,并用单线桥法标出该反应的电子转移情况______________________________ 。

(1)A装置中反应的化学方程式:
(2)取少量E装置中溶液与洁厕灵(含盐酸)混合产生有毒气体,原因是
(3)若将Cl2通入热的烧碱溶液中,可以发生如下两个反应:
Cl2+2NaOH=NaCl+NaClO+H2O和3Cl2+6NaOH=5NaCl+NaClO3+3H2O。
从氧化还原角度分析Cl2表现了
 的个数比为15∶2时,混合液中ClO-和ClO
的个数比为15∶2时,混合液中ClO-和ClO 的个数比为
的个数比为(4)近年来,随着化学工业的快速发展,氯气的需求迅速增加。下图是制备氯气的原理示意图,其反应物是

您最近一年使用:0次
2022-12-14更新
|
395次组卷
|
3卷引用:四川省泸州市泸县2022-2023学年高一下学期开学考试化学试题
名校
解题方法
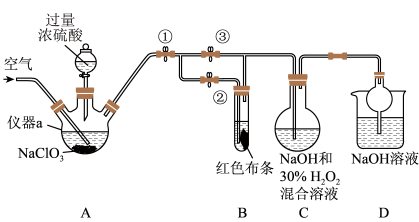
6 . ClO2又称百毒净,可用于水的消毒和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备ClO2,并探究ClO2的某些性质。
已知:①浓硫酸能与硫酸钠反应,产物为硫酸氢钠。
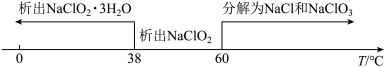
②饱和NaClO2溶液随温度变化情况如下:
回答下列问题:
(1)写出装置A制备ClO2,同时生成高氯酸(HClO4)的化学方程式:_______ 。
(2)关闭止水夹②,打开止水夹①③,通入一段时间空气,装置C中生成NaClO2,离子方程式为_______ 。若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______ 。
(3)从装置C反应后的溶液中获得NaClO2晶体,需控温在_______ 范围内进行减压蒸发结晶,采用减压蒸发的原因是_______ 。
(4)下列说法不正确的是_______(填字母)。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠替代Cl2。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是_______ 。

已知:①浓硫酸能与硫酸钠反应,产物为硫酸氢钠。
②饱和NaClO2溶液随温度变化情况如下:

回答下列问题:
(1)写出装置A制备ClO2,同时生成高氯酸(HClO4)的化学方程式:
(2)关闭止水夹②,打开止水夹①③,通入一段时间空气,装置C中生成NaClO2,离子方程式为
(3)从装置C反应后的溶液中获得NaClO2晶体,需控温在
(4)下列说法不正确的是_______(填字母)。
| A.通入的空气可将A中产生的ClO2全部驱赶到C中 |
B.ClO2处理饮用水时残留的 可用FeSO4除去,反应的离子方程式为 可用FeSO4除去,反应的离子方程式为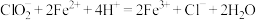 |
| C.工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输 |
| D.用Cl2和NaClO2制备ClO2,氧化剂与还原剂物质的量之比为2:1 |
您最近一年使用:0次
2022-12-12更新
|
253次组卷
|
3卷引用:四川省泸县第一中学2022-2023学年高一上学期期末考试化学试题
名校
7 . 氮在自然界中的转化是一个复杂的过程,氮循环是生态系统物质循环的重要组成部分。
(1)在一定条件下,NH3可用于脱除氮氧化物的烟气,其反应原理为4xNH3+6NOx (2x+3)N2+6xH2O。该反应中的还原剂为
(2x+3)N2+6xH2O。该反应中的还原剂为____ (填化学式)。
(2)氨的催化氧化是制备硝酸的重要过程,实验室按如图所示装置进行氨的催化氧化实验。

实验操作:将浓氨水倒入锥形瓶中,从导气管通入热空气,将红热的铂丝伸入锥形瓶中。
实验现象:a.红热的铂丝始终保持红热状态;b.瓶中有红棕色气体生成,瓶内还有白烟生成。回答下列问题:
①铂丝始终保持红热状态的可能原因是____ 。
②通入热空气的作用是____ 。
③请写出氨气的催化氧化反应的化学方程式:____ 。
④红棕色气体的化学式为____ ,此气体可用NaOH溶液吸收,有NaNO2和NaNO3生成,写出该反应的离子方程式:____ 。
(3)氨是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。高浓度的氨氮废水是造成河流及湖泊富营养化的主要因素,研究表明在微生物作用下,可实现NH →NO
→NO 的转化。写出在碱性条件下,NH
的转化。写出在碱性条件下,NH 被氧气氧化为NO
被氧气氧化为NO 的反应的离子方程式:
的反应的离子方程式:____ 。每生成1molNO ,转移的电子的物质的量为
,转移的电子的物质的量为____ mol。再往含NO 的废水中加入甲醇,可将NO
的废水中加入甲醇,可将NO 转化为N2,实现废水的无害化处理。
转化为N2,实现废水的无害化处理。
(1)在一定条件下,NH3可用于脱除氮氧化物的烟气,其反应原理为4xNH3+6NOx
 (2x+3)N2+6xH2O。该反应中的还原剂为
(2x+3)N2+6xH2O。该反应中的还原剂为(2)氨的催化氧化是制备硝酸的重要过程,实验室按如图所示装置进行氨的催化氧化实验。

实验操作:将浓氨水倒入锥形瓶中,从导气管通入热空气,将红热的铂丝伸入锥形瓶中。
实验现象:a.红热的铂丝始终保持红热状态;b.瓶中有红棕色气体生成,瓶内还有白烟生成。回答下列问题:
①铂丝始终保持红热状态的可能原因是
②通入热空气的作用是
③请写出氨气的催化氧化反应的化学方程式:
④红棕色气体的化学式为
(3)氨是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。高浓度的氨氮废水是造成河流及湖泊富营养化的主要因素,研究表明在微生物作用下,可实现NH
 →NO
→NO 的转化。写出在碱性条件下,NH
的转化。写出在碱性条件下,NH 被氧气氧化为NO
被氧气氧化为NO 的反应的离子方程式:
的反应的离子方程式: ,转移的电子的物质的量为
,转移的电子的物质的量为 的废水中加入甲醇,可将NO
的废水中加入甲醇,可将NO 转化为N2,实现废水的无害化处理。
转化为N2,实现废水的无害化处理。
您最近一年使用:0次
2022-03-23更新
|
222次组卷
|
3卷引用:四川省宜宾市叙州区第一中学校2022-2023学年高一下学期4月月考化学试题
名校
8 . 硫代硫酸钠(Na2S2O3)是一种解毒药,用于氟化物、砷、汞、铅、锡、碘等中毒,临床常用于治疗荨麻疹,皮肤瘙痒等病症.硫代硫酸钠在中性或碱性环境中稳定,在酸性溶液中分解产生S和SO2
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:
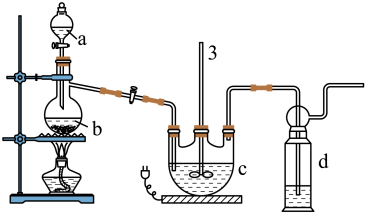
(1)仪器a的名称是_______ ,仪器b的名称是_______ 。b中利用质量分数为70%〜80%的H2SO4溶液与Na2SO3固体反应制备SO2反应的化学方程式为_______ 。c中试剂为_______
(2)实验中要控制SO2的生成速率,可以采取的措施有_______ (写出一条)
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是_______
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过_______ (填操作、试剂和现象),进一步证实生成了Fe2+。从化学反应速率和平衡的角度解释实验Ⅱ的现象:_______
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为_______ mol∙L-1
实验I:Na2S2O3的制备。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得,实验室模拟该工业过程的装置如图所示:

(1)仪器a的名称是
(2)实验中要控制SO2的生成速率,可以采取的措施有
(3)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是
实验Ⅱ:探究Na2S2O3与金属阳离子的氧化还原反应。
资料:Fe3++3S2O32-⇌Fe(S2O3)33-(紫黑色)
| 装置 | 试剂X | 实验现象 |
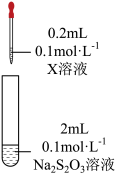 | Fe2(SO4)3溶液 | 混合后溶液先变成紫黑色,30s后几乎变为无色 |
(4)根据上述实验现象,初步判断最终Fe3+被S2O32-还原为Fe2+,通过
实验Ⅲ:标定Na2S2O3溶液的浓度
(5)称取一定质量的产品配制成硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:用分析天平准确称取基准物质K2Cr2O7(摩尔质量为294g∙mol-1)0.5880g。平均分成3份,分别放入3个锥形瓶中,加水配成溶液,并加入过量的KI并酸化,发生下列反应:6I-+Cr2O72-+14H+ = 3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应I2+2S2O32- = 2I- + S4O62-,三次消耗 Na2S2O3溶液的平均体积为25.00 mL,则所标定的硫代硫酸钠溶液的浓度为
您最近一年使用:0次
2020-04-20更新
|
816次组卷
|
6卷引用:四川省成都市双流棠湖中学2019-2020学年高二下学期第四学月考试化学试题
解题方法
9 . 实验室制取Cl2并用Cl2与铜粉反应,制取并收集产物。根据下图回答问题:

(1)写出装置A中发生反应的化学方程式___________ 。
(2)B中最适宜选用的试剂:___________ 。
(3)D中的现象是___________ ;D与E间最好选用粗而短的导管的原因:___________ 。
(4)装置A中若有0.2 mol HCl参加反应,则被氧化的HCl为___________ mol。
(5)若E中盛装蒸馏水,装置F的作用:___________ ;反应的化学方程式为___________ 。
(6)若装置E中装入足量NaOH溶液,则E中的现象:___________ 。反应的离子方程式___________ 。
(7)若无D装置且E中盛有KI -淀粉的混合溶液,E中的现象:___________ ,反应的离子方程式___________ 。

(1)写出装置A中发生反应的化学方程式
(2)B中最适宜选用的试剂:
(3)D中的现象是
(4)装置A中若有0.2 mol HCl参加反应,则被氧化的HCl为
(5)若E中盛装蒸馏水,装置F的作用:
(6)若装置E中装入足量NaOH溶液,则E中的现象:
(7)若无D装置且E中盛有KI -淀粉的混合溶液,E中的现象:
您最近一年使用:0次
名校
解题方法
10 . 为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如图所示的实验装置。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与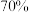 的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,制取SO2应采用气体发生装置
的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,制取SO2应采用气体发生装置___________ (填“A”或“B”)。
(2) 装置中主要反应的离子方程式为
装置中主要反应的离子方程式为___________ 。
(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。“体积膨胀,并放出有刺激性气味的气体”,写出蔗糖变黑后与浓硫酸反应对应的化学方程式:___________ 。
(4)上述(3)中现象体现了浓硫酸的___________ (填序号)
①酸性 ②吸水性 ③脱水性 ④强氧化性
(5)向80mL浓硫酸中加入5.6g铜,加热一段时间后至不再反应为止,实验测得反应中共有11.2L (标准状况下) SO2气体生成,反应中转移电子___________ mol,该反应中浓硫酸体现了强氧化性和___________ 。

(1)该化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3与
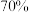 的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,制取SO2应采用气体发生装置
的硫酸为原料制取SO2,采用MnO2和浓盐酸(12mol/L)为原料制取Cl2。在此实验中,制取SO2应采用气体发生装置(2)
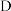 装置中主要反应的离子方程式为
装置中主要反应的离子方程式为(3)将适量的蔗糖放入烧杯中,加少量水拌匀,再加适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并放出有刺激性气味的气体。“体积膨胀,并放出有刺激性气味的气体”,写出蔗糖变黑后与浓硫酸反应对应的化学方程式:
(4)上述(3)中现象体现了浓硫酸的
①酸性 ②吸水性 ③脱水性 ④强氧化性
(5)向80mL浓硫酸中加入5.6g铜,加热一段时间后至不再反应为止,实验测得反应中共有11.2L (标准状况下) SO2气体生成,反应中转移电子
您最近一年使用:0次



