名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: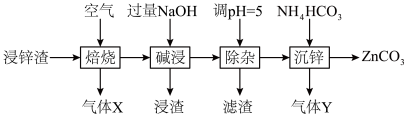
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):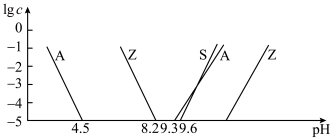
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
212次组卷
|
2卷引用:2024届四川省射洪中学校高三下学期二模理综试题-高中化学
2 . 高锰酸钾是临床医学上常用的消毒剂。如图是电化学法制备高锰酸钾的装置图,X、Y均为惰性电极。下列说法正确的是
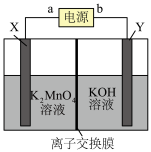
| A.a为电源负极 |
B.每转移 电子,Y极放出1.12L气体 电子,Y极放出1.12L气体 |
C.电解过程中X极附近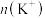 增大 增大 |
D.当外电路中有 电子转移时,X、Y电极氧化产物与还原产物的物质量的量比为 电子转移时,X、Y电极氧化产物与还原产物的物质量的量比为 |
您最近一年使用:0次
名校
3 .  表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A. 的乙酸和盐酸混合溶液含 的乙酸和盐酸混合溶液含 个 个 |
B.7.1g氯气与 充分反应转移电子数为 充分反应转移电子数为 |
C.78g过氧化钠与足量 充分反应,转移电子数为 充分反应,转移电子数为 |
D.标准状态下,20g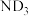 含有的质子数为 含有的质子数为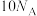 |
您最近一年使用:0次
2024-04-21更新
|
270次组卷
|
2卷引用:四川省绵阳南山中学2024届高三下学期三诊热身考试理综-化学试题
名校
解题方法
4 . 水合硼酸锌(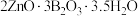 ,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为
,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为 ,以及少量
,以及少量 和
和 等)和菱锌矿(主要成分为
等)和菱锌矿(主要成分为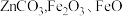 和
和 等)为原料制备水合硼酸锌的工艺流程如下:
等)为原料制备水合硼酸锌的工艺流程如下: 如下表所示:
如下表所示:
回答下列问题:
(1)“酸浸”时, 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为__________ 。为加快“酸浸”时的浸取速率,下列措施中无法达到目的是__________ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加硫酸浓度 e.适当升高温度
(2)滤渣1的主要成分为__________ (填化学式)。
(3)“氧化”的目的是__________ (语言叙述), 也可以用
也可以用 代替,若“氧化”过程中转移电子数相等,则消耗
代替,若“氧化”过程中转移电子数相等,则消耗 和
和 的物质的量之比为
的物质的量之比为__________ 。
(4)“一次调 ”时,调节溶液的
”时,调节溶液的 ,目的是
,目的是__________ 。“二次调 ”时的
”时的 范围为
范围为__________ 。
(5)“制备”水合硼酸锌的化学方程式为__________ 。
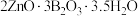 ,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为
,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为 ,以及少量
,以及少量 和
和 等)和菱锌矿(主要成分为
等)和菱锌矿(主要成分为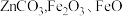 和
和 等)为原料制备水合硼酸锌的工艺流程如下:
等)为原料制备水合硼酸锌的工艺流程如下:
 如下表所示:
如下表所示:金属离子 |
|
|
|
|
|
开始沉淀 | 1.9 | 7.0 | 3.0 | 6.2 | 8.9 |
完全沉淀 | 3.2 | 9.0 | 4.7 | 8.0 | 10.9 |
(1)“酸浸”时,
 与硫酸反应的离子方程式为
与硫酸反应的离子方程式为a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加硫酸浓度 e.适当升高温度
(2)滤渣1的主要成分为
(3)“氧化”的目的是
 也可以用
也可以用 代替,若“氧化”过程中转移电子数相等,则消耗
代替,若“氧化”过程中转移电子数相等,则消耗 和
和 的物质的量之比为
的物质的量之比为(4)“一次调
 ”时,调节溶液的
”时,调节溶液的 ,目的是
,目的是 ”时的
”时的 范围为
范围为(5)“制备”水合硼酸锌的化学方程式为
您最近一年使用:0次
2024-04-21更新
|
178次组卷
|
3卷引用:四川省绵阳中学2023-2024学年高三下学期2月开学考理科综合-高中化学
解题方法
5 .  是有毒的污染性气体,可将其与氧气的混合气体通入
是有毒的污染性气体,可将其与氧气的混合气体通入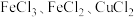 的混合溶液中进行处理,其物质转化如图所示。下列说法正确的是
的混合溶液中进行处理,其物质转化如图所示。下列说法正确的是
 是有毒的污染性气体,可将其与氧气的混合气体通入
是有毒的污染性气体,可将其与氧气的混合气体通入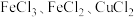 的混合溶液中进行处理,其物质转化如图所示。下列说法正确的是
的混合溶液中进行处理,其物质转化如图所示。下列说法正确的是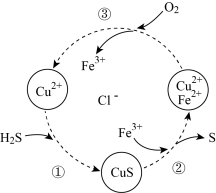
| A.过程①中发生的反应是复分解反应 |
B.过程②中每生成 转移 转移 个电子 个电子 |
C.过程③中每转化 ,需 ,需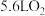 |
D.总反应为 |
您最近一年使用:0次
6 . 已知水煤气反应: ,
, 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是
 ,
, 为阿伏加德罗常数的值,下列叙述正确的是
为阿伏加德罗常数的值,下列叙述正确的是| A.所得混合气体产物的平均摩尔质量为15g |
B.若反应得到2g  ,则生成的CO体积为22.4L ,则生成的CO体积为22.4L |
C.每消耗18g  ,反应转移电子数为 ,反应转移电子数为 |
D.当断裂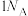 极性共价键时反应生成 极性共价键时反应生成 |
您最近一年使用:0次
2024-04-01更新
|
220次组卷
|
2卷引用:2024届四川省雅安市、遂宁市、眉山市高三第二次诊断性考试理科综合试题-高中化学
名校
7 .  为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是A.标准状况下,22.4L己烷中含有碳碳单键数目大于 |
B.60g二氧化硅晶体中含有Si-O键数为 |
C.将2.3gNa与氧气完全反应,反应中转移的电子数介于 到 到 之间 之间 |
D.2mL0.5mol/L硅酸钠溶液中滴入盐酸制硅酸胶体,所得胶粒数目为 |
您最近一年使用:0次
解题方法
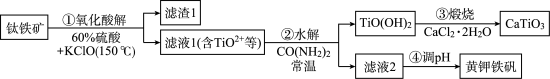
8 .  是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾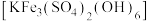 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
(1) 中Ti的化合价为
中Ti的化合价为_______ 。
(2)步骤①滤渣1的主要成分是_______ ,若氧化酸解的氧化剂用 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为_______ ,相同条件下,用 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是_______ 。
(3)已知 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为_______ ;常温下,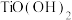
 为
为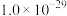 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为_______ 。
(4)步骤③反应的化学方程式为_______ ,若在实验室煅烧,用到的实验仪器除了玻璃棒、酒精灯、三脚架及泥三角外,还需要_______ 。
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
 是光电转化材料。利用钛铁矿(主要成分为
是光电转化材料。利用钛铁矿(主要成分为 ,还含有少量
,还含有少量 等杂质)来制备
等杂质)来制备 ,并回收铁制备难溶于水的黄钾铁矾
,并回收铁制备难溶于水的黄钾铁矾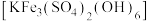 ,制备流程如图,回答下列问题:
,制备流程如图,回答下列问题:
部分原料价格表:
| 物质 | 纯碱(99% ) ) | 氢氧化钾(90% ) ) | 碳酸钾(99% ) ) | 液氨(99.9%) |
| 价格(元/吨) | 1800 | 4000 | 4500 | 25000 |
 中Ti的化合价为
中Ti的化合价为(2)步骤①滤渣1的主要成分是
 替代
替代 ,则理论上氧化剂与还原剂物质的量之比为
,则理论上氧化剂与还原剂物质的量之比为 做氧化剂时,其酸解效率较
做氧化剂时,其酸解效率较 低,原因可能是
低,原因可能是(3)已知
 在水中能部分水解并有
在水中能部分水解并有 生成,则相关离子方程式为
生成,则相关离子方程式为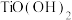
 为
为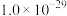 ,滤液1中
,滤液1中 浓度为
浓度为 ,步骤②中要使
,步骤②中要使 水解的转化率达99%,加
水解的转化率达99%,加 时忽略溶液体积变化,则此时溶液的pH应为
时忽略溶液体积变化,则此时溶液的pH应为(4)步骤③反应的化学方程式为
(5)结合信息分析,步骤④调pH最适宜的试剂是_______。
A. | B. | C. | D. |
您最近一年使用:0次
2024-03-28更新
|
111次组卷
|
3卷引用:2024届四川省雅安市高三上学期第一次诊断性考试理综试题
名校
解题方法
9 . 一种用3-氯丙烯(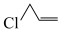 )电解合成环氧氯丙烷(
)电解合成环氧氯丙烷( )的装置如图所示。该装置无需使用隔膜,且绿色高效,图中X为Cl或Br,工作时X-和OH-同时且等量放电。下列说法正确的是
)的装置如图所示。该装置无需使用隔膜,且绿色高效,图中X为Cl或Br,工作时X-和OH-同时且等量放电。下列说法正确的是

| A.每转移1mole-,生成1mol环氧氯丙烷 | B.电解一段时间后,装置中OH-的物质的量不变 |
| C.若X为Br,则可电解制备环氧溴丙烷 | D.该装置工作时需不断补充X- |
您最近一年使用:0次
2024-03-16更新
|
626次组卷
|
2卷引用:2024届四川省成都石室中学高三下学期5月高考适应性考试(一)理科综合试卷-高中化学
10 . 设NA为阿伏加德罗常数的值。下列说法错误的是
A.标准状况下, 含有的分子数大于NA 含有的分子数大于NA |
B. 中含有的碳氧双键的数目为2NA 中含有的碳氧双键的数目为2NA |
C.足量的铜丝在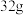 硫蒸气中充分燃烧会失去2NA个电子 硫蒸气中充分燃烧会失去2NA个电子 |
D. 溶液中,含有的氧原子的个数为0.04NA 溶液中,含有的氧原子的个数为0.04NA |
您最近一年使用:0次








