2022高二上·安徽阜阳·竞赛
解题方法
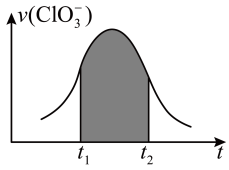
1 . 已知氯酸钾和和亚硫酸氢钾可以发生氧化还原反应(无污染性气体产生),且反应中被氧化被还原的元素个数都只有一个。若该反应的反应速率会随着c(H+)的提升而加快,下图为ClO 在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
 在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
在单位时间内物质的量浓度变化表示的反应速率-时间图象,下列说法正确的是
| A.反应进行一段时间后速率下降可能是因为c(OH-)的浓度下降导致。 |
| B.纵坐标为v(H+)的v-t曲线在通过平移后可与图中图象完全重合。 |
C.图中阴影部分的面积表示t1~t2时间内ClO 的物质的量的减少量。 的物质的量的减少量。 |
| D.系数为最简整数比时,每摩尔反应转移6mol e-并产生3mol质子。 |
您最近一年使用:0次
名校
解题方法
2 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中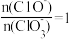 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2078次组卷
|
12卷引用:江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题
江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
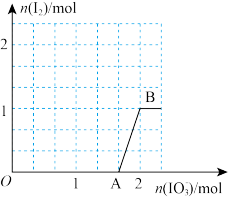
3 . 在含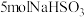 的溶液中逐滴加入
的溶液中逐滴加入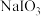 溶液,加入
溶液,加入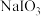 的物质的量和析出
的物质的量和析出 的物质的量的关系曲线如图所示,下列说法错误的是
的物质的量的关系曲线如图所示,下列说法错误的是
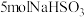 的溶液中逐滴加入
的溶液中逐滴加入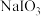 溶液,加入
溶液,加入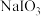 的物质的量和析出
的物质的量和析出 的物质的量的关系曲线如图所示,下列说法错误的是
的物质的量的关系曲线如图所示,下列说法错误的是
A.由图示可知还原性: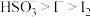 |
B.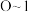 间发生反应: 间发生反应: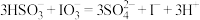 |
C.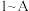 间共生成 间共生成 的物质的量为 的物质的量为 |
D.溶液中 与 与 的物质的量之比为5:3时,加入的 的物质的量之比为5:3时,加入的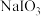 为 为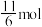 |
您最近一年使用:0次
名校
解题方法
4 . 磷化氢(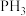 )是一种在空气中能自燃的剧毒气体,具有还原性,可作为电子工业原料。
)是一种在空气中能自燃的剧毒气体,具有还原性,可作为电子工业原料。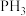 的一种工业制法流程如下:
的一种工业制法流程如下:

下列说法错误的是
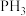 )是一种在空气中能自燃的剧毒气体,具有还原性,可作为电子工业原料。
)是一种在空气中能自燃的剧毒气体,具有还原性,可作为电子工业原料。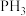 的一种工业制法流程如下:
的一种工业制法流程如下:
下列说法错误的是
| A.反应1中氧化剂与还原剂物质的量之比为1:3 |
B. 转化为 转化为 的理论转化率为 的理论转化率为 |
C.反应1与反应3分别生成 时转移电子数之比为3:4 时转移电子数之比为3:4 |
D.等物质的量 、 、 与足量 与足量 溶液反应消耗 溶液反应消耗 之比为1:1 之比为1:1 |
您最近一年使用:0次
2022-10-20更新
|
802次组卷
|
4卷引用:辽宁省大连市滨城联盟2022-2023学年高三上学期期中(Ⅰ)考试化学试题
辽宁省大连市滨城联盟2022-2023学年高三上学期期中(Ⅰ)考试化学试题河南省洛阳市宜阳县第一高级中学2022-2023学年高一上学期第四次能力达标测试化学试题(已下线)2022年河北省高考真题变式题(1-9)(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
名校
解题方法
5 . 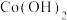 在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物[其中Co的化合价为+2、+3,分别表示为Co(II)、Co(III)],用
在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物[其中Co的化合价为+2、+3,分别表示为Co(II)、Co(III)],用 盐酸将其恰好完全溶解,得到
盐酸将其恰好完全溶解,得到 溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是
溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是

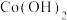 在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物[其中Co的化合价为+2、+3,分别表示为Co(II)、Co(III)],用
在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物[其中Co的化合价为+2、+3,分别表示为Co(II)、Co(III)],用 盐酸将其恰好完全溶解,得到
盐酸将其恰好完全溶解,得到 溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是
溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是
A.290℃时,若固体中只含有两种元素,则为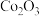 |
B.400℃时, |
| C.500℃时,固体中氧元素质量分数约为26.6% |
| D.生成的黄绿色气体可用于工业上生产“84”消毒液 |
您最近一年使用:0次
2022-10-18更新
|
529次组卷
|
3卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高三上学期月考化学试题(二)
解题方法
6 . 一方面,磷矿藏在地球上分布不均匀且储量有限;另一方面,污水中含有较多的磷元素。因此在污水处理生物污泥中的蓝铁矿[Fe3(PO4)2·nH2O]因其潜在的特殊用途以及经济价值而备受关注。蓝铁矿在自然水体中形成的过程如图。

(1)水处理时,加入的高铁酸钾(K2FeO4)作为净水消毒剂,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4中Fe的化合价为_______ 价,上述反应涉及的物质中属于盐的是_______ 。
②高铁酸钾可用于净水消毒的原因是_______ 。
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:________ _______Fe(OH)3+______CH4+_______H+ ______Fe2++_______HCO
______Fe2++_______HCO +_______H2O,
+_______H2O,
该反应中的氧化产物为_______ (填离子符号),被氧化的原子与被还原的原子的数目之比为_______ 。
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=
Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=_______ ,蓝铁矿的相对分子质量为_______ 。

(1)水处理时,加入的高铁酸钾(K2FeO4)作为净水消毒剂,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4中Fe的化合价为
②高铁酸钾可用于净水消毒的原因是
(2)在甲烷厌氧氧化菌的作用下,氢氧化铁和甲烷发生如下反应,配平该离子方程式:
 ______Fe2++_______HCO
______Fe2++_______HCO +_______H2O,
+_______H2O,该反应中的氧化产物为
(3)无氧条件下加热,蓝铁矿(无杂质)发生分解:Fe3(PO4)2·nH2O
 Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=
Fe3(PO4)2+nH2O,蓝铁矿的质量由5.02g减小为3.58g,则n=
您最近一年使用:0次
2022-10-10更新
|
803次组卷
|
3卷引用:河南省新乡市2022~2023学年高一上学期选科调研第一次测试化学试题
名校
解题方法
7 . 高铁酸盐是一种集氧化、絮凝、杀菌、吸附、助凝、除臭为一体的新型高效多功能水处理剂。
I.某实验小组在实验室制备少量高铁酸钾( )。
)。
查阅资料:
a. 为紫色固体。
为紫色固体。
b. 具有强氧化性,在酸性或中性溶液中快速产生
具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。

(1)装置B除去挥发的HCl,目的是_______ 。
(2)装置C中反应的离子方程式:_______ 。
(3)装置D中反应的离子方程式为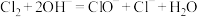 ,用单线桥表示电子转移方向和数目
,用单线桥表示电子转移方向和数目_______ 。在装置D的溶液中还检测出 ,若溶液中个数
,若溶液中个数 ,则个数
,则个数
_______ 。
II.工业上可以用多种制备高铁酸钠( )。
)。
(4) 与
与 生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式
生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式____ 。
(5)高铁酸钠还可以通过如下反应制得: ,反应中的还原剂有
,反应中的还原剂有_____ ,反应中1个 可以还原
可以还原 的数目为
的数目为_____ 个。
I.某实验小组在实验室制备少量高铁酸钾(
 )。
)。查阅资料:
a.
 为紫色固体。
为紫色固体。b.
 具有强氧化性,在酸性或中性溶液中快速产生
具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)装置B除去挥发的HCl,目的是
(2)装置C中反应的离子方程式:
(3)装置D中反应的离子方程式为
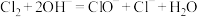 ,用单线桥表示电子转移方向和数目
,用单线桥表示电子转移方向和数目 ,若溶液中个数
,若溶液中个数 ,则个数
,则个数
II.工业上可以用多种制备高铁酸钠(
 )。
)。(4)
 与
与 生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式
生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式(5)高铁酸钠还可以通过如下反应制得:
 ,反应中的还原剂有
,反应中的还原剂有 可以还原
可以还原 的数目为
的数目为
您最近一年使用:0次
2022-10-09更新
|
381次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学校2022一2023学年高一上学期9月份考试化学试题
名校
解题方法
8 . 二氧化氯(ClO2)是一种常用的饮用水消毒剂。
(1)ClO2分子中的键角约为120°。ClO2易溶于水的原因是____ 。
(2)某ClO2泡腾片的有效成分为NaClO2、NaHSO4、NaHCO3,其溶于水时反应可得到ClO2溶液,并逸出大量气体。NaClO2和NaHSO4反应生成ClO2和Cl-的离子方程式为____ ,逸出气体的主要成分是____ (填化学式)。
(3)ClO2消毒时会产生少量的ClO ,可利用FeSO4将ClO
,可利用FeSO4将ClO 转化为Cl-除去。控制其他条件相同,ClO
转化为Cl-除去。控制其他条件相同,ClO 去除率随温度变化如图所示。温度低于50℃时,随着温度升高,ClO
去除率随温度变化如图所示。温度低于50℃时,随着温度升高,ClO 去除率逐渐增大的可能原因是
去除率逐渐增大的可能原因是____ 。

(4)测定某水样中ClO 浓度的方法如下:
浓度的方法如下:
量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:ClO +I-+H+—H2O+I2+Cl-(未配平)
+I-+H+—H2O+I2+Cl-(未配平)
I2+S2O —I-+S4O
—I-+S4O (未配平)
(未配平)
计算水样中ClO 的浓度
的浓度____ 。
(1)ClO2分子中的键角约为120°。ClO2易溶于水的原因是
(2)某ClO2泡腾片的有效成分为NaClO2、NaHSO4、NaHCO3,其溶于水时反应可得到ClO2溶液,并逸出大量气体。NaClO2和NaHSO4反应生成ClO2和Cl-的离子方程式为
(3)ClO2消毒时会产生少量的ClO
 ,可利用FeSO4将ClO
,可利用FeSO4将ClO 转化为Cl-除去。控制其他条件相同,ClO
转化为Cl-除去。控制其他条件相同,ClO 去除率随温度变化如图所示。温度低于50℃时,随着温度升高,ClO
去除率随温度变化如图所示。温度低于50℃时,随着温度升高,ClO 去除率逐渐增大的可能原因是
去除率逐渐增大的可能原因是
(4)测定某水样中ClO
 浓度的方法如下:
浓度的方法如下:量取25.00mL水样于碘量瓶中,加水稀释至50.00mL,加入过量KI,再滴入适量稀硫酸,充分反应后,滴加1mL淀粉溶液,用0.01000mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:ClO
 +I-+H+—H2O+I2+Cl-(未配平)
+I-+H+—H2O+I2+Cl-(未配平)I2+S2O
 —I-+S4O
—I-+S4O (未配平)
(未配平)计算水样中ClO
 的浓度
的浓度
您最近一年使用:0次
9 . 重铬酸钠(Na2Cr2O7)俗称红矾钠,工业上有着广泛的用途,五氧化二钒广泛地用于冶金、印染、陶瓷及石油工业等方面。某化工厂用钒铬渣[主要成分为VO2•xH2O、Cr(OH)3及少量的SiO2]为原料生产上述两种物质的工艺流程如图所示: 
已知:①有关物质的溶解度(g/100gH2O)如表所示:
②当pH>4.1时,Cr3+开始沉淀。
回答下列问题:
(1)Na2S2O8名称为过二硫酸钠,存在一个过氧键,则该化合物中硫元素的化合价是____ 价;写出滤渣的一种用途:____ 。
(2)“氧化1”过程中,钒元素由VO2+转化为VO ,相应反应的离子方程式为
,相应反应的离子方程式为_____ 。
(3)“中和沉淀”过程中,生成V2O5•xH2O的离子方程式为_____ ;若“中和沉淀”后溶液(常温)中c(Cr3+)=1mol·L-1,则此温度下Ksp[Cr(OH)3]=_____ 。
(4)“氧化2”过程中,铬元素由Cr3+转化为CrO ,当有3molCrO
,当有3molCrO 生成时,理论上消耗
生成时,理论上消耗____ molH2O2;两次氧化均需要加热,但“氧化2”中加热的温度应较低,原因是____ 。
(5)重结晶包括蒸发浓缩、趁热过滤、降温结晶、过滤、洗涤等步骤,则“趁热过滤”得到的晶体成分是_____ (填化学式);“降温结晶”时得到的物质是_____ (填“纯净”或“混合”)物。

已知:①有关物质的溶解度(g/100gH2O)如表所示:
| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| Na2Cr2O7 | 183.6 | 215.1 | 269.2 | 376.4 | 415.0 |
| Na2SO4 | 19.5 | 48.8 | 45.3 | 43.7 | 42.5 |
回答下列问题:
(1)Na2S2O8名称为过二硫酸钠,存在一个过氧键,则该化合物中硫元素的化合价是
(2)“氧化1”过程中,钒元素由VO2+转化为VO
 ,相应反应的离子方程式为
,相应反应的离子方程式为(3)“中和沉淀”过程中,生成V2O5•xH2O的离子方程式为
(4)“氧化2”过程中,铬元素由Cr3+转化为CrO
 ,当有3molCrO
,当有3molCrO 生成时,理论上消耗
生成时,理论上消耗(5)重结晶包括蒸发浓缩、趁热过滤、降温结晶、过滤、洗涤等步骤,则“趁热过滤”得到的晶体成分是
您最近一年使用:0次
名校
解题方法
10 . 完成下列问题。
(1)已知完全断裂物质的量均为1mol的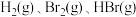 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为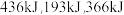 。则在该条件下,
。则在该条件下,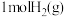 与
与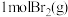 完全反应会
完全反应会_______ (填“吸收”或“放出”)_______  能量。
能量。
(2)将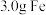 和
和 的混合粉末完全溶于
的混合粉末完全溶于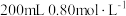 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:
①则混合粉末中Fe的物质的量是_______ mol;
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是_______ g。
(1)已知完全断裂物质的量均为1mol的
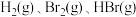 中的化学键时吸收能量分别为
中的化学键时吸收能量分别为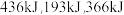 。则在该条件下,
。则在该条件下,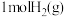 与
与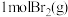 完全反应会
完全反应会 能量。
能量。(2)将
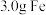 和
和 的混合粉末完全溶于
的混合粉末完全溶于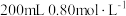 盐酸中,生成标准状况下
盐酸中,生成标准状况下 (假设气体被完全收集);反应后的溶液中滴入2滴
(假设气体被完全收集);反应后的溶液中滴入2滴 溶液后不显血红色。请通过分析计算回答:
溶液后不显血红色。请通过分析计算回答:①则混合粉末中Fe的物质的量是
②若在反应后的混合液中加入锌,则理论上最多可溶解锌的质量是
您最近一年使用:0次



