名校
解题方法
1 . 碳酸锌在工业上用途广泛。利用某种浸锌渣(主要含有 )制备
)制备 的一种流程如下:
的一种流程如下: ;
;
②室温下,部分离子浓度的对数 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体 中主要成分是
中主要成分是______ (填化学式)。
(2)“碱浸”后,浸出液中含有金属元素的离子主要是 和
和______ (填离子符号);欲使浸出液中的含锌微粒完全沉淀,应调节 的范围是
的范围是______ 。
(3)浸渣回收银的过程中有配合物 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为______ 。
(4)“除杂”时滤渣的主要成分是______ (填化学式)。
(5)“沉锌”时发生反应的离子方程式为______ ;此过程不宜用碳酸钠代替碳酸氢铵,原因是______ 。
 )制备
)制备 的一种流程如下:
的一种流程如下: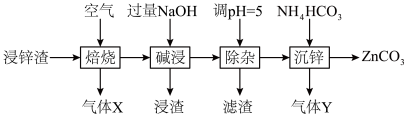
 ;
;②室温下,部分离子浓度的对数
 与
与 的关系如下图所示(其中
的关系如下图所示(其中 和
和 分别代表含铝、含硅和含锌微粒):
分别代表含铝、含硅和含锌微粒):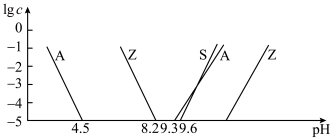
(1)“焙烧”时,金属硫化物均转化为氧化物,生成的气体
 中主要成分是
中主要成分是(2)“碱浸”后,浸出液中含有金属元素的离子主要是
 和
和 的范围是
的范围是(3)浸渣回收银的过程中有配合物
 生成,在碱性条件下用
生成,在碱性条件下用 还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为
还原该配合物,还原产物为银单质,同时放出N2,该反应中氧化剂与还原剂的物质的量之比为(4)“除杂”时滤渣的主要成分是
(5)“沉锌”时发生反应的离子方程式为
您最近一年使用:0次
2024-05-17更新
|
213次组卷
|
2卷引用:云南省罗平第一中学2024年高三二模考试化学试题
名校
解题方法
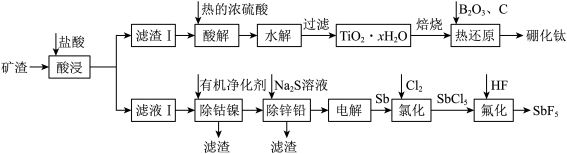
2 . 硼化钛强度高、硬度大,广泛应用于机械制造领域;五氟化锑( )是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含
)是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含 、
、 、
、 、
、 、
、 、
、 )为原料制取硼化钛和五氟化锑的流程如图所示。
)为原料制取硼化钛和五氟化锑的流程如图所示。
已知:① 性质较稳定,加热时可溶于浓硫酸中形成
性质较稳定,加热时可溶于浓硫酸中形成 。
。
②25℃时, 、
、 的
的 分别为
分别为 ,
,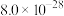 。
。
(1)“水解”步骤中对应的离子方程式为___________ 。为了使水解趋于完全,可采取的措施有___________ 。
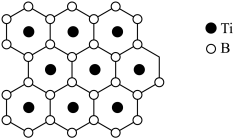
(2)硼化钛有类似石墨的层状结构,硼原子平面和钛原子平面在晶体结构中交替出现,形成二维网状结构,其投影图如下,硼化钛的化学式为___________ 。“热还原”步骤中使用电弧炉高温加热装置(1450~1550℃),每消耗1mol 转移电子数为
转移电子数为___________ 。
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理表示为:
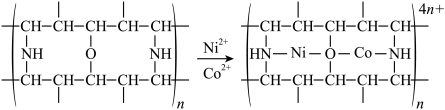
 ,
, 能发生上述转化而
能发生上述转化而 不能,推测可能的原因为
不能,推测可能的原因为___________ 。
(4)已知滤液I中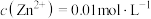 ,
,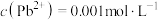 。“除锌铅”步骤中,缓慢滴加稀
。“除锌铅”步骤中,缓慢滴加稀 溶液,先产生的沉淀是(填化学式)
溶液,先产生的沉淀是(填化学式)___________ ;当 、
、 共沉时,先沉淀的物质是否已经沉淀完全(离子浓度
共沉时,先沉淀的物质是否已经沉淀完全(离子浓度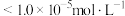 )
)___________ (填“是”或“否”)。
(5)1986年化学家用 和
和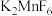 反应,首次实现了用非电解法制取
反应,首次实现了用非电解法制取 ,同时生成
,同时生成 ,已知该过程中
,已知该过程中 接受了一个
接受了一个 的电子对,请写出该反应的化学方程式
的电子对,请写出该反应的化学方程式___________ 。
 )是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含
)是一种高能氟化剂,广泛应用于制药业。工业上以一种含钛的矿渣(主要含 、
、 、
、 、
、 、
、 、
、 )为原料制取硼化钛和五氟化锑的流程如图所示。
)为原料制取硼化钛和五氟化锑的流程如图所示。
已知:①
 性质较稳定,加热时可溶于浓硫酸中形成
性质较稳定,加热时可溶于浓硫酸中形成 。
。②25℃时,
 、
、 的
的 分别为
分别为 ,
,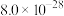 。
。(1)“水解”步骤中对应的离子方程式为
(2)硼化钛有类似石墨的层状结构,硼原子平面和钛原子平面在晶体结构中交替出现,形成二维网状结构,其投影图如下,硼化钛的化学式为
 转移电子数为
转移电子数为
(3)“除钴镍”步骤中,有机净化剂的基本组分为大分子立体网格结构的聚合物,其净化原理表示为:

 ,
, 能发生上述转化而
能发生上述转化而 不能,推测可能的原因为
不能,推测可能的原因为(4)已知滤液I中
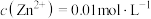 ,
,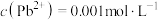 。“除锌铅”步骤中,缓慢滴加稀
。“除锌铅”步骤中,缓慢滴加稀 溶液,先产生的沉淀是(填化学式)
溶液,先产生的沉淀是(填化学式) 、
、 共沉时,先沉淀的物质是否已经沉淀完全(离子浓度
共沉时,先沉淀的物质是否已经沉淀完全(离子浓度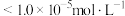 )
)(5)1986年化学家用
 和
和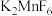 反应,首次实现了用非电解法制取
反应,首次实现了用非电解法制取 ,同时生成
,同时生成 ,已知该过程中
,已知该过程中 接受了一个
接受了一个 的电子对,请写出该反应的化学方程式
的电子对,请写出该反应的化学方程式
您最近一年使用:0次
名校
3 .  是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。
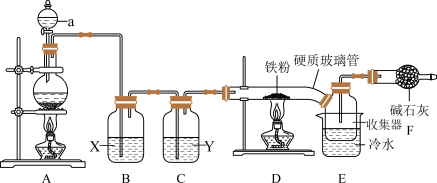
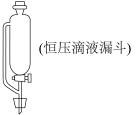
回答下列问题:
(1)A中发生的化学反应方程式是___________ 。为使实验顺利进行,可将仪器a更换为恒压滴液漏斗(如上图),更换后优点是___________ 。
(2)试剂“X”是___________ ,其作用是___________ 。
(3)硬质玻璃管直接连接收集器的优点___________ 。
(4)实验开始时,应先点燃A处酒精灯,当___________ 时,再点燃D处酒精灯。
(5)装置F作用是吸收多余氯气和___________ ,氯气和碱石灰反应时,若有0.71g氯气被氧化成次氯酸盐,1.42g氯气被氧化成氯酸盐,则被还原的氯原子的物质的量为___________ 。
 是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。
是实验室中一种常见的化学试剂,也是生产生活中常用的净水剂。 熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备
熔点为306℃,沸点为315℃,易吸收空气中的水分而潮解。巴中中学某化学兴趣设计以下装置,制备 。
。

回答下列问题:
(1)A中发生的化学反应方程式是
(2)试剂“X”是
(3)硬质玻璃管直接连接收集器的优点
(4)实验开始时,应先点燃A处酒精灯,当
(5)装置F作用是吸收多余氯气和
您最近一年使用:0次
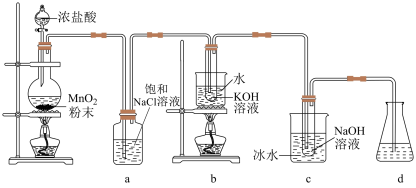
4 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域,实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。
回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是___________ ,装置a的作用是___________ 。
(2)写出b中试管内反应的化学方程式___________ 。
(3)装置c采用冰水浴冷却的目的是___________ 。
(4)反应结束后,取出b中试管,经蒸发浓缩,___________ ,___________ ,少量冷水洗涤,干燥,得到 晶体。
晶体。
(5)设计实验探究 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。
因此, 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO的氧化能力。
(6) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: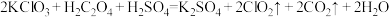 。
。
①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:___________
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为___________ 。(计算结果保留两位小数)
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响
 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是
(2)写出b中试管内反应的化学方程式
(3)装置c采用冰水浴冷却的目的是
(4)反应结束后,取出b中试管,经蒸发浓缩,
 晶体。
晶体。(5)设计实验探究
 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。| 实验操作 | 现象 | |
| Ⅰ | 取  溶液,振荡。 溶液,振荡。 | 无明显变化 |
| Ⅱ | 取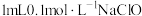 溶液于2号试管中, 溶液于2号试管中, | 出现红褐色沉淀 |
 的氧化能力
的氧化能力(6)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: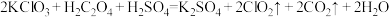 。
。①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
5 . “化肥也能爆炸”。阅读下面信息材料,回答相关问题。
硝酸铵可用作肥料;一定条件下会剧烈分解生成 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。
(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是___________ (填化学式)。
(2)根据上述材料写出工业制备硝酸铵的化学方程式___________ ,该反应___________ (填“是”或“否”)属于氧化还原反应。
(3)上述硝酸铵爆炸发生的反应为 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为___________ ,氧化产物为___________ 。
(4)某化学小组需要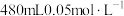 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。
①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有___________ 和___________ 。
②根据计算需用天平称取___________ g硝酸铵固体。
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制 溶液的浓度
溶液的浓度___________ (填“偏低”、“偏高”或“无影响”)。
硝酸铵可用作肥料;一定条件下会剧烈分解生成
 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是
(2)根据上述材料写出工业制备硝酸铵的化学方程式
(3)上述硝酸铵爆炸发生的反应为
 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为(4)某化学小组需要
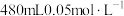 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有
②根据计算需用天平称取
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制
 溶液的浓度
溶液的浓度
您最近一年使用:0次
6 . 一氧化二氯( )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: 。
。
已知: 的部分性质如表所示
的部分性质如表所示

请回答下列问题:
(1)装置A中仪器a的名称为___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B中盛装的试剂的名称为___________ 。
(3)装置E采用冰水混合物冷却的目的是___________ 。
(4)装置F中无水 的作用是
的作用是___________ 。
(5)装置G中发生反应的离子方程式为___________ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的___________ 倍(产物视为 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
 )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: 。
。已知:
 的部分性质如表所示
的部分性质如表所示| 物理性质 | 化学性质 |
常温下, 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ |  易溶于水,同时与水反应生成 易溶于水,同时与水反应生成 |

请回答下列问题:
(1)装置A中仪器a的名称为
(2)装置B中盛装的试剂的名称为
(3)装置E采用冰水混合物冷却的目的是
(4)装置F中无水
 的作用是
的作用是(5)装置G中发生反应的离子方程式为
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
您最近一年使用:0次
名校
解题方法
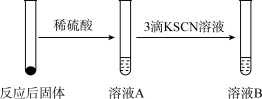
7 . 铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
Ⅰ.某学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
请回答下列问题:
(1)实验①中湿棉花、肥皂液作用分别是___________ 、___________ ;实验①中能观察到肥皂液中持续产生肥皂泡,当用燃烧着火柴靠近肥皂泡时,气泡破裂,气体燃烧,火焰呈黄色,并发出轻微的爆鸣声。解释火焰呈黄色的原因___________ ;实验①中反应的化学方程式是___________ 。
(2)实验②前,甲同学对其反应及现象进行预测:向反应后固体加入稀硫酸发生反应的离子方程式_______________ ;实验②中溶液B呈现______ 色,其中发生反应的离子方程式___________ 。
(3)实验②中,乙同学观察到溶液B未呈现红色,则溶液B未呈现红色的原因__________ (用离子方程式表示)。检验B溶液中金属离子的方法_______________ 。
Ⅱ.我国具有5000年文化,文物是活的历史。某博物馆修复出土铁器包括:检测锈蚀产物→分析腐蚀原理→脱氯→形成保护层等过程。
(4)锈蚀产物的主要成分为 、
、 、
、 、
、 、FeOCl。研究发现,出土文物
、FeOCl。研究发现,出土文物 保护层被
保护层被 氧化为
氧化为 而引起腐蚀的。
而引起腐蚀的。 中铁的化合价为
中铁的化合价为_______ 。
(5)利用在NaOH溶液中,溶解度FeOCl大于 ,对固体FeOCl进行脱氯,离子方程式为
,对固体FeOCl进行脱氯,离子方程式为_______________ 。
(6)用 把脱氯产物
把脱氯产物 还原为
还原为 ,生成1mol
,生成1mol  需要
需要___________ mol  。
。
Ⅰ.某学习小组同学继续研究铁与水蒸气的反应,分别进行了如图实验。
| 实验① | 实验② |
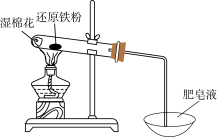 |  |
(1)实验①中湿棉花、肥皂液作用分别是
(2)实验②前,甲同学对其反应及现象进行预测:向反应后固体加入稀硫酸发生反应的离子方程式
(3)实验②中,乙同学观察到溶液B未呈现红色,则溶液B未呈现红色的原因
Ⅱ.我国具有5000年文化,文物是活的历史。某博物馆修复出土铁器包括:检测锈蚀产物→分析腐蚀原理→脱氯→形成保护层等过程。
(4)锈蚀产物的主要成分为
 、
、 、
、 、
、 、FeOCl。研究发现,出土文物
、FeOCl。研究发现,出土文物 保护层被
保护层被 氧化为
氧化为 而引起腐蚀的。
而引起腐蚀的。 中铁的化合价为
中铁的化合价为(5)利用在NaOH溶液中,溶解度FeOCl大于
 ,对固体FeOCl进行脱氯,离子方程式为
,对固体FeOCl进行脱氯,离子方程式为(6)用
 把脱氯产物
把脱氯产物 还原为
还原为 ,生成1mol
,生成1mol  需要
需要 。
。
您最近一年使用:0次
名校
解题方法
8 . 据题目要求完成下列各题:
(1)写出氯气溶于水的离子反应方程式___________ 。
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a___________ b(填>、<、=)。
(3) 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为___________ 。
(4) 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为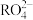 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为___________ 。
(5)已知爆炸时硝酸铵按下式分解: 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为___________ 。
(6)高铁酸钠( )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。
①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:________

②每转移3mol电子,生成 的物质的量为
的物质的量为___________ mol。
(1)写出氯气溶于水的离子反应方程式
(2)将4.6g金属钠投入到足量水中,得ag溶液;将4.8g金属镁投入到足量盐酸中,得bg溶液,假设水的质量与盐酸的质量相等,则反应后两溶液的质量关系式为a
(3)
 在碱性溶液中可被NaClO氧化为
在碱性溶液中可被NaClO氧化为 ,而NaClO被还原为NaCl。若反应中
,而NaClO被还原为NaCl。若反应中 与NaClO的物质的量之比为1:13,则x的值为
与NaClO的物质的量之比为1:13,则x的值为(4)
 离子在一定条件下可以把
离子在一定条件下可以把 离子氧化,若反应后
离子氧化,若反应后 离子变为
离子变为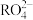 离子,又知反应中氧化剂和还原剂的物质的量之比为5:2,
离子,又知反应中氧化剂和还原剂的物质的量之比为5:2, 离子被氧化后的化合价为
离子被氧化后的化合价为(5)已知爆炸时硝酸铵按下式分解:
 。则该反应中被氧化和被还原的N原子数之比为
。则该反应中被氧化和被还原的N原子数之比为(6)高铁酸钠(
 )是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化
)是高效的饮用水处理剂,可在碱性溶液环境下由NaClO溶液氧化 制得。
制得。①请配平以下化学反应方程式,并用单线桥标出电子转移的方向和数目:

②每转移3mol电子,生成
 的物质的量为
的物质的量为
您最近一年使用:0次
2023-11-29更新
|
323次组卷
|
2卷引用:河北省秦皇岛市第一中学2023-2024学年高一上学期期中考试化学试题
解题方法
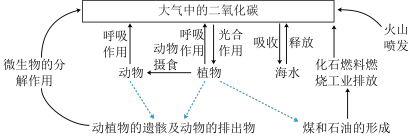
9 . 二氧化碳的捕捉与封存是未来实现低碳经济转型的重要途径。
(1)自然界中 主要循环方式如图所示,其中属于“二氧化碳的捕捉与封存”的除了“海水吸收”外,还有
主要循环方式如图所示,其中属于“二氧化碳的捕捉与封存”的除了“海水吸收”外,还有___________ (任写一点)。
(2)科学家设计出烧碱溶液捕捉 法,原理如图所示
法,原理如图所示

①该过程中能实现再生的反应为 和
和___________ 。
②若喷洒完 的
的 溶液后,测得吸收液中的
溶液后,测得吸收液中的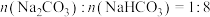 ,则被吸收的
,则被吸收的 在标况下的体积为
在标况下的体积为___________ L。
③下列溶液中,也能用作“捕捉”二氧化碳试剂的是___________ (填序号)。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀硫酸
溶液 D.稀硫酸
(3)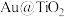 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如下左图所示。制得的甲烷
封存和能量储存双重效果,其原理如下左图所示。制得的甲烷 通过两步法可制取
通过两步法可制取 ,原理如下右图所示。
,原理如下右图所示。


①已知 中
中 为
为 价,则空心球催化剂技术中获得的
价,则空心球催化剂技术中获得的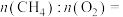
___________ 。
②写出步骤ii的化学方程式并用单线桥表示出电子转移的方向和数目___________ 。
③若不考虑过程中原料损失,则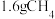 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为___________ 。
(1)自然界中
 主要循环方式如图所示,其中属于“二氧化碳的捕捉与封存”的除了“海水吸收”外,还有
主要循环方式如图所示,其中属于“二氧化碳的捕捉与封存”的除了“海水吸收”外,还有
(2)科学家设计出烧碱溶液捕捉
 法,原理如图所示
法,原理如图所示
①该过程中能实现再生的反应为
 和
和②若喷洒完
 的
的 溶液后,测得吸收液中的
溶液后,测得吸收液中的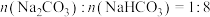 ,则被吸收的
,则被吸收的 在标况下的体积为
在标况下的体积为
③下列溶液中,也能用作“捕捉”二氧化碳试剂的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液 D.稀硫酸
溶液 D.稀硫酸(3)
 蛋黄型空心球催化剂技术实现了
蛋黄型空心球催化剂技术实现了 封存和能量储存双重效果,其原理如下左图所示。制得的甲烷
封存和能量储存双重效果,其原理如下左图所示。制得的甲烷 通过两步法可制取
通过两步法可制取 ,原理如下右图所示。
,原理如下右图所示。

①已知
 中
中 为
为 价,则空心球催化剂技术中获得的
价,则空心球催化剂技术中获得的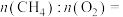
②写出步骤ii的化学方程式并用单线桥表示出电子转移的方向和数目
③若不考虑过程中原料损失,则
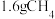 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为
您最近一年使用:0次
10 . K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于_______ (填“酸”、“碱”或“盐”)。
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了_______ mole-,该高铁酸钾样品的纯度为_______ 。(用质量分数表示)
③高铁酸钾可用于消毒的原因是_______ 。
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是_______ 。
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是_______ ;
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了
③高铁酸钾可用于消毒的原因是
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和NaHCO3溶液 |
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是
您最近一年使用:0次



