15-16高二下·河北石家庄·期末
名校
解题方法
1 . 把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
| A.反应后生成的盐只为Fe(NO3)3 |
| B.反应后生成的盐只为Fe(NO3)2 |
| C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3 |
| D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1 |
您最近一年使用:0次
2022-07-16更新
|
748次组卷
|
13卷引用:专题07 铁及其化合物(核心精讲)——【新教材精创】2019-2020学年高中化学新教材知识讲学
(已下线)专题07 铁及其化合物(核心精讲)——【新教材精创】2019-2020学年高中化学新教材知识讲学2015-2016学年河北省石家庄一中高二下期末化学试卷【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题新疆阿瓦提县多浪乡中学2019届高三毕业班第二次质量检测理综化学试题吉林省靖宇县一中2020届高三上学期9月月考化学试题福建省福州市第三中学2019-2020学年上学期高三9月月考化学试题2020届人教版高中化学高三专题基础复习专题3《金属及其化合物》测试卷专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》浙江省东阳中学2020-2021学年高二上学期10月阶段考试化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练安徽合肥一六八中学2021-2022学年高三下学第二次调研化学试题辽宁省沈阳市东北育才学校高三上学期10月第一次模拟考试化学试题
10-11高二上·甘肃武威·阶段练习
名校
解题方法
2 . 在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量之比为3:2:1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变为1:2:4,则参加反应的铁粉和原溶液中Fe3+的物质的量之比为
| A.2:1 | B.1:2 | C.1:3 | D.1:4 |
您最近一年使用:0次
2021-09-09更新
|
1678次组卷
|
28卷引用:3.1.2 铁的氢氧化物 铁盐和亚铁盐练习(1)——《高中新教材同步备课》(人教版 必修第一册)
(已下线)3.1.2 铁的氢氧化物 铁盐和亚铁盐练习(1)——《高中新教材同步备课》(人教版 必修第一册)人教版(2019)高一必修第一册第三章 铁 金属材料 素养拓展区(已下线)8.1 铁及其化合物-2020-2021学年秋季班高二上学期化学教材知识点精讲练(沪科版)(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)(已下线)2010年甘肃省武威五中高二11月月考化学试卷2015届河北省邯郸市高三上学期1月教学质量检测化学试卷2014-2015江西省新余市高一上学期期末考试化学试卷2014-2015学年辽宁师大附中高二下学期期末考试化学试卷2015-2016学年陕西省长安区一中高一上期末化学试卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【押题专练】【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题安徽省阜阳市第三中学2018-2019学年高一上学期小期末考试(期末模拟)化学试题河北省大名县第一中学2020届高三9月月考化学试题河北省武安市第一中学2020届高三9月月考化学试题甘肃省兰州市第一中学2020届高三9月月考化学试题宁夏石嘴山市第三中学2019-2020学年高一上学期第二次(12月)月考化学试题安徽省安庆一中2018-2019学年高一上学期期末考试化学试题安徽省太和第一中学2019-2020学年高一上学期期末考试化学试题人教版高中化学必修1第三章《金属及其化合物》测试卷2专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)人教版(2019)高一必修第一册 第三章素养检测江西省鹰潭市第一中学2021届高三上学期期中考试化学试题重庆市三峡名校联盟2020-2021学年高一上学期12月联考化学试题四川省仁寿第一中学校南校区2020-2021学年高一下学期开学考试化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高三上学期期中考试化学试题广东省普宁市华侨中学2021—2022学年高一上学期第三次月考化学试题陕西省延安子长市中学2021-2022学年高三上学期期中考试化学试题
20-21高二下·辽宁铁岭·期末
名校
3 . 利用 氧化尿素制备
氧化尿素制备 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示: 有强还原性,能与
有强还原性,能与 剧烈反应生成
剧烈反应生成 。
。
下列说法不正确的是
 氧化尿素制备
氧化尿素制备 (水合肼)的实验流程如图所示:
(水合肼)的实验流程如图所示: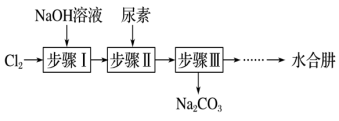
 有强还原性,能与
有强还原性,能与 剧烈反应生成
剧烈反应生成 。
。下列说法不正确的是
| A.步骤Ⅰ中为避免温度过高,可采用冰水浴 |
B.步骤Ⅰ制备 溶液时,测得产物中 溶液时,测得产物中 与 与 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为5∶3 |
C.步骤Ⅱ中可将尿素水溶液逐滴滴入 碱性溶液中 碱性溶液中 |
D.生成水合肼反应的离子方程式为ClO﹣+CO(NH2)2+2OH﹣=Cl-+N2H4•H2O+CO |
您最近一年使用:0次
2021-07-24更新
|
1552次组卷
|
9卷引用:第二章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
(已下线)第二章 单元检测-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)辽宁省铁岭市六校2020-2021学年高二下学期期末联考化学试题山西省运城市2021-2022学年高三上学期期中考试化学试题2021年北京高考化学试题变式题1-10 河南大学附属中学2022-2023学年高一下学期第一次月考化学试题江苏省南菁高级中学2023-2024学年高一上学期9月阶段性检测化学(创优班)试题江苏省南京市第九中学2023-2024学年高一上学期10月阶段学情调研化学试题江苏省苏州市吴县中学2023-2024学年高一上学期12月月考化学试题四川省成都市树德中学2023-2024学年高一下学期3月月考化学试题
4 . SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下化学反应:①SO2+2Fe3++2H2O=SO +2Fe2++4H+;②Cr2O
+2Fe2++4H+;②Cr2O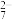 +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
 +2Fe2++4H+;②Cr2O
+2Fe2++4H+;②Cr2O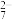 +6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是
+6Fe2++14H+=2Cr3++6Fe3++7H2O。则下列有关说法不正确的是A.氧化性:Cr2O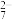 >Fe3+ >Fe3+ |
| B.标准状况下,若有6.72LSO2参加反应,则最终消耗0.2molK2Cr2O7 |
| C.反应②中,每有1molK2Cr2O7参加反应,转移电子的数目为6NA |
D.由上述反应原理推断:K2Cr2O7溶液也可以将SO2氧化成SO |
您最近一年使用:0次
2021-01-27更新
|
497次组卷
|
7卷引用:章末检测卷(二) 海水中的重要元素——钠和氯
5 . 从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是
| A.Cu2S既是氧化产物又是还原产物 |
| B.5mol FeS2发生反应,有10mol电子转移 |
C.产物中的SO 离子有一部分是氧化产物 离子有一部分是氧化产物 |
| D.FeS2只作还原剂 |
您最近一年使用:0次
2021-01-12更新
|
1910次组卷
|
41卷引用:专题3 第一单元 第3课时 氧化还原反应-高中化学苏教2019版必修第一册
专题3 第一单元 第3课时 氧化还原反应-高中化学苏教2019版必修第一册(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2010年安徽省合肥八中高三上学期第二次月考化学试题(已下线)2012届浙江省杭州市高复高三上学期11月份月考化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷2016届重庆市巫山中学高三第一次质量检测化学试卷2016届辽宁省葫芦岛市高三上学期期末调研化学试卷2015-2016学年吉林松原油田高中高一下期初考试化学试卷2015-2016学年湖南省长沙长郡中学高一上期末化学试卷2016-2017学年安徽省合肥一中高一上开学测化学试卷2017届陕西省西安市第七十中学高三上学期10月月考化学试卷2017届河北辛集中学高三上理综测试三化学试卷2017届河北省定州中学高三上期中化学试卷12016-2017学年安徽省铜陵一中高一12月月考化学试卷广东省化州市2018届高三上学期第一次高考模拟考试理综化学试题辽宁省大连育明高级中学、本溪市高级中学2018届高三10月月考化学(理)试题江苏省无锡市普通高中2017-2018学年高一上学期期末考试化学试题陕西省西安市第一中学2017-2018学年高一上学期期末考试化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题福建省华安一中、长泰一中等四校2017-2018学年高一下学期第一次(4月)联考化学试题(已下线)2019年高考化学一轮复习讲练测2.3 氧化还原反应的基本概念 讲【全国百强校】陕西省西安市第一中学2019届高三上学期第一次月考化学试题【全国百强校】西藏自治区拉萨北京实验中学2019届高三上学期第二次月考化学试题【全国百强校】河北省武邑中学2019届高三上学期第四次调研考试化学试题【全国百强校】山东省临沂市蒙阴县实验中学2019届高三上学期第二次月考(12月)化学试题吉林省白城市第一中学2018-2019学年高一上学期12月月考化学试题福建省福州市八县一中2020届高三年上学期期中联考化学试题广东省深圳市实验中学2019-2020学年高一上学期期中考试化学试题安徽省滁州市定远县育才学校2019-2020学年高一(普通班)上学期第三次月考化学试题甘肃省武威第十八中学2021届高三上学期第四次诊断检测(期末)化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)江西省丰城市第九中学2021-2022学年高三上学期9月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)(已下线)押新高考卷10题 氧化还原反应-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)福建省福州市格致中学2022-2023学年高三上学期期中模拟测试化学试题山西省山西大学附属中学2022-2023学年高一上学期期中考试化学试题 新疆乌鲁木齐八一中学2023-2024学年高一上学期期中考试化学试卷
20-21高一·全国·课时练习
6 . 我国锑的蕴藏量占世界第一,锑(Sb)在自然界一般以硫化物的形式存在。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
①2Sb2S3+3O2+6Fe=Sb4O6+6FeS
②Sb4O6+6C=4Sb+6CO
下列说法正确的是
①2Sb2S3+3O2+6Fe=Sb4O6+6FeS
②Sb4O6+6C=4Sb+6CO
下列说法正确的是
| A.反应②说明高温下C的氧化性比Sb强 |
| B.反应①②中还原剂分别是Sb2S3、Sb4O6 |
| C.每生成1molSb时,反应①与反应②中还原剂的物质的量之比为2:1 |
| D.反应①中反应的Fe原子与转移电子数目之比是1:2 |
您最近一年使用:0次
7 . 等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
| A.FeO | B.Fe2O3 | C.FeSO4 | D.Fe3O4 |
您最近一年使用:0次
2019-01-30更新
|
3438次组卷
|
43卷引用:2018-2019学年高中化学鲁科版必修1 模块综合测评
2018-2019学年高中化学鲁科版必修1 模块综合测评2014年全国普通高等学校招生统一考试理科综合能力测试化学(山东卷)(已下线)2015届河南省中原名校高三上学期第一次摸底考试化学试卷2015届上海市五校高三上学期联合教学质量调研化学试卷2014-2015湖南省娄底市湘中名校高一上学期期末化学试卷2016届山西省榆社中学高三上学期10月月考化学试卷2015-2016学年山东省牟平一中高一上12月月考化学试卷2015-2016学年湖南省邵阳市邵东三中高一上学期第三次月考化学试卷2016届湖北省荆州市公安一中高三上学期12月月考化学试卷2015-2016学年黑龙江省实验中学高二下期末化学试卷2017届河北省武邑中学高三上学期9.18周考化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷广西钦州市钦州港经济技术开发区中学2018届高三上学期开学考试化学试题甘肃省临夏中学2018届高三上学期期中考试化学试题吉林省吉化一中2017-2018学年高一上学期期末考试化学试题2018-2019学年人教版高中化学必修一:非金属及其化合物章末综合测评(四)(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第一次调研考试化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第3讲 铁及其化合物【教学案】河北省隆化县存瑞中学2019届高三上学期第一次质检化学试题【全国百强校】山东省济南市外国语学校2019届高三上学期第一次月考化学试题(已下线)2019高考热点题型和提分秘籍 第三章 金属及其化合物 第3讲 铁及其化合物 (教学案)(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第4讲 氮及其化合物 (教学案)江西省上饶市“山江湖”协作体2018-2019学年高一(自主班)上学期第三次月考化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)江西省南昌市八一中学、洪都中学、十七中、实验中学四校2018-2019学年高一下学期3月联考化学试题福建省泉州市泉港区第一中学2018-2019学年高一下学期期中考试化学试题甘肃省甘谷第一中学2018-2019学年高一下学期子才班选拔考试化学试题云南省兰坪县第一中学2019-2020学年高二上学期期末考试化学试题2020年春季鲁教版高中化学必修1第3章《自然界中的元素》测试卷2020届高三化学无机化学二轮专题复习——铁及其化合物的相关计算【精编20题】新疆昌吉回族自治州玛纳斯县第一中学2018-2019学年高一下学期第一次月考化学试题江西省安福中学2019-2020学年高一(普通班)下学期3月线上考试化学试题(已下线)上海市七宝中学2014-2015学年高二上学期期中考试化学试题(已下线)专题3.5 氮及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)【南昌新东方】2019 八一、洪都 高一下 第一次月考黑龙江省哈尔滨市第一中学2019-2020 学年高二下学期期末考试化学试题云南省楚雄彝族自治州民族中学2021-2022学年高一下学期3月月考化学试题(已下线)题型27 铁及其化合物的性质、用途及相关计算(已下线)第5章 金属及其化合物 5.2 重要的金属化合物
8 . (1)5 mol的CO2与8 mol的SO2的分子数之比是________ ;原子数之比是________ ;质量比是________ 。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:________ KClO3+________HCl(浓)===________KCl+________ClO2↑+________Cl2↑+________H2O
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的________ (填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是(填写号码)________ 。
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________ 倍(保留2位小数)。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的
您最近一年使用:0次
解题方法
9 . N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第_______ 周期第_______ 族;N与O的基态原子核外未成对电子个数比为_______ ;Cu的基态原子电子排布式为_______ 。
(2)用“>”或“<”填空:
碱性:Mg(OH)2_______ Cu(OH)2
第一电离能:O_______ N
熔点:MgS_______ MgO
稳定性:H2S_______ H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为_______ 。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目_______ 。
(1)Mg位于元素周期表第
(2)用“>”或“<”填空:
碱性:Mg(OH)2
第一电离能:O
熔点:MgS
稳定性:H2S
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次
2016-12-09更新
|
455次组卷
|
2卷引用:人教版2017-2018学年高一化学必修2:第一章 第一节 难度偏大尖子生题



