解题方法
1 . 按要求回答下列问题:
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有___________ (填字母,下同),属于酸性氧化物的有___________ 。
②Fe2(SO4)3溶于水的电离方程式为___________ 。
③写出实验室制取Fe(OH)3胶体的离子方程式:___________ 。
④写出H与足量A反应的离子方程式:___________ 。
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:___________ 。

②该反应中的还原剂为___________ (填化学式),被还原的物质与被氧化的物质的物质的量之比为___________ 。
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=___________ 。
(1)现有8种物质:A.稀硫酸;B.Fe2(SO4)3溶液;C.CO;D.熔融的NaNO3;E.SO2;F.Fe(OH)3胶体;G.NH4NO3固体;H.Na2CO3溶液。
①能导电的电解质有
②Fe2(SO4)3溶于水的电离方程式为
③写出实验室制取Fe(OH)3胶体的离子方程式:
④写出H与足量A反应的离子方程式:
(2)①甲烷(甲烷中C的化合价为-4)在厌氧氧化菌的作用下,可以和氢氧化铁发生如下反应,配平该离子方程式:

②该反应中的还原剂为
(3)无氧条件下加热蓝铁矿(无杂质),发生反应的化学方程式为
 ,蓝铁矿的质量由10.04g减小到7.16g,则n=
,蓝铁矿的质量由10.04g减小到7.16g,则n=
您最近一年使用:0次
解题方法
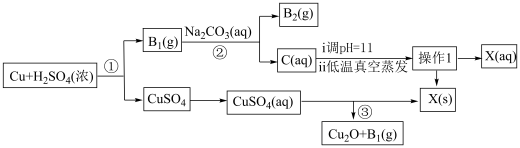
2 . 一种制备 的工艺路线如图所示
的工艺路线如图所示
已知:ⅰ.常温下, 的电离平衡常数
的电离平衡常数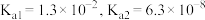
ⅱ.反应②所得C溶液 在
在 之间
之间
ⅲ.反应③需及时补加 以保持反应在
以保持反应在 条件下进行。
条件下进行。
(1)反应①中氧化剂与还原剂物质的量之比为___________ ,溶液C的溶质为___________ (填化学式)。
(2)低温真空蒸发主要目的是___________ ,操作1的名称为___________ 。
(3)写出流程中可以循环利用的物质___________ (填化学式)。
(4)写出反应③的化学反应方程式___________ 。
(5)若 产量不变,参与反应③的X与
产量不变,参与反应③的X与 物质的量之比
物质的量之比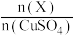 增大时,需补加
增大时,需补加 的量
的量___________ (填“减少”或“增多”或“不变”)。
 的工艺路线如图所示
的工艺路线如图所示
已知:ⅰ.常温下,
 的电离平衡常数
的电离平衡常数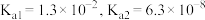
ⅱ.反应②所得C溶液
 在
在 之间
之间ⅲ.反应③需及时补加
 以保持反应在
以保持反应在 条件下进行。
条件下进行。(1)反应①中氧化剂与还原剂物质的量之比为
(2)低温真空蒸发主要目的是
(3)写出流程中可以循环利用的物质
(4)写出反应③的化学反应方程式
(5)若
 产量不变,参与反应③的X与
产量不变,参与反应③的X与 物质的量之比
物质的量之比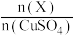 增大时,需补加
增大时,需补加 的量
的量
您最近一年使用:0次
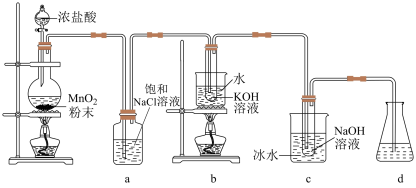
3 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域,实验室中利用如图装置(部分装置省略)制备 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。
回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是___________ ,装置a的作用是___________ 。
(2)写出b中试管内反应的化学方程式___________ 。
(3)装置c采用冰水浴冷却的目的是___________ 。
(4)反应结束后,取出b中试管,经蒸发浓缩,___________ ,___________ ,少量冷水洗涤,干燥,得到 晶体。
晶体。
(5)设计实验探究 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。
因此, 的氧化能力
的氧化能力___________ (填“大于”或“小于”)NaClO的氧化能力。
(6) 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: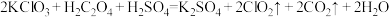 。
。
①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:___________
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为___________ 。(计算结果保留两位小数)
 和NaClO,并探究其氧化还原性质。
和NaClO,并探究其氧化还原性质。
已知:温度会影响
 与碱反应氧化产物的价态。
与碱反应氧化产物的价态。回答下列问题:
(1)发生装置中添加浓盐酸的仪器名称是
(2)写出b中试管内反应的化学方程式
(3)装置c采用冰水浴冷却的目的是
(4)反应结束后,取出b中试管,经蒸发浓缩,
 晶体。
晶体。(5)设计实验探究
 和NaClO氧化性强弱。实验方案如下,完成下列表格。
和NaClO氧化性强弱。实验方案如下,完成下列表格。| 实验操作 | 现象 | |
| Ⅰ | 取  溶液,振荡。 溶液,振荡。 | 无明显变化 |
| Ⅱ | 取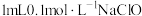 溶液于2号试管中, 溶液于2号试管中, | 出现红褐色沉淀 |
 的氧化能力
的氧化能力(6)
 是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得:
是一种新型含氯消毒剂,已经开始在自来水消毒领域使用。实验室可通过以下反应制得: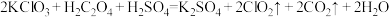 。
。①请在答题卡上用单线桥表示该反应中电子转移的方向和数目:
②“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。
的氧化能力(消毒过程中,物质所得电子数相等,认为氧化能力相等)。 的有效氯含量为
的有效氯含量为
您最近一年使用:0次
4 . “化肥也能爆炸”。阅读下面信息材料,回答相关问题。
硝酸铵可用作肥料;一定条件下会剧烈分解生成 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。
(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是___________ (填化学式)。
(2)根据上述材料写出工业制备硝酸铵的化学方程式___________ ,该反应___________ (填“是”或“否”)属于氧化还原反应。
(3)上述硝酸铵爆炸发生的反应为 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为___________ ,氧化产物为___________ 。
(4)某化学小组需要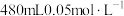 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。
①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有___________ 和___________ 。
②根据计算需用天平称取___________ g硝酸铵固体。
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制 溶液的浓度
溶液的浓度___________ (填“偏低”、“偏高”或“无影响”)。
硝酸铵可用作肥料;一定条件下会剧烈分解生成
 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是
(2)根据上述材料写出工业制备硝酸铵的化学方程式
(3)上述硝酸铵爆炸发生的反应为
 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为(4)某化学小组需要
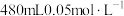 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有
②根据计算需用天平称取
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制
 溶液的浓度
溶液的浓度
您最近一年使用:0次
名校
解题方法
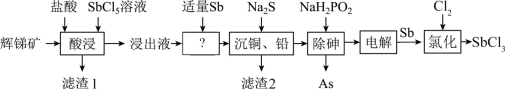
5 . SbCl3用于红外光谱分析以及显像管生产等。工业生产中,以辉锑矿(主要成分为的Sb2S3,还含有As2S3、PbS、CuO和SiO2等)为原料制备SbCl3的工艺流程如下:
②常温下, ,
, ;
;
③溶液中离子浓度小于或等于 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。
回答下列问题:
(1)加快辉锑矿“酸浸”的措施有 。
(2)滤渣1中除了S之外,还有__________ 。
(3)浸出液中加入适量Sb的目的是________________________ 。(用化学方程式表示)
(4)已知浸出液中c(Cu2+)=0.01mol/L、c(Pb2+)=0.10mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是__________ (填化学式);常温下,“除铜、铅”时Cu2+和Pb2+均沉淀完全,此时溶液中 不低于
不低于__________ mol/L,Na2S也不宜过多,其原因为__________________ 。
(5)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为___________ ;已知在“电解”SbCl3溶液时,无气体生成,被氧化的Sb元素与被还原的Sb元素的质量之比为3:2,可在上述流程中循环利用的物质有_________________ 。
②常温下,
 ,
, ;
;③溶液中离子浓度小于或等于
 mol/L时,认为该离子沉淀完全。
mol/L时,认为该离子沉淀完全。回答下列问题:
(1)加快辉锑矿“酸浸”的措施有 。
| A.将辉锑矿粉碎 | B.用酒精灯加热 | C.用玻璃棒搅拌 | D.适当增加酸液浓度 |
(3)浸出液中加入适量Sb的目的是
(4)已知浸出液中c(Cu2+)=0.01mol/L、c(Pb2+)=0.10mol/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是
 不低于
不低于(5)在“除砷”过程中,氧化产物为H3PO4,则该反应中氧化剂、还原剂的物质的量之比为
您最近一年使用:0次
2024-01-13更新
|
450次组卷
|
5卷引用:河北省廊坊市廊坊卓越艺术职业中学2023-2024学年高二上学期1月期末化学试题
6 . 一氧化二氯( )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: 。
。
已知: 的部分性质如表所示
的部分性质如表所示

请回答下列问题:
(1)装置A中仪器a的名称为___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B中盛装的试剂的名称为___________ 。
(3)装置E采用冰水混合物冷却的目的是___________ 。
(4)装置F中无水 的作用是
的作用是___________ 。
(5)装置G中发生反应的离子方程式为___________ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的___________ 倍(产物视为 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
 )是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集
)是高效安全的杀菌消毒剂,某兴趣小组用下图所示装置制备并收集 ,反应的原理如下:
,反应的原理如下: 。
。已知:
 的部分性质如表所示
的部分性质如表所示| 物理性质 | 化学性质 |
常温下, 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ 是棕黄色、有刺激性气味的气体;熔点:-120.6℃;沸点2.0℃ |  易溶于水,同时与水反应生成 易溶于水,同时与水反应生成 |

请回答下列问题:
(1)装置A中仪器a的名称为
(2)装置B中盛装的试剂的名称为
(3)装置E采用冰水混合物冷却的目的是
(4)装置F中无水
 的作用是
的作用是(5)装置G中发生反应的离子方程式为
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的 ,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
,消毒效率以单位质量得到的电子数表示,结果精确到0.01)。
您最近一年使用:0次
名校
解题方法
7 . ClO2又称百毒净,可用于水的净化和纸张、纺织品的漂白。用如图所示装置(夹持装置和加热装置省略)制备ClO2并探究ClO2的某些性质。
(1)仪器a的名称为_______ 。
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为_______ 。
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的_______ 性。若关闭止水夹③,打开止水夹②,B中可观察到的现象为_______ 。
(4)D装置的作用是_______ 。
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的_______ 倍(结果保留两位小数)。
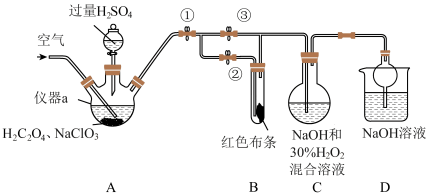
(1)仪器a的名称为
(2)装置A用于制备ClO2且生成的ClO2中混有CO2,该反应的化学方程式为
(3)关闭止水夹②,打开止水夹①③,通空气一段时间后,装置C中生成了NaClO2和气体,该反应体现了H2O2的
(4)D装置的作用是
(5)城市饮用水处理,新技术用NaClO2替代Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么消毒杀菌剂NaClO2的消毒效率是Cl2的
您最近一年使用:0次
2023-10-04更新
|
228次组卷
|
2卷引用:江西省宜春市宜丰中学2022-2023学年高一上学期期末考试化学试题
解题方法
8 . 含氮化合物对生态环境和人类健康都有一定的影响,必须采取相应的措施来治理或加以控制。
(1)生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图-1所示。

① 的空间构型为
的空间构型为___________ 。
②每处理含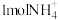 的酸性废水,理论上消耗
的酸性废水,理论上消耗 的物质的量为
的物质的量为___________ 。
③上述生物硝化反硝化法的优点是___________ 。
(2)折点加氯法是将次氯酸钠投入废水中,将废水中的氨氮转化为 的化学脱氮工艺。设定反应温度为
的化学脱氮工艺。设定反应温度为 ,向含
,向含 的酸性废水中投加
的酸性废水中投加 时,
时, 浓度、氯胺(
浓度、氯胺( )浓度与投入的
)浓度与投入的 溶液体积的关系如图-2所示。
溶液体积的关系如图-2所示。

①在酸性废水中,投入的 在
在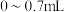 过程中发生的反应为
过程中发生的反应为 。投入量在
。投入量在 的过程中反应的离子方程式为
的过程中反应的离子方程式为___________ 。
②实验证明,弱酸性有助于提高废水中氮的脱除率,其原因是___________ 。
(3)腌制食品中亚硝酸盐允许残留量(以 计)
计) 。为测定某咸菜中亚硝酸盐的残留量,取
。为测定某咸菜中亚硝酸盐的残留量,取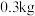 咸菜榨汁,经处理得无色溶液,将所得溶液转移至
咸菜榨汁,经处理得无色溶液,将所得溶液转移至 容量瓶并定容。取出
容量瓶并定容。取出 溶液置于锥形瓶中,加入盐酸调节
溶液置于锥形瓶中,加入盐酸调节 ,再滴加
,再滴加 至过量,待反应完成后用
至过量,待反应完成后用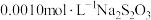 标准液滴定,共消耗体积为
标准液滴定,共消耗体积为 。则该市售咸菜的亚硝酸盐残留量是否符合安全标准。(写出计算过程)
。则该市售咸菜的亚硝酸盐残留量是否符合安全标准。(写出计算过程) ______ 。
已知: ;
;
(1)生物硝化反硝化法可将酸性废水中的氨氮转化为氮气,其原理如图-1所示。

①
 的空间构型为
的空间构型为②每处理含
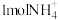 的酸性废水,理论上消耗
的酸性废水,理论上消耗 的物质的量为
的物质的量为③上述生物硝化反硝化法的优点是
(2)折点加氯法是将次氯酸钠投入废水中,将废水中的氨氮转化为
 的化学脱氮工艺。设定反应温度为
的化学脱氮工艺。设定反应温度为 ,向含
,向含 的酸性废水中投加
的酸性废水中投加 时,
时, 浓度、氯胺(
浓度、氯胺( )浓度与投入的
)浓度与投入的 溶液体积的关系如图-2所示。
溶液体积的关系如图-2所示。
①在酸性废水中,投入的
 在
在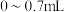 过程中发生的反应为
过程中发生的反应为 。投入量在
。投入量在 的过程中反应的离子方程式为
的过程中反应的离子方程式为②实验证明,弱酸性有助于提高废水中氮的脱除率,其原因是
(3)腌制食品中亚硝酸盐允许残留量(以
 计)
计) 。为测定某咸菜中亚硝酸盐的残留量,取
。为测定某咸菜中亚硝酸盐的残留量,取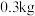 咸菜榨汁,经处理得无色溶液,将所得溶液转移至
咸菜榨汁,经处理得无色溶液,将所得溶液转移至 容量瓶并定容。取出
容量瓶并定容。取出 溶液置于锥形瓶中,加入盐酸调节
溶液置于锥形瓶中,加入盐酸调节 ,再滴加
,再滴加 至过量,待反应完成后用
至过量,待反应完成后用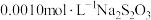 标准液滴定,共消耗体积为
标准液滴定,共消耗体积为 。则该市售咸菜的亚硝酸盐残留量是否符合安全标准。(写出计算过程)
。则该市售咸菜的亚硝酸盐残留量是否符合安全标准。(写出计算过程) 已知:
 ;
;
您最近一年使用:0次
9 . 回答下列问题:
(1)复旦大学、北京大学和上海电力大学等的研究团队共同报道了一种新型NASICON相铁基磷酸盐负极材料 ,
, 放电后生成
放电后生成 。回答下列问题:
。回答下列问题:
①基态 的价电子排布式为
的价电子排布式为___________ 。
② 中
中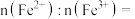
___________ 。
(2)一组同学对铁和稀硝酸的反应进行探究。他们用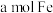 和含有
和含有 的稀硝酸进行实验,若
的稀硝酸进行实验,若 只被还原成
只被还原成 ,且反应结束后溶液中含有
,且反应结束后溶液中含有 和
和 。若反应结束后的溶液中
。若反应结束后的溶液中 ,则
,则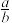 的值为
的值为___________ 。
(3)“纳米零价铁- ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的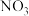 。在一定温度下,将
。在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
① 催化
催化 分解产生
分解产生 ,
, 将NO氧化为
将NO氧化为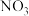 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为___________ 。

②纳米零价铁的作用是___________ 。
(4)制备黄血盐 可以由
可以由 与KCN直接在溶液中作用而合成,但制备赤血盐
与KCN直接在溶液中作用而合成,但制备赤血盐 ,却不能直接用
,却不能直接用 离子与
离子与 直接作用而得,而是采用氧化剂
直接作用而得,而是采用氧化剂 或
或 将黄血盐氧化为赤血盐。
将黄血盐氧化为赤血盐。 在性质上与卤离子
在性质上与卤离子 相似,而
相似,而 则似游离卤素
则似游离卤素 ,故
,故 称为拟卤素。
称为拟卤素。
① 中含有的
中含有的 键数目为
键数目为___________ 。
②用离子方程式表示不能用 与KCN直接反应制备赤血盐的原因是
与KCN直接反应制备赤血盐的原因是___________ 。
③写出采用 氧化黄血盐制备赤血盐的化学方程式:
氧化黄血盐制备赤血盐的化学方程式:___________ 。
(1)复旦大学、北京大学和上海电力大学等的研究团队共同报道了一种新型NASICON相铁基磷酸盐负极材料
 ,
, 放电后生成
放电后生成 。回答下列问题:
。回答下列问题:①基态
 的价电子排布式为
的价电子排布式为②
 中
中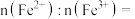
(2)一组同学对铁和稀硝酸的反应进行探究。他们用
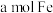 和含有
和含有 的稀硝酸进行实验,若
的稀硝酸进行实验,若 只被还原成
只被还原成 ,且反应结束后溶液中含有
,且反应结束后溶液中含有 和
和 。若反应结束后的溶液中
。若反应结束后的溶液中 ,则
,则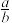 的值为
的值为(3)“纳米零价铁-
 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的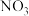 。在一定温度下,将
。在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。①
 催化
催化 分解产生
分解产生 ,
, 将NO氧化为
将NO氧化为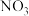 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为
②纳米零价铁的作用是
(4)制备黄血盐
 可以由
可以由 与KCN直接在溶液中作用而合成,但制备赤血盐
与KCN直接在溶液中作用而合成,但制备赤血盐 ,却不能直接用
,却不能直接用 离子与
离子与 直接作用而得,而是采用氧化剂
直接作用而得,而是采用氧化剂 或
或 将黄血盐氧化为赤血盐。
将黄血盐氧化为赤血盐。 在性质上与卤离子
在性质上与卤离子 相似,而
相似,而 则似游离卤素
则似游离卤素 ,故
,故 称为拟卤素。
称为拟卤素。①
 中含有的
中含有的 键数目为
键数目为②用离子方程式表示不能用
 与KCN直接反应制备赤血盐的原因是
与KCN直接反应制备赤血盐的原因是③写出采用
 氧化黄血盐制备赤血盐的化学方程式:
氧化黄血盐制备赤血盐的化学方程式:
您最近一年使用:0次
名校
解题方法
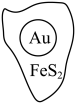
10 . 抗原检测盒中T线处使用的是胶体金(Au)标记物。一种从被 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:
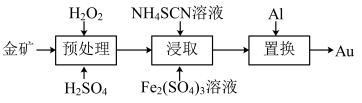
(1)①“预处理”时,用 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式______ 。
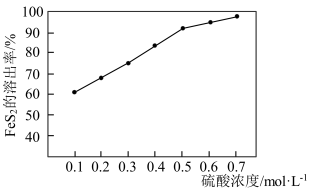
②研究发现:在 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是________ 。
(2)“置换”时需维持无氧环境,其主要原因是_________ 。
(3)测定样品中 的含量:准确称取
的含量:准确称取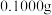 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸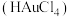 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量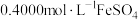 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用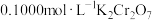 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。
已知: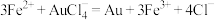

计算样品中金的质量分数(写出计算过程)_____________ 。
 包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去
包裹的含金矿物(如图)中提取金单质的过程为:将金矿进行预处理,可除去 而露出金矿物,再加入
而露出金矿物,再加入 溶液和
溶液和 溶液对金矿物进行浸取,得到含金的溶液,然后加入
溶液对金矿物进行浸取,得到含金的溶液,然后加入 置换出
置换出 。其工艺流程如下:
。其工艺流程如下:

(1)①“预处理”时,用
 将
将 直接氧化为
直接氧化为 和硫酸,写出该反应的化学方程式
和硫酸,写出该反应的化学方程式②研究发现:在
 的催化作用下,
的催化作用下, 产生具有强氧化能力的中间体
产生具有强氧化能力的中间体 ,
, 将金表面的
将金表面的 氧化溶出,
氧化溶出, 越多,
越多, 溶出率越高.
溶出率越高. 溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大,
溶出率与硫酸初始浓度的关系如图所示,随着硫酸初始浓度的增大, 溶出率逐渐提高的主要原因是
溶出率逐渐提高的主要原因是
(2)“置换”时需维持无氧环境,其主要原因是
(3)测定样品中
 的含量:准确称取
的含量:准确称取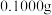 试样,加入王水,将样品中的
试样,加入王水,将样品中的 完全转化成具有强氧化性的氯金酸
完全转化成具有强氧化性的氯金酸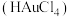 ,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量
,在除去硝酸根后的溶液中,边不断搅拌,边向溶液中加入过量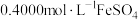 溶液
溶液 ,将
,将 完全还原为
完全还原为 ,滴加二苯胺磺酸钠作指示剂,用
,滴加二苯胺磺酸钠作指示剂,用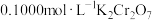 标准溶液滴定至终点(将剩余的
标准溶液滴定至终点(将剩余的 恰好完全氧化),消耗
恰好完全氧化),消耗 溶液
溶液 。
。已知:
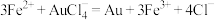

计算样品中金的质量分数(写出计算过程)
您最近一年使用:0次
2023-04-25更新
|
923次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一上学期期末考试化学试题



