解题方法
1 . 某校化学研究学习小组设计实验验证NH3能还原CuO,实验装置如下图。

请回答下列问题:
(1)A装置中反应的化学方程式为_______ 。
(2)B装置中盛放的试剂是_______ ;D装置仪器的名称为_______ 。
(3)甲同学认为该实验装置不严谨,应在装置D后连接一个盛有浓硫酸的试剂瓶,其目的是____ 。
(4)证明NH3能与CuO反应的实验现象是_______ 。
(5)若NH3还原CuO的还原产物唯一且生成无毒无污染气体,则C反应中氧化产物与还原产物的物质的量之比为_______ 。
(6)已知该反应受NH3用量和反应温度影响,有时会生成副产物Cu2O,Cu2O为砖红色,易对实验结论产生干扰。已知Cu2O在酸性溶液中不稳定: ,请设计实验方案验证CuO完全反应后的红色固体产物中是否含有Cu2O
,请设计实验方案验证CuO完全反应后的红色固体产物中是否含有Cu2O_______ 。

请回答下列问题:
(1)A装置中反应的化学方程式为
(2)B装置中盛放的试剂是
(3)甲同学认为该实验装置不严谨,应在装置D后连接一个盛有浓硫酸的试剂瓶,其目的是
(4)证明NH3能与CuO反应的实验现象是
(5)若NH3还原CuO的还原产物唯一且生成无毒无污染气体,则C反应中氧化产物与还原产物的物质的量之比为
(6)已知该反应受NH3用量和反应温度影响,有时会生成副产物Cu2O,Cu2O为砖红色,易对实验结论产生干扰。已知Cu2O在酸性溶液中不稳定:
 ,请设计实验方案验证CuO完全反应后的红色固体产物中是否含有Cu2O
,请设计实验方案验证CuO完全反应后的红色固体产物中是否含有Cu2O
您最近一年使用:0次
名校
解题方法
2 . 无机流程8.碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1) 的一种制备方法如下图所示:
的一种制备方法如下图所示:

①加入Fe粉进行转化反应的离子方程式为___________ ,生成的沉淀与硝酸反应,生成___________ 后可循环使用。
②通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为___________ ;若反应物用量比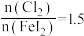 时,氧化产物为
时,氧化产物为___________ ;当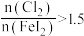 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是___________ 。
(2)以 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成碘化物,离子方程式为
,生成碘化物,离子方程式为___________ 。再向混合溶液中加入 溶液,反应得到
溶液,反应得到 ,离子方程式为
,离子方程式为___________ 。
(3) 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成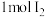 ,消耗的
,消耗的 至少为
至少为___________  。
。 在
在 溶液中可发生反应
溶液中可发生反应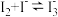 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是___________ 。
(4)向含SO 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
(1)
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
①加入Fe粉进行转化反应的离子方程式为
②通入
 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为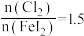 时,氧化产物为
时,氧化产物为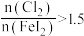 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是(2)以
 为原料制备
为原料制备 的方法是:先向
的方法是:先向 溶液中加入计量的
溶液中加入计量的 ,生成碘化物,离子方程式为
,生成碘化物,离子方程式为 溶液,反应得到
溶液,反应得到 ,离子方程式为
,离子方程式为(3)
 溶液和
溶液和 溶液混合可生成
溶液混合可生成 沉淀和
沉淀和 ,若生成
,若生成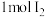 ,消耗的
,消耗的 至少为
至少为 。
。 在
在 溶液中可发生反应
溶液中可发生反应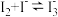 。实验室中使用过量的
。实验室中使用过量的 与
与 溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量
溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量 的原因是
的原因是(4)向含SO
 、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是
、Fe2+、Br-、I-各0.1 mol的溶液中通入标准状况下的Cl2,通入Cl2的体积和溶液中相关离子的物质的量的关系图正确的是A.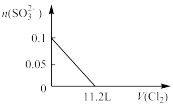 | B.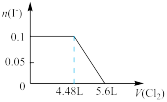 | C. | D. |
您最近一年使用:0次
名校
3 . 现有 的
的 ,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的
,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的 能和浓盐酸反应放出
能和浓盐酸反应放出 。
。 受热可分解为
受热可分解为 的+4、+2价的混合氧化物并放出
的+4、+2价的混合氧化物并放出 )。则下列说法中正确的是
)。则下列说法中正确的是
 的
的 ,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的
,将其加热并发生反应,并检测放出的气体1的质量,后向剩余固体a中加入足量的浓盐酸,并检测放出的气体2的质量。(已知,+4价的 能和浓盐酸反应放出
能和浓盐酸反应放出 。
。 受热可分解为
受热可分解为 的+4、+2价的混合氧化物并放出
的+4、+2价的混合氧化物并放出 )。则下列说法中正确的是
)。则下列说法中正确的是A.气体1的物质的量最多为 |
B.若物质的量,气体 气体 气体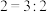 ,则固体的成分为物质的量之比可能为 ,则固体的成分为物质的量之比可能为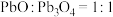 |
C.若物质的量,气体 气体 气体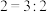 ,则固体a的成分为物质的量之比可能为 ,则固体a的成分为物质的量之比可能为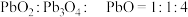 |
D.气体总物质的量可能为 |
您最近一年使用:0次
2022-08-17更新
|
478次组卷
|
2卷引用:2022年山东省第三届学科素养知识竞赛(高中组)化学试题
4 . 炼锌工厂产生的含砷酸性污水需做无害化处理后排放,一种提取砷并将其资源化的工艺流程如下:
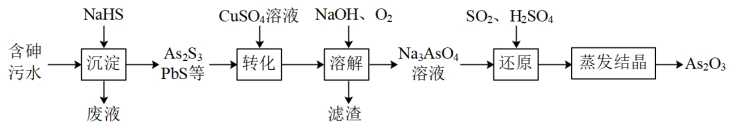
回答下列问题:
(1)“沉淀”时,需控制溶液中HS—的浓度不能过高,原因为_______ 。
(2)“转化”时,As2S3在CuSO4溶液中转化为HAsO2,HAsO2中As元素的化合价为_______ ,该反应的化学方程式为_______ 。
(3)已知Ksp(CuS)=1×10-36、Ksp(PbS)=1×10-26、Ksp(PbSO4)=1×10-8,若“转化时,调节溶液中Cu2+浓度为10-8mol/L,SO 的浓度为0.1mol/L,此时c(Pb2+)=
的浓度为0.1mol/L,此时c(Pb2+)=_______ ,滤渣中的Pb的存在形式为_______ 。
(4)“溶解”时,发生反应的氧化剂和还原剂的物质的量之比为_______ ,实验测得Na3AsO4溶液呈碱性,其原因为_______ (用离子方程式表示)。
(5)该流程制得99g As2O3,则“还原”时消耗标准状况下SO2的体积为_______ 。

回答下列问题:
(1)“沉淀”时,需控制溶液中HS—的浓度不能过高,原因为
(2)“转化”时,As2S3在CuSO4溶液中转化为HAsO2,HAsO2中As元素的化合价为
(3)已知Ksp(CuS)=1×10-36、Ksp(PbS)=1×10-26、Ksp(PbSO4)=1×10-8,若“转化时,调节溶液中Cu2+浓度为10-8mol/L,SO
 的浓度为0.1mol/L,此时c(Pb2+)=
的浓度为0.1mol/L,此时c(Pb2+)=(4)“溶解”时,发生反应的氧化剂和还原剂的物质的量之比为
(5)该流程制得99g As2O3,则“还原”时消耗标准状况下SO2的体积为
您最近一年使用:0次
名校
解题方法
5 . Ⅰ.为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
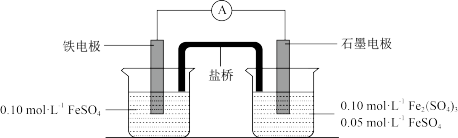
回答下列问题:
(1)实验室用FeSO4·7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和___________ (写物质名称)。
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为___________ ,因此,验证了Fe2+氧化性小于___________ (写化学符号,下同),还原性小于___________ 。
Ⅱ. 工业废水中常含有一定量有毒的 和,必须进行处理。常用的处理方法有两种。
和,必须进行处理。常用的处理方法有两种。
方法一:还原沉淀法
该法的工艺流程为: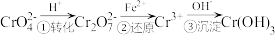 ↓
↓
(3)第①步存在平衡:2 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显___________ 色。
(4)第②步中,还原1 mol 离子,需要
离子,需要___________ mol FeSO4·7H2O。
方法二:电解法
该法用Fe做电极电解含 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为___________ 。
(6)溶液中同时生成的沉淀还有___________ (写化学式)。

回答下列问题:
(1)实验室用FeSO4·7H2O固体和蒸馏水配制FeSO4溶液时,还需要加入少量铁粉和
(2)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增大,石墨电极上未见Fe析出。则石墨电极的电极反应式为
Ⅱ. 工业废水中常含有一定量有毒的
 和,必须进行处理。常用的处理方法有两种。
和,必须进行处理。常用的处理方法有两种。方法一:还原沉淀法
该法的工艺流程为:
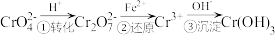 ↓
↓(3)第①步存在平衡:2
 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。若平衡体系的pH=2,则溶液显
(橙色)+H2O。若平衡体系的pH=2,则溶液显(4)第②步中,还原1 mol
 离子,需要
离子,需要方法二:电解法
该法用Fe做电极电解含
 的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。
的酸性废水,随着电解进行,阴极附近溶液pH升高,产生Cr(OH)3沉淀。(5)用Fe做电极的原因为
(6)溶液中同时生成的沉淀还有
您最近一年使用:0次
解题方法
6 . 我国提出争取在2030年前实现碳达峰,2060年实现碳中和。将二氧化碳进行捕集并转化为可利用的能源有具有划时代的意义。
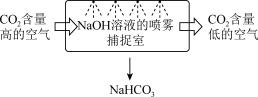
(1)下图是一种利用NaOH溶液实现“碳捕获”的技术,使用NaOH溶液喷雾捕捉 的原因是
的原因是_______ ,若实现NaOH溶液的循环利用,可采取的措施为_______ 。
(2)消防员和矿工使用的呼吸器是利用超氧化钾( )吸收
)吸收 ,若生成碳酸氢钟,则发生反应的化学方程式为
,若生成碳酸氢钟,则发生反应的化学方程式为_______ ,每吸收1mol 转移电子数为
转移电子数为_______ 。
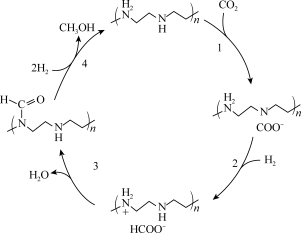
(3)下图是科学家利用石乙烯六胺来捕获 的反应机理示意图,总反应方程式为
的反应机理示意图,总反应方程式为_______ ,该反应中 表现
表现_______ 性,反应1和反应2中胺表现出_______ 性。
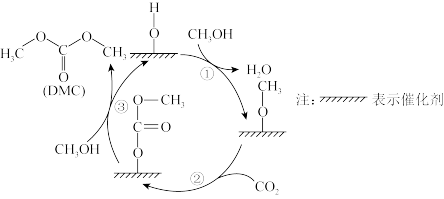
(4)我国科学家以 基做催化剂,利用
基做催化剂,利用 和
和 合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为
合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为_______ ,历程中涉及反应类型为_______ ,碳酸二甲酯(DMC)在氢氧化钠作用下发生水解的化学方程式为_______ 。
(1)下图是一种利用NaOH溶液实现“碳捕获”的技术,使用NaOH溶液喷雾捕捉
 的原因是
的原因是
(2)消防员和矿工使用的呼吸器是利用超氧化钾(
 )吸收
)吸收 ,若生成碳酸氢钟,则发生反应的化学方程式为
,若生成碳酸氢钟,则发生反应的化学方程式为 转移电子数为
转移电子数为(3)下图是科学家利用石乙烯六胺来捕获
 的反应机理示意图,总反应方程式为
的反应机理示意图,总反应方程式为 表现
表现
(4)我国科学家以
 基做催化剂,利用
基做催化剂,利用 和
和 合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为
合成碳酸二甲酯(DMC)反应历程如图,反应①中催化剂的作用为
您最近一年使用:0次
名校
解题方法
7 . 把22.4g铁粉完全溶解于某浓度的硝酸中,如反应只收集到0.3 mol NO2和0.2 mol NO,下列说法正确的是
| A.反应后生成的盐只为Fe(NO3)3 |
| B.反应后生成的盐只为Fe(NO3)2 |
| C.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为1∶3 |
| D.反应后生成的盐为Fe(NO3)3和Fe(NO3)2,其物质的量之比为3∶1 |
您最近一年使用:0次
2022-07-16更新
|
751次组卷
|
13卷引用:2015-2016学年河北省石家庄一中高二下期末化学试卷
2015-2016学年河北省石家庄一中高二下期末化学试卷【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题新疆阿瓦提县多浪乡中学2019届高三毕业班第二次质量检测理综化学试题吉林省靖宇县一中2020届高三上学期9月月考化学试题福建省福州市第三中学2019-2020学年上学期高三9月月考化学试题2020届人教版高中化学高三专题基础复习专题3《金属及其化合物》测试卷专题1.3 氧化还原反应(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)专题07 铁及其化合物(核心精讲)——【新教材精创】2019-2020学年高中化学新教材知识讲学浙江省东阳中学2020-2021学年高二上学期10月阶段考试化学试题(已下线)专题05 金属及其重要化合物-备战2021届高考化学二轮复习题型专练安徽合肥一六八中学2021-2022学年高三下学第二次调研化学试题辽宁省沈阳市东北育才学校高三上学期10月第一次模拟考试化学试题
名校
解题方法
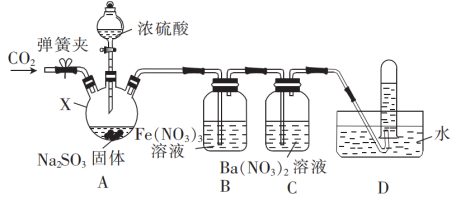
8 . 某小组设计实验探究SO2的还原性(部分夹持仪器省略)。
回答下列问题:
(1)分液漏斗中浓硫酸的浓度宜选择_______ (填标号)。
a.98.3% b.70% c.30% d.10%
(2)仪器X的名称是_______ ,装置A中发生反应的化学方程式为_______ 。
(3)为了探究装置B中 、
、 是否与SO2发生反应,设计如下实验:
是否与SO2发生反应,设计如下实验:
由操作I及其现象可知
_______ (填“部分”或“全部”,下同)参与了反应,由操作II及其现象可知
_______ 参与了反应。
(4)测定装置B溶液中 的浓度(只考虑
的浓度(只考虑 与
与 的反应)。用
的反应)。用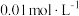 的酸性
的酸性 溶液滴定20mL装置B中溶液,共消耗酸性
溶液滴定20mL装置B中溶液,共消耗酸性 溶液16mL,则装置B溶液中
溶液16mL,则装置B溶液中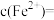
_______  。
。
(5)经分析,装置C中反应可能有两种情况:
①若通入少量SO2,则反应为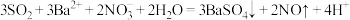 ;
;
②若通入过量SO2,则反应为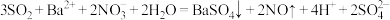 。
。
为了探究发生了哪一种情况,取装置C中溶液分别装入甲、乙、丙、丁四支试管中,进行如下实验:
能说明发生的是情况①的实验是____ (填标号,下同),能说明发生的是情况②的实验是_____ 。

回答下列问题:
(1)分液漏斗中浓硫酸的浓度宜选择
a.98.3% b.70% c.30% d.10%
(2)仪器X的名称是
(3)为了探究装置B中
 、
、 是否与SO2发生反应,设计如下实验:
是否与SO2发生反应,设计如下实验:| 实验操作 | 现象 |
| I.取装置B中溶液于试管,滴加KSCN溶液 | 溶液不变红 |
| II.取装置B中溶液于试管,加入适量浓硫酸,再加入铜粉 | 铜粉不溶解,溶液不变蓝 |
III.取装置B中溶液于试管,滴加 溶液和盐酸 溶液和盐酸 | 产生白色沉淀 |


(4)测定装置B溶液中
 的浓度(只考虑
的浓度(只考虑 与
与 的反应)。用
的反应)。用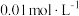 的酸性
的酸性 溶液滴定20mL装置B中溶液,共消耗酸性
溶液滴定20mL装置B中溶液,共消耗酸性 溶液16mL,则装置B溶液中
溶液16mL,则装置B溶液中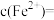
 。
。(5)经分析,装置C中反应可能有两种情况:
①若通入少量SO2,则反应为
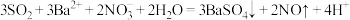 ;
;②若通入过量SO2,则反应为
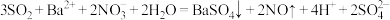 。
。为了探究发生了哪一种情况,取装置C中溶液分别装入甲、乙、丙、丁四支试管中,进行如下实验:
| 实验 | 操作及现象 |
| a | 向甲中加入锌粒,产生气泡 |
| b | 向乙中加入铜粉,溶液颜色发生了变化 |
| c | 向丙中加入 粉末,产生气泡 粉末,产生气泡 |
| d | 向丁中加入 溶液,产生沉淀 溶液,产生沉淀 |
您最近一年使用:0次
2022-07-07更新
|
335次组卷
|
4卷引用:湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题
名校
解题方法
9 . Co(OH)2在空气中加热时,固体(不含其他杂质)质量随温度变化的曲线如图所示,取400℃时的产物(其中Co的化合价为+2,+3),用500mL5.1mol·L-1盐酸将其恰好完全溶解,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。下列说法错误的是
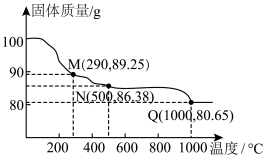

A.290℃时,固体的成分仅有 |
B.400℃时,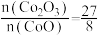 |
| C.500℃时,固体中氧元素总质量分数约为26.6% |
| D.生成的黄绿色气体可用于工业上生产“84”消毒液 |
您最近一年使用:0次
2022-07-03更新
|
549次组卷
|
4卷引用:河北省保定市2021-2022学年高二下学期期末考试化学试题
河北省保定市2021-2022学年高二下学期期末考试化学试题山西省长治市2021-2022学年高二下学期期末联考化学试题江西省南昌市第二中学2022-2023学年高三上学期第三次考试化学试题(已下线)2022年福建省高考真题变式题(选择题6-10)
解题方法
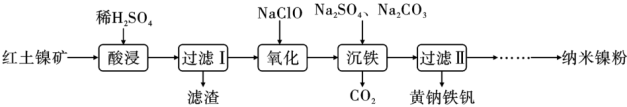
10 . 以红土镍矿(主要含有 、FeO、NiO、
、FeO、NiO、 等)为原料,获取高效净水剂黄钠铁矾[
等)为原料,获取高效净水剂黄钠铁矾[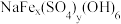 ]和纳米镍粉的部分工艺流程如图:
]和纳米镍粉的部分工艺流程如图:
已知: 在pH约为3.7时可完全转化为
在pH约为3.7时可完全转化为 ,
, 在pH约为9时可完全转化为
在pH约为9时可完全转化为 。
。
(1)若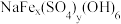 中y=2,则黄钠铁矾的化学式为
中y=2,则黄钠铁矾的化学式为_______ 。
(2)“酸浸”过程,欲提高铁和镍元素的浸出率,可采取的措施为_______ (写出一条即可)。
(3)滤渣的主要成分为_______ 。
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为_______ ,“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,生成黄钠铁矾,应将pH控制在_______ ,写出该反应的化学方程式:_______ 。
(5)高铁酸盐也是优良的含铁净水剂,利用纯铁作电极插入浓的NaOH溶液电解制得 ,请写出阳极生成
,请写出阳极生成 的电极反应式为
的电极反应式为_______ 。
 、FeO、NiO、
、FeO、NiO、 等)为原料,获取高效净水剂黄钠铁矾[
等)为原料,获取高效净水剂黄钠铁矾[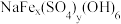 ]和纳米镍粉的部分工艺流程如图:
]和纳米镍粉的部分工艺流程如图:
已知:
 在pH约为3.7时可完全转化为
在pH约为3.7时可完全转化为 ,
, 在pH约为9时可完全转化为
在pH约为9时可完全转化为 。
。(1)若
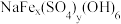 中y=2,则黄钠铁矾的化学式为
中y=2,则黄钠铁矾的化学式为(2)“酸浸”过程,欲提高铁和镍元素的浸出率,可采取的措施为
(3)滤渣的主要成分为
(4)“氧化”过程中氧化剂与还原剂的物质的量之比为
(5)高铁酸盐也是优良的含铁净水剂,利用纯铁作电极插入浓的NaOH溶液电解制得
 ,请写出阳极生成
,请写出阳极生成 的电极反应式为
的电极反应式为
您最近一年使用:0次



