名校
解题方法
1 . 锰酸锂离子蓄电池是第二代锂离子动力电池,性能优良。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂(LiMn2O4)。流程如图:
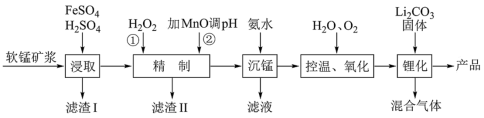
(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为______ 。
(2)滤渣II的主要成分是______ ;“精制”中加入H2O2的量比理论值大得多,其主要原因是_____ 。
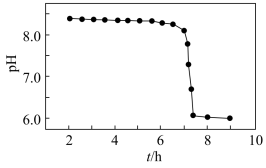
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是______ (用化学方程式表示)。
(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为______ 。
(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是_____ 。
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy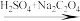 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为______ 。

(1)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为
(2)滤渣II的主要成分是
(3)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为MnO2,若控温氧化时溶液的pH随时间的变化如图,其中pH下降的原因是

(4)工业上也可以将“精制”后的滤液加入K2S2O8来合成MnO2。K2S2O8中S的化合价为
 价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为
价,加入K2S2O8溶液合成MnO2发生反应的离子方程式为(5)“锂化”是将MnO2和Li2CO3按4∶1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品。所得混合气体的成分是
(6)为测定成品锰酸锂的纯度,实验室可通过连续滴定法测定锰酸锂中锰元素的平均价态。
进行如下实验:
步骤1:取少量成品锰酸锂(假设为LiMnxOy)分成两等份,分别置于两只锥形瓶中;
步骤2:向一只锥形瓶中加入稀硝酸和双氧水,完全反应后,LiMnxOy中Mn元素转化为Mn2+,除去过量的双氧水。调节pH,滴加指示剂,用浓度为0.300mol•L-1的EDTA标准溶液滴定,终点时消耗EDTA标准溶液20.00mL(已知:Mn2+与EDTA反应的化学计量数之比为1∶1);
步骤3:向另一锥形瓶中加入1.340gNa2C2O4和足量硫酸,充分反应后,用0.100mol•L-1KMnO4标准溶液滴定,到达滴定终点时消耗KMnO4标准溶液20.80mL。
已知:LiMnxOy
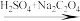 Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
Mn2+,则此成品锰酸锂LiMnxOy中Mn元素的平均化合价为
您最近一年使用:0次
2023-01-10更新
|
598次组卷
|
3卷引用:山东省烟台第一中学2022-2023学年高一上学期月考化学试题
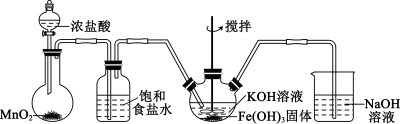
2 . 氢氧化铁、高铁酸盐(如 )均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:
)均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:
第一组:取 饱和
饱和 溶液,慢慢加入
溶液,慢慢加入 的
的 溶液,并不断搅拌;
溶液,并不断搅拌;
第二组:取 饱和
饱和 溶液,滴加12%硫酸酸化的双氧水,再慢慢加入
溶液,滴加12%硫酸酸化的双氧水,再慢慢加入 的
的 溶液;
溶液;
第三组:在第二组实验的基础上用制得的 合成
合成 ,其装置如下(夹持仪器已略去):
,其装置如下(夹持仪器已略去):
已知:① 对双氧水的分解有一定的催化作用;
对双氧水的分解有一定的催化作用;
②氧元素的非金属性大于碘。
回答下列问题:
(1)第一组同学看到的现象是__________ ,不断搅拌的目的是__________ 。
(2)第二组同学滴加双氧水的过程中,观察到溶液颜色变成黄色,其反应的离子方程式为__________ ,在溶液变成黄色的同时,看到不断有气泡产生,其原因是__________ (用化学方程式解释)。
(3)第二组同学完成实验后,及时对烧杯壁上附着的 进行了清洗,但错把氢碘酸
进行了清洗,但错把氢碘酸 当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质
当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质 。他们认为一定是
。他们认为一定是 和
和 反应的过程中,
反应的过程中, 氧化了
氧化了 ,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是
,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是__________ 。
(4)第三组实验装置中的明显缺陷是__________ ,用双线桥表示制备 时的电子转移情况:
时的电子转移情况:__________ 。

生成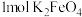 理论上需要标准状态下的
理论上需要标准状态下的
__________ L。
(5)实验发现,在制备氯气时,浓盐酸的实际加入量远超过理论用量,分析出现该情况的原因:_____ 。
 )均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:
)均可用于净水。某化学兴趣班同学进行以下分组实验,在制得氢氧化铁的基础上制备高铁酸盐:第一组:取
 饱和
饱和 溶液,慢慢加入
溶液,慢慢加入 的
的 溶液,并不断搅拌;
溶液,并不断搅拌;第二组:取
 饱和
饱和 溶液,滴加12%硫酸酸化的双氧水,再慢慢加入
溶液,滴加12%硫酸酸化的双氧水,再慢慢加入 的
的 溶液;
溶液;第三组:在第二组实验的基础上用制得的
 合成
合成 ,其装置如下(夹持仪器已略去):
,其装置如下(夹持仪器已略去):
已知:①
 对双氧水的分解有一定的催化作用;
对双氧水的分解有一定的催化作用;②氧元素的非金属性大于碘。
回答下列问题:
(1)第一组同学看到的现象是
(2)第二组同学滴加双氧水的过程中,观察到溶液颜色变成黄色,其反应的离子方程式为
(3)第二组同学完成实验后,及时对烧杯壁上附着的
 进行了清洗,但错把氢碘酸
进行了清洗,但错把氢碘酸 当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质
当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质 。他们认为一定是
。他们认为一定是 和
和 反应的过程中,
反应的过程中, 氧化了
氧化了 ,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是
,但也有人对生成碘单质的原因提出了另一种看法,该看法可能是(4)第三组实验装置中的明显缺陷是
 时的电子转移情况:
时的电子转移情况:
生成
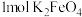 理论上需要标准状态下的
理论上需要标准状态下的
(5)实验发现,在制备氯气时,浓盐酸的实际加入量远超过理论用量,分析出现该情况的原因:
您最近一年使用:0次
2023-01-06更新
|
376次组卷
|
2卷引用:四川省成都市蓉城名校联盟2022-2023学年高一上学期期末联考化学试题
3 .  是一种优良的饮用水处理剂,可用
是一种优良的饮用水处理剂,可用 、
、 、
、 混合共熔反应制得:
混合共熔反应制得: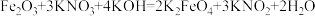 。下列关于该反应的说法
。下列关于该反应的说法不正确 的是
 是一种优良的饮用水处理剂,可用
是一种优良的饮用水处理剂,可用 、
、 、
、 混合共熔反应制得:
混合共熔反应制得: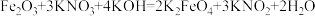 。下列关于该反应的说法
。下列关于该反应的说法A. 是还原剂, 是还原剂,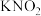 为还原产物 为还原产物 |
B.在熔融条件下氧化性: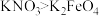 |
C.每生成 ,转移 ,转移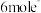 |
D. 在处理饮用水过程中起氧化、杀菌、脱色、除味、净水等作用 在处理饮用水过程中起氧化、杀菌、脱色、除味、净水等作用 |
您最近一年使用:0次
2023-01-02更新
|
522次组卷
|
3卷引用:浙江省杭州学军中学2022-2023学年高三上学期模拟考试化学试题
名校
解题方法
4 . 将 铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为
铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为 ,放出的气体
,放出的气体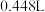 (标准状况)。则下列判断中正确的是
(标准状况)。则下列判断中正确的是
 铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为
铁和氧化铁的混合物加入足量的盐酸中充分反应,固体无剩余。测得参加反应的盐酸的物质的量为 ,放出的气体
,放出的气体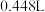 (标准状况)。则下列判断中正确的是
(标准状况)。则下列判断中正确的是A.原混合物中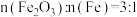 |
B.原混合物中氧化铁的质量为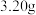 |
C.向所得溶液中滴加 溶液,溶液显红色 溶液,溶液显红色 |
D.向所得溶液中通入 ,可以将 ,可以将 完全转化为 完全转化为 |
您最近一年使用:0次
2023-01-01更新
|
586次组卷
|
5卷引用:辽宁省大连市2022-2023学年高一上学期期末考试化学试题
5 . 一定量的某磁黄铁矿(主要成分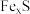 ,S为-2价)与
,S为-2价)与 盐酸恰好完全反应(杂质不与盐酸反应),生成
盐酸恰好完全反应(杂质不与盐酸反应),生成 硫单质、
硫单质、 和一定量的某种气体,且反应后溶液中无
和一定量的某种气体,且反应后溶液中无 。有关说法正确的是
。有关说法正确的是
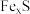 ,S为-2价)与
,S为-2价)与 盐酸恰好完全反应(杂质不与盐酸反应),生成
盐酸恰好完全反应(杂质不与盐酸反应),生成 硫单质、
硫单质、 和一定量的某种气体,且反应后溶液中无
和一定量的某种气体,且反应后溶液中无 。有关说法正确的是
。有关说法正确的是A. | B.生成了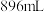 气体 气体 |
C. | D.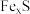 中, 中, |
您最近一年使用:0次
2022-12-16更新
|
429次组卷
|
2卷引用: 上海市闵行区2022-2023学年高三上学期一模质量调研化学试题
名校
解题方法
6 .  可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L  被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
您最近一年使用:0次
2022-12-07更新
|
1482次组卷
|
4卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
7 . 二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如图,其中反应Ⅲ制取ClO2的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。

(1)试剂X是____ (填化学式)。
(2)NaOH及试剂X均需过量的原因是____ 。
(3)反应Ⅲ,若生成67.5gClO2,转移电子的物质的量为____ 。
(4)用ClO2处理过的饮用水常含有一定量有害的ClO2。我国规定饮用水中ClO2的含量在0.1~0.8mg·L-1。测定水样中ClO2的含量的过程如下:
①量取25.00mL水样加入锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-=2ClO +I2。
+I2。
③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3mol·L-1Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45mL。此过程发生反应:2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
根据上述数据计算并判断该水样中ClO2的含量是否符合国家规定____ 。(请写出计算过程)

(1)试剂X是
(2)NaOH及试剂X均需过量的原因是
(3)反应Ⅲ,若生成67.5gClO2,转移电子的物质的量为
(4)用ClO2处理过的饮用水常含有一定量有害的ClO2。我国规定饮用水中ClO2的含量在0.1~0.8mg·L-1。测定水样中ClO2的含量的过程如下:
①量取25.00mL水样加入锥形瓶中,并调节水样的pH为7.0~8.0。
②加入足量的KI晶体。此过程发生反应2ClO2+2I-=2ClO
 +I2。
+I2。③加入少量淀粉溶液,再向上述溶液中滴加1.00×10-3mol·L-1Na2S2O3溶液至溶液蓝色刚好褪去,消耗Na2S2O3溶液7.45mL。此过程发生反应:2S2O
 +I2=S4O
+I2=S4O +2I-。
+2I-。根据上述数据计算并判断该水样中ClO2的含量是否符合国家规定
您最近一年使用:0次
解题方法
8 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水处理剂,制备流程如图所示:
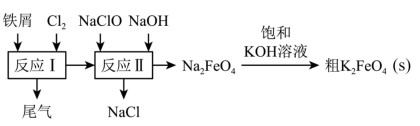
下列叙述不正确的是

下列叙述不正确的是
| A.反应I产生的尾气可通入碱液中吸收 |
| B.反应I生成的FeCl2,在碱性条件下会被NaClO氧化成Na2FeO4 |
| C.反应II中每转移6mol电子会生成166gNa2FeO4 |
| D.Na2FeO4转化成K2FeO4的化学方程式为Na2FeO4+2KOH=K2FeO4↓+2NaOH |
您最近一年使用:0次
解题方法
9 . 近几年,我国汽车工业得到了飞速发展,新能源汽车走在世界前列。回答下列问题:
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为_______ 。
(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为_______ 作为汽车燃料最好,简述理由_______ (至少回答两点)
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:_______ 。
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应: ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。
①反应中,每生成16molN2,转移的电子数为_______ 。
②反应中,氧化产物与还原产物的物质的量之比为_______ 。
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为: 。
。

①充电时,电解质溶液中的锂离子向电极_______ (填写“M”“N”)方向移动
②若放电时外电路有2NA电子转移,则理论上电极M的质量_______ (填序号)。
A.增重14g B.不变 C.减重14g D.无法确定
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以
 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应:
 ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。①反应中,每生成16molN2,转移的电子数为
②反应中,氧化产物与还原产物的物质的量之比为
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为:
 。
。
①充电时,电解质溶液中的锂离子向电极
②若放电时外电路有2NA电子转移,则理论上电极M的质量
A.增重14g B.不变 C.减重14g D.无法确定
您最近一年使用:0次
解题方法
10 . 斑岩铜矿是重要的铜矿类型之一,一种以斑岩铜矿(含 、
、 、
、 ,少量的
,少量的 等)为原料提取铜等产品的流程如下:
等)为原料提取铜等产品的流程如下:

请回答下列问题:
(1)浸渣的主要成分是_______ (填化学式)。
(2)铜矿在灼烧之前要粉碎,其目的是_______ 。
(3)灼烧中 转化成磁性氧化铁,写出反应的化学方程式:
转化成磁性氧化铁,写出反应的化学方程式:_______ ,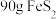 完全反应时转移
完全反应时转移_______ mol电子。
(4)电解硫酸铜溶液的化学方程式为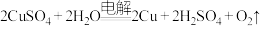 ,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。
,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。
(5)双氧水的作用是_______ (用离子方程式表示)。
(6)工业上,以辉铜矿(主要成分为 )为原料,采用火法治铜,有关反应如下:
)为原料,采用火法治铜,有关反应如下:
①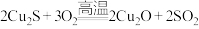 ;
;
② 和
和 高温下反应制备Cu,该反应的化学方程式为
高温下反应制备Cu,该反应的化学方程式为_______ 。
 、
、 、
、 ,少量的
,少量的 等)为原料提取铜等产品的流程如下:
等)为原料提取铜等产品的流程如下:
请回答下列问题:
(1)浸渣的主要成分是
(2)铜矿在灼烧之前要粉碎,其目的是
(3)灼烧中
 转化成磁性氧化铁,写出反应的化学方程式:
转化成磁性氧化铁,写出反应的化学方程式: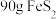 完全反应时转移
完全反应时转移(4)电解硫酸铜溶液的化学方程式为
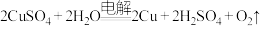 ,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。
,电解所得“废液”可用于_______(填字母),实现资源循环利用,提高原料利用率。| A.灼烧 | B.酸浸 | C.氧化 | D.沉铁 |
(6)工业上,以辉铜矿(主要成分为
 )为原料,采用火法治铜,有关反应如下:
)为原料,采用火法治铜,有关反应如下: ①
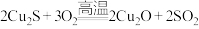 ;
;②
 和
和 高温下反应制备Cu,该反应的化学方程式为
高温下反应制备Cu,该反应的化学方程式为
您最近一年使用:0次



