1 . 中学化学中几种常见物质的转化关系如下图(部分产物未列出)。A是一种生活中常见金属单质之一,D是淡黄色固体单质。

请回答下列问题:
(1)A、G的化学式分别为A________ ,G________ 。
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是________ 。
A. C+2H2SO4(浓) CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
B. Fe+H2SO4===FeSO4+H2↑
C. Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
D. FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2→F的化学方程式:______________________________ 。
(4)若反应F+D→E转移电子数为6.02×1023,则消耗D的质量为_________ 。

请回答下列问题:
(1)A、G的化学式分别为A
(2)F的浓溶液与A反应过程中,F体现的性质与下列反应中H2SO4体现的性质完全相同的是
A. C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2OB. Fe+H2SO4===FeSO4+H2↑
C. Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2OD. FeO+H2SO4===FeSO4+H2O
(3)写出反应E+H2O2→F的化学方程式:
(4)若反应F+D→E转移电子数为6.02×1023,则消耗D的质量为
您最近一年使用:0次
真题
解题方法
2 . 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第_____ 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为____ 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是_____ 。
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为___________ 。
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是______ (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为____________ ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为____ L(标准状况)。
(1)原子序数为29的铜元素位于元素周期表中第
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是
| A.降低了反应的活化能 | B.增大了反应的速率 |
| C.降低了反应的焓变 | D.增大了反应的平衡常数 |
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。

①腐蚀过程中,负极是
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈u2(OH)3Cl,其离子方程式为
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
2016-12-09更新
|
2064次组卷
|
3卷引用:2015年全国普通高等学校招生统一考试化学(重庆卷)
解题方法
3 . 短周期元素形成的常见非金属固体单质 A 与常见金属单质 B,在加热条件下反应生成化合物 C,C 与水反应生成白色沉淀 D 和气体 E,D 既能溶于强酸,又能溶于强碱。E 在足量空气中燃烧产生刺激性气味的气体 G,G 在大气中能导致酸雨的形成。E 被足量氢氧化钠溶液吸收得到无色溶液 F。溶液 F 在空气中长期放置发生反应,生成物之一为 H。H 与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质 A 的元素在周期表中的位置_______ 。
(2)B 与氢氧化钠溶液反应的化学方程式为:_______ 。
(3)G 与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为_______ ,当生成 2mol 二氧化氯时,转移电子_______ mol。
(4)溶液 F 在空气中长期放置生成 H 的化学方程式为:_______ 。
(5)H 的溶液与稀硫酸反应产生的现象为_______ 。
(1)组成单质 A 的元素在周期表中的位置
(2)B 与氢氧化钠溶液反应的化学方程式为:
(3)G 与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为
(4)溶液 F 在空气中长期放置生成 H 的化学方程式为:
(5)H 的溶液与稀硫酸反应产生的现象为
您最近一年使用:0次
4 . 铜及其化合物在工业、农业、科技和日常生活中有广泛应用。
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,所得溶液加入Ba(NO3)2有白色沉淀生成。写出辉铜矿与高锰酸钾反应的离子方程式_____ 。
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)=2 mol/L,c(H2SO4)=4 mol/L的废酸混合液100 mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为_________ 。
(3)现有一块含有铜绿〔Cu2(OH)2CO3〕的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。

①固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式_____ 。
②上述铜片中铜的生锈率为_________ (金属生锈率= )。(结果保留到整数)
)。(结果保留到整数)
(4)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS)。
①硫化铜与氧气在淋滤作用下生成硫酸铜等,该过程的化学方程式为______ 。
②写出渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式________ ,请用简短的语言解释该反应发生的原理_________
(1)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜。为了测定辉铜矿样品的纯度,用酸性高锰酸钾溶液反应,所得溶液加入Ba(NO3)2有白色沉淀生成。写出辉铜矿与高锰酸钾反应的离子方程式
(2)工业上利用废铜屑、废酸(含硝酸、硫酸)为主要原料制备硫酸铜晶体。某含有c(HNO3)=2 mol/L,c(H2SO4)=4 mol/L的废酸混合液100 mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4·5H2O)的质量为
(3)现有一块含有铜绿〔Cu2(OH)2CO3〕的铜片(假设不含其它杂质)在空气中灼烧至完全反应,经测定,反应前后固体的质量相同。

①固态铜与适量氧气反应,能量变化如下图所示,写出固态铜与氧气反应生成1 mol固态氧化亚铜的热化学方程式
②上述铜片中铜的生锈率为
 )。(结果保留到整数)
)。(结果保留到整数)(4)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向深部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS)。
①硫化铜与氧气在淋滤作用下生成硫酸铜等,该过程的化学方程式为
②写出渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式
您最近一年使用:0次
2016-12-09更新
|
681次组卷
|
2卷引用:2015届吉林省实验中学高三上学期第五次模拟考试理综化学试卷
5 . SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中生成 的离子方程为
的离子方程为_____ 。
(2)含硫各微粒(H2SO3、 和
和 )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。

①下列说法正确的是________ (填字母序号)。
a.pH=8时,溶液中c( ) < c(
) < c( )
)
b.pH=7时,溶液中c(Na+) =c( )+c(
)+c( )
)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_____ 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是 、
、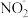 ,写出生成NO3-的离子方程式
,写出生成NO3-的离子方程式_______ 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成Ce4+的电极反应式为______ 。
②生成Ce4+从电解槽的________ (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2_________ L(用含a代数式表示,计算结果保留整数)。

(1)装置Ⅰ中生成
 的离子方程为
的离子方程为(2)含硫各微粒(H2SO3、
 和
和 )存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
①下列说法正确的是
a.pH=8时,溶液中c(
 ) < c(
) < c( )
)b.pH=7时,溶液中c(Na+) =c(
 )+c(
)+c( )
)c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是
 、
、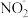 ,写出生成NO3-的离子方程式
,写出生成NO3-的离子方程式(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。

①生成Ce4+的电极反应式为
②生成Ce4+从电解槽的
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2
您最近一年使用:0次
2016-12-09更新
|
862次组卷
|
2卷引用:2015届湖南省长沙市雅礼中学高三5月一模化学试卷
解题方法
6 . N、Cu、H、O、S、Mg是常见的六种元素。
(1)Mg位于元素周期表第_______ 周期第_______ 族;N与O的基态原子核外未成对电子个数比为_______ ;Cu的基态原子电子排布式为_______ 。
(2)用“>”或“<”填空:
碱性:Mg(OH)2_______ Cu(OH)2
第一电离能:O_______ N
熔点:MgS_______ MgO
稳定性:H2S_______ H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为_______ 。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目_______ 。
(1)Mg位于元素周期表第
(2)用“>”或“<”填空:
碱性:Mg(OH)2
第一电离能:O
熔点:MgS
稳定性:H2S
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种正盐,在25℃、101kPa下,已知该反应每消耗1molH2SO4放热akJ,则该反应的热化学方程式为
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽),写出该反应的化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次
2016-12-09更新
|
455次组卷
|
2卷引用:2015届安徽省安庆市高三第二次模拟考试理综化学试卷
解题方法
7 . A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去): 。
。
(1)若A、D的水溶液均呈酸性,且D为强酸。
①则A、D分别为A:__________ ,D:____________ 。(填写化学式,下同)
②写出B→C转化的化学方程式:________________________________ 。
③简述检验B物质的方法________________ 。
④写出D的浓溶液和Cu在加热条件的化学方程式________________ 。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。
①则C为___________
②写出实验室制取A的化学方程式_______________________________ 。
③1.92g铜投入一定量D的浓溶液中,铜完全溶解,共收集到672mL气体(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为_____ mL。
(3)在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是_____(填写字母符号)
 。
。(1)若A、D的水溶液均呈酸性,且D为强酸。
①则A、D分别为A:
②写出B→C转化的化学方程式:
③简述检验B物质的方法
④写出D的浓溶液和Cu在加热条件的化学方程式
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红。
①则C为
②写出实验室制取A的化学方程式
③1.92g铜投入一定量D的浓溶液中,铜完全溶解,共收集到672mL气体(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积为
(3)在铁和铜的混合物中,加入一定量的稀硝酸,使之充分反应,剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2 g,则m1与m2关系是_____(填写字母符号)
| A.m1一定大于m2 | B.m1可能大于m2 |
| C.m1可能等于m2 | D.m1一定等于m2 |
您最近一年使用:0次
2014·江苏南通·二模
解题方法
8 . 催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成__________ (填“CO、CO2或HCHO”)。
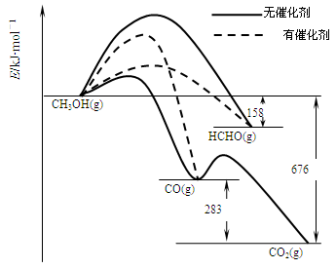
②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=_______ 。
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式:_________ 。
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式:__________________________ 。
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4,从环境保护的角度看,催化脱硫的意义为_________________________ ;每吸收标准状况下11.2L SO2,被SO2还原的O2的质量为_______ g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式_______________________________________ 。

(1)人们常用催化剂来选择反应进行的方向。下图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成

②2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=
③在稀硫酸催化下,HCHO可以通过反应生成分子式为C3H6O3的环状三聚甲醛分子,其分子中同种原子的化学环境均相同。写出三聚甲醛的结构简式:
④甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性,用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式:
(2)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4,从环境保护的角度看,催化脱硫的意义为
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式

您最近一年使用:0次
10-11高三上·江苏泰州·阶段练习
解题方法
9 . 草酸(H2C2O4)是一种重要的化工原料。已知常温下0.01 mol·L-l的H2C2O4、KHC2O4、K2C2O4溶液的pH如下表所示。
(1)在其它条件不变时,下列措施能使KHC2O4溶液中c(K+):c(HC2O4-)接近1:1的是_________ (填字母)。
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-lNaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-lH2S04溶液酸化后,用0.10 mol·L-lKMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:

①完成离子方程式:5C2O42-+2MnO4-+16H+=10______ +2Mn2++8H2O。
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为__________ 。
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量_____________ 。(已知FeC2O4·2H2O的相对分子质量为180;设反应产生的气体被充分吸收)
H2C2O4 | KHC2O4 | K2C2O4 | |
pH | 2.0 | 3.1 | 8.1 |
A.加入适量的H2C2O4 B.加入适量的KHC2O4
C.加入适量的Na2C2O4 D.升高溶液的温度
(2)取一定质量H2C2O4·2H2O和KHC2O4的混合物,加水溶解,配成250 mL溶液,取两份此溶液各25 mL,向第一份溶液中先加入几滴酚酞试液,再滴加0.25 mol·L-lNaOH溶液至20.00 mL时,溶液由无色变为浅红色;向第二份溶液中滴加适量3 mol·L-lH2S04溶液酸化后,用0.10 mol·L-lKMnO4溶液滴定,当消耗KMnO4溶液16.00 mL时,溶液由无色变为浅紫红色。请回答下列问题:

①完成离子方程式:5C2O42-+2MnO4-+16H+=10
②原混合物中H2C2O4·2H2O和KHC2O4的物质的量之比为
(3)某实验小组用如图所示的装置探究FeC2O4·2H2O在隔绝空气条件下受热分解的产物。当36.0g FeC2O4·2H2O充分反应后,残留固体质量为13.6g,浓硫酸增重7.2g,碱石灰增重11.0g。求残留固体的成分和物质的量
您最近一年使用:0次
9-10高三·辽宁丹东·阶段练习
10 . (一)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ/mol。请回答下列问题:

(1)图中E的大小对该反应的反应热有无影响?_________ 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_______ ;
(2)已知单质硫16g燃烧放热为148kJ写出硫燃烧热的热化学方程式:___________ ;
(3)计算由S(s)生成3 molSO3(g)的△H_______ ;
(二)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
___ Fe(NO3)3 +__ NaOH+ ___ Cl2 → ___ Na2FeO4+ ___ NaNO3 + ___ NaCl + _____ H2O
(1)配平上述反应,当生成3mol还原产物时,转移电子的总数为_____ mol;
(2)铁酸钠除了能消毒外,还可以用于净水,原因是_____________________________ 。

(1)图中E的大小对该反应的反应热有无影响?
(2)已知单质硫16g燃烧放热为148kJ写出硫燃烧热的热化学方程式:
(3)计算由S(s)生成3 molSO3(g)的△H
(二)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
(1)配平上述反应,当生成3mol还原产物时,转移电子的总数为
(2)铁酸钠除了能消毒外,还可以用于净水,原因是
您最近一年使用:0次



