解题方法
1 . 溴元素被称为海洋元素,它主要以溴离子形式存在于海水中。工业上制备粗溴( )的流程如图:
)的流程如图:

已知:①在酸性条件下,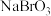 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:
(1)“置换”时通入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)单质溴可用热空气吹出,其原因是___________ 。
(3)写出“酸化”时发生反应的化学方程式:___________ 。
(4)用 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是___________ 。
(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量___________ (填字母),充分反应后,分液。
a.饱和NaCl溶液 b.NaOH溶液 c.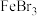 溶液 d.
溶液 d. 溶液
溶液
 )的流程如图:
)的流程如图:
已知:①在酸性条件下,
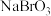 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:(1)“置换”时通入
 发生反应的离子方程式为
发生反应的离子方程式为(2)单质溴可用热空气吹出,其原因是
(3)写出“酸化”时发生反应的化学方程式:
(4)用
 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量
a.饱和NaCl溶液 b.NaOH溶液 c.
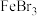 溶液 d.
溶液 d. 溶液
溶液
您最近一年使用:0次
2 . 请回答以下问题:
(1)氢化钠(NaH)为白色晶体,其中 有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目
有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目___________ ;NaH能与水剧烈反应NaH+H2O=NaOH+H2↑,NaH与液氨也有类似反应,写出反应的化学方程式___________ 。
(2)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被H2O所还原的BrF3的物质的量是___________ 。
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___________ 。
②若生成0.2molAsH3,则转移的电子数为___________ 。
(4)氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___________ ;
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两方法中消耗的还原剂质量之比为___________ ;
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为 ,则相同质量的ClO2是Cl2消毒效率的
,则相同质量的ClO2是Cl2消毒效率的___________ 倍。
(5)配平反应方程式(答题卡上写出完整的化学方程式)___________________ 。
______Al+_______NaNO3+_____H2O=____Al(OH)3+____N2↑+____NaAlO2
(1)氢化钠(NaH)为白色晶体,其中
 有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目
有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目(2)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被H2O所还原的BrF3的物质的量是
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目
②若生成0.2molAsH3,则转移的电子数为
(4)氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两方法中消耗的还原剂质量之比为
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为
 ,则相同质量的ClO2是Cl2消毒效率的
,则相同质量的ClO2是Cl2消毒效率的(5)配平反应方程式(答题卡上写出完整的化学方程式)
______Al+_______NaNO3+_____H2O=____Al(OH)3+____N2↑+____NaAlO2
您最近一年使用:0次
3 . 亚硝酸钠有咸味,有毒,暴露于空气中会与氧气反应生成硝酸钠。
已知: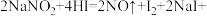 _____。
_____。
(1)上述方程式中横线处应填的是___________ 。
(2)上述反应的还原剂为___________ (填化学式);若反应中有 (标准状况下)气体生成则反应中转移电子的物质的量为
(标准状况下)气体生成则反应中转移电子的物质的量为___________  。
。
(3)在酸性条件下,高锰酸钾可将 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:___________ 。
(4) 加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:
加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:___________ 。反应中被氧化的元素和被还原的元素的物质的量之比为___________ 。
(5)某厂废液中,含有2%~5%的 ,直接排放会造成污染,
,直接排放会造成污染, 能使
能使 转化为
转化为 ,则反应中氧化剂和还原剂的质量之比为
,则反应中氧化剂和还原剂的质量之比为___________ 。
已知:
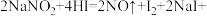 _____。
_____。(1)上述方程式中横线处应填的是
(2)上述反应的还原剂为
 (标准状况下)气体生成则反应中转移电子的物质的量为
(标准状况下)气体生成则反应中转移电子的物质的量为 。
。(3)在酸性条件下,高锰酸钾可将
 氧化为
氧化为 ,所得溶液中锰元素仅以
,所得溶液中锰元素仅以 形式存在,写出此反应的离子方程式:
形式存在,写出此反应的离子方程式:(4)
 加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:
加热到320℃以上会分解生成二氧化氮、一氧化氮和氧化钠,写出此反应的化学方程式并用双线桥法标明电子的转移方向和数目:(5)某厂废液中,含有2%~5%的
 ,直接排放会造成污染,
,直接排放会造成污染, 能使
能使 转化为
转化为 ,则反应中氧化剂和还原剂的质量之比为
,则反应中氧化剂和还原剂的质量之比为
您最近一年使用:0次
名校
解题方法
4 . 常用于印染工业的连二亚硫酸钠(Na2S2O4)俗称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:
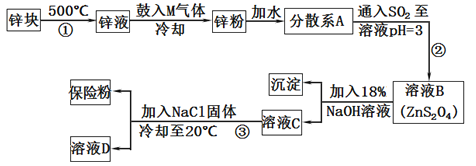
请回答下列问题:
(1)保险粉应如何保存?_______________________ (填一个注意事项)。
(2)由锌块制备锌粉的目的是___________ ;向液锌中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm(1m=106μm)的锌粉.鼓入气体M为常见的双原子单质分子,则M的化学式为___________ ;分散系A为____________ (填“溶液”“胶体”或“悬浊液”)。
(3)流程②的化学方程式为_____________________ 。
(4)流程③的分离方法步骤为___________ 、洗涤、干燥,其中洗涤所用试剂是__________ ;实验室加入NaCl固体的作用是_____________ 。
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式____________________ 。
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②__________________ 。

请回答下列问题:
(1)保险粉应如何保存?
(2)由锌块制备锌粉的目的是
(3)流程②的化学方程式为
(4)流程③的分离方法步骤为
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②
您最近一年使用:0次
2017-02-17更新
|
1264次组卷
|
2卷引用:青海湟川中学2020-2021学年高一下学期3月考化学试题



