名校
解题方法
1 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)
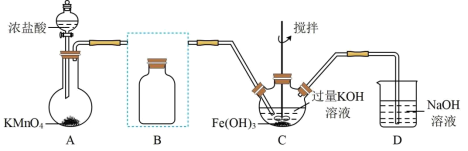
(1)写出A中产生氯气的离子方程式:_______
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:_______
(3)在C中发生的2个反应的离子方程式:_______ ;_______
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
(4)由方案Ⅰ中溶液变红可知a中含有_______ 离子,根据方案Ⅱ得出:氧化性Cl2_______  (填“>”或“<”)
(填“>”或“<”)
(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______
①完成并配平上述离子方程式_______ 。
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。(计算结果保留到0.1%)
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)写出A中产生氯气的离子方程式:
(2)在答题纸上将除杂装置B补充完整并标明所用试剂:
(3)在C中发生的2个反应的离子方程式:
Ⅱ.探究K2FeO4的性质:取C中紫色溶液,加入稀硫酸,产生气体和溶液a.为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶解,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生 |
 (填“>”或“<”)
(填“>”或“<”)(5)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
_______FeO
 +_______H+=_______O2↑+_______Fe3++ _______
+_______H+=_______O2↑+_______Fe3++ _______①完成并配平上述离子方程式
②现取C中洗涤并干燥后样品的质量10 g,加入稀硫酸,收集到0.672 L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近一年使用:0次
2 . 研究氮及其化合物的制备性质具有重要的意义。回答下列问题:
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证 的性质。
的性质。________ ,锥形瓶中的药品是________ 。
(2)装置乙的作用是________ ;装置丙用于收集 ,应将导管
,应将导管________ (填“a”或“b”)延长至集气瓶底部。
(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为__________ ,证明氨气具有________ (填“氧化性”或“还原性”)。
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是________ (填标号)。 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为_____________ 。
(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是________________ 。
I.某研究性学习小组设计用如图所示实验装置(夹持仪器省略),制取干燥的氨气并验证
 的性质。
的性质。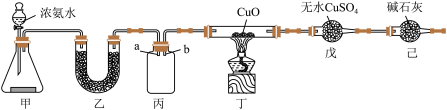
(2)装置乙的作用是
 ,应将导管
,应将导管(3)实验中观察到丁中CuO粉末变红,戊中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为
(4)为防止环境污染,以下装置(盛放的液体均为水)可用于吸收多余氨气的是
a.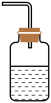 b.
b.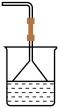 c.
c. d.
d.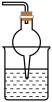
 ,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。
,可用NaClO溶液氧化吸收以消除它们对环境的污染。其他条件相同,NO转化为的转化率随NaClO溶液初始pH(用稀硫酸调节)的变化如图所示。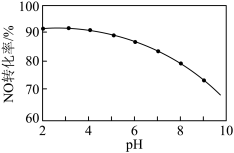
 和
和 ,反应的离子反应方程式为
,反应的离子反应方程式为(6)NaClO溶液的初始pH越小,NO转化率越高,其原因是
您最近一年使用:0次
2023-04-27更新
|
180次组卷
|
3卷引用:山东省临沂市五区县2022-2023学年高一下学期期中考试化学试题
解题方法
3 . Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是________ (填化学式),过氧化钠(Na2O2)中氧元素化合价为_____ 。(填数字)
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_________________ 。
②每生成1mol FeO42-转移___ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____ mol。
(3)配平下面化学方程式,回答下列问题:____ C +K2Cr2O7+H2SO4=K2SO4+CO2↑+Cr2(SO4)3+H2O。
①H2SO4在上述反应中表现出来的性质是(填选项编号)______ 。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____ L。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO42-转移
(3)配平下面化学方程式,回答下列问题:
①H2SO4在上述反应中表现出来的性质是(填选项编号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
解题方法
4 . 氮、硫、碳的氧化物都会引起环境问题,越来越引起人们的重视。如图是氮、硫元素的各种价态与物质类别的对应关系: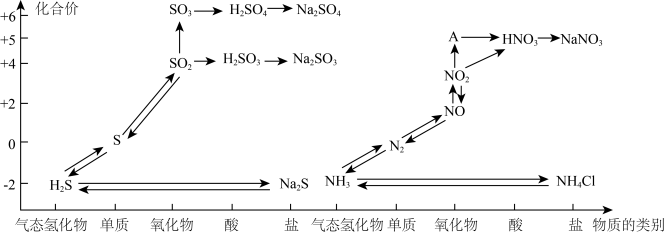
(1)根据A对应的化合价和物质类别,A为___________ (写分子式),从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有____________ 。
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择________ ,反应的离子方程式为______________ 。
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:_______________ 。
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为_____ 。
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式_______ 。
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为____________ 。

(1)根据A对应的化合价和物质类别,A为
(2)浓、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应选择
(3)某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4。回答下列问题:

①写出制取SO2的化学方程式:
②该同学利用实验现象来检验SO2的还原性,则选用的试剂为
A. 品红溶液 B. 酸性高锰酸钾溶液 C. 双氧水(H2O2)
(4)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学反应方程式
(5)工业上把海水先进行氧化,再吸收溴,达到富集溴的目的。吸收工艺常用的方法是先用热空气吹出Br2,再用SO2吸收Br2。取吸收后的溶液,向其中加入氯化钡溶液有白色沉淀析出。写出SO2吸收Br2反应的化学方程式为
您最近一年使用:0次
2020-05-29更新
|
709次组卷
|
2卷引用:山东省济宁市鱼台县第一中学2019-2020学年高一5月开学考试化学试题
解题方法
5 . 根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为__________ 。
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:__________ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:
方案一:碱性条件下用 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为__________ 。
方案二:在碱性条件下,用铝粉处理,已知反应时Al与 为
为 ,且Al转化为
,且Al转化为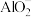 ,被氧化的元素是
,被氧化的元素是__________ ,还原产物是__________ ,请写出反应的离子方程式:__________ 。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取2mLH2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
②有同学认为Na2SO3也有还原性,可以选择其作为试剂验证H2O2氧化性。该观点是否正确,请从化合价的角度说明理由:
(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,某饮用水研究人员提出两种处理方案:
的浓度,某饮用水研究人员提出两种处理方案:方案一:碱性条件下用
 还原[氧化产物为
还原[氧化产物为 ]
] 生成
生成 ,反应中氧化剂和还原剂物质的量之比为
,反应中氧化剂和还原剂物质的量之比为方案二:在碱性条件下,用铝粉处理,已知反应时Al与
 为
为 ,且Al转化为
,且Al转化为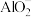 ,被氧化的元素是
,被氧化的元素是
您最近一年使用:0次
6 . 高铁酸钾 (K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知: 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与 反应制备
反应制备
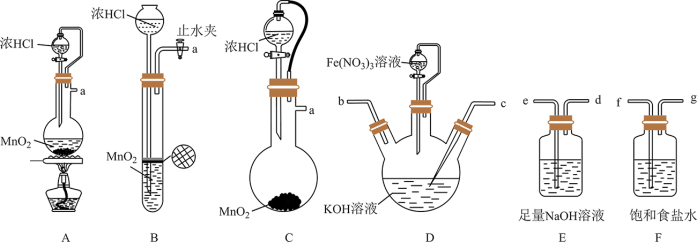
(1)氯气的发生装置可以选择图中的_______ (用图中大写字母表示);化学反应方程式为_______ 。
(2)选择上述装置,制备 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。_________
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。 在硫酸溶液中反应如下:
在硫酸溶液中反应如下:
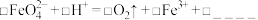
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。__________
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为_______ 。
Ⅱ.干法制备高铁酸钾的主要反应为: 。
。
(4)①该反应中的还原剂是_______ 。
②每生成 转移
转移_______ 个电子(阿伏加德罗常数用 表示)。
表示)。
(5)简要说明 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用_______ 。
 为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,易溶于水、不溶于乙醇,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。Ⅰ.湿法制备高铁酸钾(夹持装置略去)
原理:实验室中常用KClO在强碱性介质中与
 反应制备
反应制备

(1)氯气的发生装置可以选择图中的
(2)选择上述装置,制备
 ,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。
,按气流从左到右的方向,合理的连接顺序a→_______→_______→_______→_______→_______(填仪器接口字母,仪器不可重复使用)。(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。
 在硫酸溶液中反应如下:
在硫酸溶液中反应如下: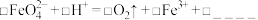
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。
②现取D中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
Ⅱ.干法制备高铁酸钾的主要反应为:
 。
。(4)①该反应中的还原剂是
②每生成
 转移
转移 表示)。
表示)。(5)简要说明
 作为复合型水处理剂时所起的作用
作为复合型水处理剂时所起的作用
您最近一年使用:0次
名校
7 . I.海带中含有丰富的碘,某学习小组设计并进行以下实验:
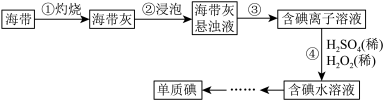
(1)步骤③的实验操作所用。用到的玻璃仪器有___________ 。步骤④的离子反应方程式为: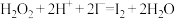 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是___________ ,还原剂是___________ 。步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现蓝色,说明有碘单质产生。
II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失, 被氧气氧化成碘单质(I2),同时得到强碱性物质。
被氧气氧化成碘单质(I2),同时得到强碱性物质。
(2)写出潮湿环境下KI与氧气反应的化学方程式:___________ 。
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:
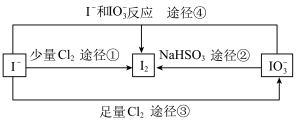
(3)四个途径中属于氧化还原反应的是___________ (填序号)。
(4)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为: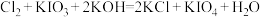 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(5)比较I2、 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:___________ 。

(1)步骤③的实验操作所用。用到的玻璃仪器有
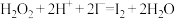 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是II.碘称为“智力元素”。过去食盐中KI作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,
 被氧气氧化成碘单质(I2),同时得到强碱性物质。
被氧气氧化成碘单质(I2),同时得到强碱性物质。(2)写出潮湿环境下KI与氧气反应的化学方程式:
III.现在的食盐里改添加性质稳定的KIO3,以满足人们需要。几种粒子之间有如图所示关系:

(3)四个途径中属于氧化还原反应的是
(4)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(KIO4),反应方程式为:
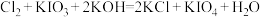 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(5)比较I2、
 和Cl2的氧化性强弱:
和Cl2的氧化性强弱:
您最近一年使用:0次
名校
8 . Ⅰ.海带中含有丰富的碘,某学习小组设计并进行以下实验:
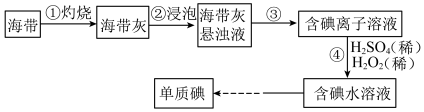
(1)步骤③的实验操作为___________ (填实验名称),此过程使用玻璃棒,玻璃棒的作用是___________ 。
(2)步骤④的离子反应方程式为: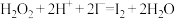 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是___________ ,还原剂是___________ 。步骤④得到的含碘水溶液中滴加淀粉溶液,溶液呈现蓝色,说明有碘单质产生。
Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失, 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。
(3)写出潮湿环境下 与氧气反应的化学方程式:
与氧气反应的化学方程式:___________ 。
Ⅲ.现在的食盐里改添加性质稳定的 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
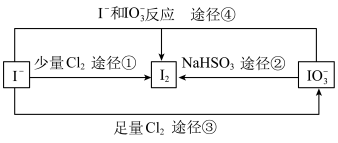
(4)四个途径中属于氧化还原反应的是___________ (填序号)。
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(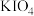 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ 。
(6)比较 、
、 和
和 的氧化性强弱:
的氧化性强弱:___________ 。

(1)步骤③的实验操作为
(2)步骤④的离子反应方程式为:
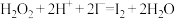 ,该离子反应中的氧化剂是
,该离子反应中的氧化剂是Ⅱ.碘称为“智力元素”。过去食盐中作为加碘剂,但由于空气中氧气的作用,容易引起碘的损失,
 被氧气氧化成碘单质(
被氧气氧化成碘单质( ),同时得到强碱性物质。
),同时得到强碱性物质。(3)写出潮湿环境下
 与氧气反应的化学方程式:
与氧气反应的化学方程式:Ⅲ.现在的食盐里改添加性质稳定的
 ,以满足人们需要。几种粒子之间有如图所示关系:
,以满足人们需要。几种粒子之间有如图所示关系:
(4)四个途径中属于氧化还原反应的是
(5)在碱性条件下碘酸钾能被氯气氧化为高碘酸钾(
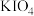 ),反应方程式为:
),反应方程式为: ,写出该反应的离子方程式:
,写出该反应的离子方程式:(6)比较
 、
、 和
和 的氧化性强弱:
的氧化性强弱:
您最近一年使用:0次
名校
解题方法
9 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_________ (填序号)。
甲. 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_________ ;②加入_________ 。
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_________ 。
(4)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 作用,得到
作用,得到 最多的是
最多的是___________ 。
(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为 ),可用如图转化方式除去。
),可用如图转化方式除去。
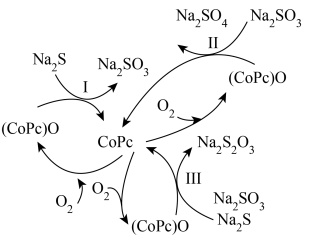
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为___________ 。
②在废水处理整个过程中,催化剂为___________ ,氧化剂为___________ 。
③反应Ⅲ中 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式_________________ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值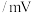 | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
甲.
 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于
 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为
 ),可用如图转化方式除去。
),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为
②在废水处理整个过程中,催化剂为
③反应Ⅲ中
 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式
您最近一年使用:0次
2023-12-04更新
|
384次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
10 . 国家卫生健康委员会发布公告称,富硒酵母、二氧化硅、硫黄等6种食品添加剂新品种安全性已通过审查,这些食品添加剂包括食品营养强化剂、风味改良剂、结构改善剂、防腐剂,用于食品生产中,丰富舌尖上的营养和美味。氧、硫、硒为同一主族元素,请回答下列问题:
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为______ 。工业上用浓H2SO4焙烧CuSe的方法提取硒(其中Cu转化为CuSO4),且有SO2、H2O和SeO2(固体)生成,写出发生反应的化学方程式:_____ 。理论上该反应每转移1mol电子,得到的SeO2的质量为_____ 。
(2)下列说法正确的是______。
(3)短周期元素d、e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:___________ 。
②d、e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为___________ 。
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为___________ 。
④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程___________ 。
(1)硒(Se)是一种生命元素,有抗癌、抗衰老等重要功能。富硒酵母是一种新型添加剂,其中硒元素在周期表中的位置为
(2)下列说法正确的是______。
A.热稳定性: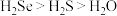 | B.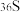 与 与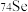 的中子数之和为60 的中子数之和为60 |
C.酸性: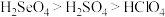 | D.还原性:Se2- < S2- |
(3)短周期元素d、e、f、g、h、x都可能存在于某些食品添加剂中,其最高正化合价或最低负化合价与原子序数的关系如图所示:
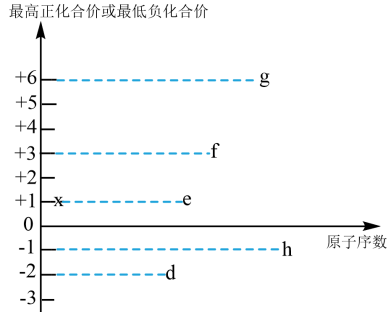
②d、e、f、g、h元素形成的简单离子中,半径最大的离子结构示意图为
③x和d组成的化合物中,既含有极性共价键又含有非极性共价键,此化合物可将碱性工业废水中的
 氧化,生成碳酸盐和氨气,相应的离子方程式为
氧化,生成碳酸盐和氨气,相应的离子方程式为④e和d组成的某化合物,可做呼吸面具的供氧剂,用电子式表示其形成过程
您最近一年使用:0次
2023-08-31更新
|
270次组卷
|
3卷引用:山东省东明县第一中学2022-2023学年高一下学期3月月考化学试题



