1 . 金属钠及其化合物在人类生产、生活中起着重要作用。诸回答下列问题:
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为___________ ,采用空气和Na为原料可直接制备Na2O2.空气与熔融的金属Na反应前需依次通过的试剂为___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)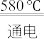 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
①配平上述离子方程式___________ 。
②该反应说明Na2O2具有___________ (选填“氧化性”“还原性"或“漂白性”)。
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为___________ 。
(1)向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中加入黄豆粒大小的金属钠,可能观察到的现象是___________(填序号)。
A.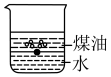 | B.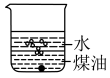 |
C. | D. |
(2)金属钠在氧气中燃烧生成Na2O2,其电子式为
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(3)NaCl的熔点为800.8℃。工业上采用电解熔融的NaCl和CaCl2混合盐制备金属Na,电解的化学方程式为:2NaCl(l)
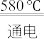 2Na(1)+Cl2(g),加入CaCl2的目的是
2Na(1)+Cl2(g),加入CaCl2的目的是(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应。
 +____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O
+____ H++_____ Na2O2=____ Mn2++_____ Na+_____ O2↑+____H2O①配平上述离子方程式
②该反应说明Na2O2具有
(5)在密闭容器中,将a mol Na2O2和b mol NaHCO3固体混合物加热至250℃,充分反应后,若剩余固体为Na2CO3和NaOH,排出气体为O2和H2O时,a:b的取值范围为
您最近一年使用:0次
2 . 铅元素位于周期表ⅣA族,其氧化物铅丹(Pb3O4)可作防锈涂料,围绕铅丹的制备与性质有如下流程。下列有关说法错误的是
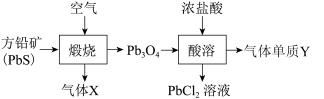

| A.Pb3O4可表示为2PbO·PbO2 |
| B.“煅烧”时PbS只作还原剂,Cl2的氧化性强于Pb3O4 |
| C.气体X既是氧化产物又是还原产物,气体Y为氧化产物 |
| D.“酸溶”时0.1 mol Pb3O4与足量的浓盐酸反应,生成0.1 mol Cl2 |
您最近一年使用:0次
2023-08-11更新
|
99次组卷
|
2卷引用:黑龙江省哈尔滨市第四中学校2023-2024学年高一上学期11月月考化学试题
3 . 已知反应:①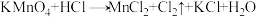 、②
、②
 、③
、③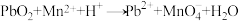 (方程式均未配平)。下列说法正确的是
(方程式均未配平)。下列说法正确的是
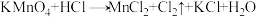 、②
、②
 、③
、③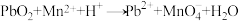 (方程式均未配平)。下列说法正确的是
(方程式均未配平)。下列说法正确的是A.反应③中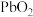 发生氧化反应 发生氧化反应 |
| B.反应①中氧化剂与还原剂的物质的量之比为1:8 |
C.氧化性: |
| D.反应①和②中生成相同质量的氯气时,消耗HCl的物质的量之比为5:4 |
您最近一年使用:0次
2022-10-10更新
|
339次组卷
|
3卷引用:皖豫名校联盟2022-2023学年高三毕业班第一次联考化学试题
名校
4 . 已知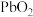 在盐酸溶液中易生成
在盐酸溶液中易生成 ,且
,且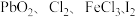 的氧化性依次减弱,下列叙述中,正确的是
的氧化性依次减弱,下列叙述中,正确的是
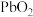 在盐酸溶液中易生成
在盐酸溶液中易生成 ,且
,且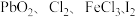 的氧化性依次减弱,下列叙述中,正确的是
的氧化性依次减弱,下列叙述中,正确的是A. 通入 通入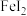 溶液中,可存在反应: 溶液中,可存在反应: |
B.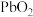 可能与浓盐酸反应生成 可能与浓盐酸反应生成 |
C. 溶液能将 溶液能将 溶液中的 溶液中的 还原成 还原成 |
D. 可能将 可能将 氧化成 氧化成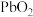 |
您最近一年使用:0次
5 . 请按要求回答下列问题:
(1)钠在空气中燃烧生成淡黄色的固体,则其化学方程式为___________ ;
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种___________ (填“酸性”、“碱性”或“两性”)氧化物;
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式___________ ;
(4)氨气极易溶于水,其水溶液显___________ (填“酸”、“碱”或“中”)性;
(5)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出___________ (填“吸水”、“脱水”或“氧化”)性;
(6)向试管中的品红溶液中通入一段时间的SO2,观察到品红溶液褪色,然后再加热试管,已褪色的溶液___________ (填“恢复”或“不恢复”)红色。
(7)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式___________ ;
(1)钠在空气中燃烧生成淡黄色的固体,则其化学方程式为
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式
(4)氨气极易溶于水,其水溶液显
(5)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出(6)向试管中的品红溶液中通入一段时间的SO2,观察到品红溶液褪色,然后再加热试管,已褪色的溶液
(7)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式
您最近一年使用:0次
2022-02-15更新
|
578次组卷
|
2卷引用:湖南省祁东县育贤中学2021-2022学年高一下学期第一次月考化学试题
6 . 高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂,工业制备高铁酸钾的反应离子方程式为Fe(OH)3+ClO-+OH-→ +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是A.由上述反应可知,ClO-的氧化性强于 |
| B.高铁酸钾中铁显+6价 |
| C.上述反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+与水反应形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2020-09-08更新
|
545次组卷
|
3卷引用:河南省洛阳市第一高级中学2021届高三9月月考化学试题
名校
解题方法
7 . 用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。

一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧为-1价) Na2FeO4+Na2O(未配平),下列说法不正确的是( )
Na2FeO4+Na2O(未配平),下列说法不正确的是( )

一种生成Na2FeO4的反应如下:Fe2O3+Na2O2(氧为-1价)
 Na2FeO4+Na2O(未配平),下列说法不正确的是( )
Na2FeO4+Na2O(未配平),下列说法不正确的是( )| A.Na2O2既是氧化剂又是还原剂 |
| B.Fe2O3在反应中失去电子 |
| C.配平后为Fe2O3+3Na2O2=2Na2FeO4+Na2O |
| D.Na2FeO4能消毒杀菌是因其具有强氧化性 |
您最近一年使用:0次
2020-03-13更新
|
253次组卷
|
4卷引用:四川省成都市蒲江县蒲江中学2019-2020学年高二上学期12月月考化学试题



