1 . 化学与生活、生产息息相关。请回答下列问题:
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有_______ (填序号,下同),属于非电解质的有_______ 。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为_______ 。
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为_______ 。
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式_______ :
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳;②熔融KCl;③NaHSO4固体;④铜;⑤H2SO4溶液;⑥澄清石灰水,其中属于电解质的有
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。用小苏打片治疗胃酸过多的离子方程式为
(3)工业上制备漂白粉常将氯气通入冷的石灰乳中,发生反应的化学方程式为
(4)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,发生的化学反应如下:
①配平化学方程式
_______C+_______K2Cr2O7+_______H2SO4=_______K2SO4+_______CO2↑+_______Cr2(SO4)3+_______H2O。
②在上述反应中生成标准状况下的11.2LCO2,转移电子数为
您最近一年使用:0次
名校
2 . 新型冠状病毒肺炎爆发以来,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液(有效成分 );②
);② (在水中一部分可以电离出阴、阳离子);③漂白粉;④
(在水中一部分可以电离出阴、阳离子);③漂白粉;④ ;⑤
;⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸(
酒精;⑧过氧乙酸( );⑨高铁酸钠(
);⑨高铁酸钠( )。回答下列问题:
)。回答下列问题:
(1)上述杀菌消毒剂属于电解质的是___________ (填序号)。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用导致游泳池藻类快速生长,池水变绿,写出该反应的化学方程式___________ 。
(3)实验室可用 溶液配制消毒液。
溶液配制消毒液。
①需要用托盘天平称量 固体的质量为
固体的质量为___________  ;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有
;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有___________ 。
②下列情况会导致所配制溶液浓度偏高的是___________ (填标号)。
a.称量时所用的砝码生锈
b.移液时,有少量液体浅出
c.定容时,俯视刻度线
(4)高铁酸钠 是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体:
是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体: 。当反应转移电子的数目是
。当反应转移电子的数目是 时,生成标准状况下
时,生成标准状况下 的体积约为
的体积约为___________ 。用 代替
代替 处理饮用水的优点是
处理饮用水的优点是___________ (只答一条即可)。
 );②
);② (在水中一部分可以电离出阴、阳离子);③漂白粉;④
(在水中一部分可以电离出阴、阳离子);③漂白粉;④ ;⑤
;⑤ ;⑥碘酒;⑦
;⑥碘酒;⑦ 酒精;⑧过氧乙酸(
酒精;⑧过氧乙酸( );⑨高铁酸钠(
);⑨高铁酸钠( )。回答下列问题:
)。回答下列问题:(1)上述杀菌消毒剂属于电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用导致游泳池藻类快速生长,池水变绿,写出该反应的化学方程式
(3)实验室可用
 溶液配制消毒液。
溶液配制消毒液。①需要用托盘天平称量
 固体的质量为
固体的质量为 ;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有
;在配制过程中,除托盘天平、烧杯、玻璃棒、胶头滴管外还必需的玻璃仪器有②下列情况会导致所配制溶液浓度偏高的是
a.称量时所用的砝码生锈
b.移液时,有少量液体浅出
c.定容时,俯视刻度线
(4)高铁酸钠
 是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体:
是一种新型净水剂。高铁酸钠在水中可以发生如下反应并生成胶体: 。当反应转移电子的数目是
。当反应转移电子的数目是 时,生成标准状况下
时,生成标准状况下 的体积约为
的体积约为 代替
代替 处理饮用水的优点是
处理饮用水的优点是
您最近一年使用:0次
名校
解题方法
3 . 硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上使用黄铁矿(主要成分为 )制备硫酸的反应原理如下图:
)制备硫酸的反应原理如下图:___________ ;煅烧时发生反应的化学方程式为___________ 。
(2)“氧化”时,发生反应的化学方程式为___________ ;保持其他条件不变,只改变一个反应条件时,生成 的反应速率会如何变化?(填“增大”“减小”或“不变”)
的反应速率会如何变化?(填“增大”“减小”或“不变”)
(3)研究证明,高炉中 与
与 反应不能完全转化为
反应不能完全转化为 和
和 ,据此写出高炉炼铁时
,据此写出高炉炼铁时 与
与 反应的化学方程式:
反应的化学方程式:___________ ;若投入 的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中
的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中 的转化率为
的转化率为___________ 。
 )制备硫酸的反应原理如下图:
)制备硫酸的反应原理如下图: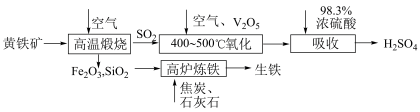
(2)“氧化”时,发生反应的化学方程式为
 的反应速率会如何变化?(填“增大”“减小”或“不变”)
的反应速率会如何变化?(填“增大”“减小”或“不变”)| 改变条件 | 升高温度 | 增大反应容器体积 | 反应达到平衡状态后,延长反应时间 |
生成 的速率 的速率 |
(3)研究证明,高炉中
 与
与 反应不能完全转化为
反应不能完全转化为 和
和 ,据此写出高炉炼铁时
,据此写出高炉炼铁时 与
与 反应的化学方程式:
反应的化学方程式: 的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中
的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中 的转化率为
的转化率为
您最近一年使用:0次
2023-08-20更新
|
368次组卷
|
3卷引用:河北省沧州市东光县等3地海兴县中学等2校2022-2023学年高一下学期3月月考化学试题
名校
解题方法
4 . 铬酸钠( )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(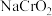 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为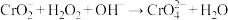 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是
 )是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(
)是一种无机化合物,主要用于墨水、涂料、颜料,金属缓蚀剂以及鞣革和印染等。碱性亚铬酸钠溶液(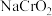 )与过氧化氢溶液反应生成黄色的铬酸钠(
)与过氧化氢溶液反应生成黄色的铬酸钠( ),其反应离子方程式为
),其反应离子方程式为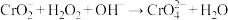 (未配平),下列叙述正确的是
(未配平),下列叙述正确的是| A.反应物中Cr元素的化合价为+4 |
B. 是还原剂 是还原剂 |
| C.该反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.生成2mol水分子时,转移3mol电子 |
您最近一年使用:0次
2023-08-20更新
|
362次组卷
|
2卷引用:湖南省衡阳市名校协作体2022-2023学年高一下学期5月月考化学试题
5 . 铅元素位于周期表ⅣA族,其氧化物铅丹(Pb3O4)可作防锈涂料,围绕铅丹的制备与性质有如下流程。下列有关说法错误的是
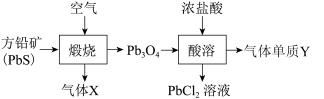

| A.Pb3O4可表示为2PbO·PbO2 |
| B.“煅烧”时PbS只作还原剂,Cl2的氧化性强于Pb3O4 |
| C.气体X既是氧化产物又是还原产物,气体Y为氧化产物 |
| D.“酸溶”时0.1 mol Pb3O4与足量的浓盐酸反应,生成0.1 mol Cl2 |
您最近一年使用:0次
2023-08-11更新
|
99次组卷
|
2卷引用:河北省霸州市第一中学2022-2023学年高二下学期期末考试化学试题
名校
解题方法
6 . Ti具备优良的抗腐蚀性,被称为未来金属,工业上可以采用铁热还原法高温制备,工艺流程如下;已知: ,下列说法错误的是
,下列说法错误的是
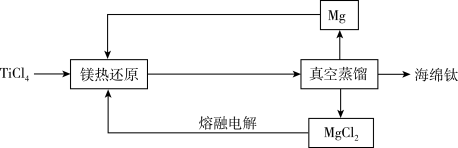
 ,下列说法错误的是
,下列说法错误的是 
| A.Mg的循环使用可以提高原料利用率,降低成本 |
B.热还原的化学方程式为: |
| C.Ti和Mg高温下化学性质非常活泼,镁还原需在惰性气氛中进行 |
| D.整个工艺流程中,Cl元素化合价始终不变 |
您最近一年使用:0次
名校
解题方法
7 . 已知有如图所示转化关系(反应条件略)。
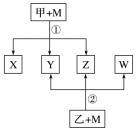
已知:① 、
、 、
、 、
、 均为氧化物。常温下,
均为氧化物。常温下, 是红棕色气体;
是红棕色气体; 能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲
能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲 乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
(1) 是:
是:_______ 。(填写化学式)
(2)在 与
与 的反应中,被氧化的
的反应中,被氧化的 与被还原的
与被还原的 的物质的量之比是
的物质的量之比是_______ 。
(3) 可用于工业制溴过程中吸收潮湿空气中的
可用于工业制溴过程中吸收潮湿空气中的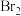 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ ,该反应很好地解决了环保问题。
(4)写出Cu与甲的浓溶液反应的化学方程_______ 。

已知:①
 、
、 、
、 、
、 均为氧化物。常温下,
均为氧化物。常温下, 是红棕色气体;
是红棕色气体; 能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲
能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲 乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:
乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:(1)
 是:
是:(2)在
 与
与 的反应中,被氧化的
的反应中,被氧化的 与被还原的
与被还原的 的物质的量之比是
的物质的量之比是(3)
 可用于工业制溴过程中吸收潮湿空气中的
可用于工业制溴过程中吸收潮湿空气中的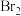 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(4)写出Cu与甲的浓溶液反应的化学方程
您最近一年使用:0次
8 . 请按要求回答下列问题:
(1)钠在空气中燃烧生成淡黄色的固体,则其化学方程式为___________ ;
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种___________ (填“酸性”、“碱性”或“两性”)氧化物;
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式___________ ;
(4)氨气极易溶于水,其水溶液显___________ (填“酸”、“碱”或“中”)性;
(5)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出___________ (填“吸水”、“脱水”或“氧化”)性;
(6)向试管中的品红溶液中通入一段时间的SO2,观察到品红溶液褪色,然后再加热试管,已褪色的溶液___________ (填“恢复”或“不恢复”)红色。
(7)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式___________ ;
(1)钠在空气中燃烧生成淡黄色的固体,则其化学方程式为
(2)Al2O3能溶于酸或强碱溶液生成盐和水,则是一种
(3)Fe(OH)3不溶于水,但能溶于酸,请写出Fe(OH)3与盐酸反应的离子方程式
(4)氨气极易溶于水,其水溶液显
(5)加热时,浓硫酸可与碳发生反应:C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出
CO2↑+2SO2↑+2H2O。在该反应中,浓H2SO4表现出(6)向试管中的品红溶液中通入一段时间的SO2,观察到品红溶液褪色,然后再加热试管,已褪色的溶液
(7)在常温下,将Cl2通入NaOH溶液中,可以得到漂白液。请写出该反应的离子方程式
您最近一年使用:0次
2022-02-15更新
|
578次组卷
|
2卷引用:湖南省娄底市新化县2021-2022学年高一上学期期末考试化学试题
解题方法
9 . 下列含氮物质中,氮元素化合价最低的是
| A.NO | B.NH3 | C.NO2 | D.HNO3 |
您最近一年使用:0次
2021-04-23更新
|
256次组卷
|
4卷引用:黑龙江省宾县第二中学2020-2021学年高一下学期第一次月考化学试题
名校
解题方法
10 . 某离子反应中涉及H2O、ClO-、NH 、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )
、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )

 、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )
、H+、N2、Cl-六种微粒。其中N2的分子数随时间变化的曲线如图所示。下列判断正确的是( )
| A.该反应的还原剂是Cl- |
| B.每生成1个N2分子,转移3个电子 |
| C.参与反应的氧化剂与还原剂的个数比为2:3 |
| D.反应后溶液的酸性明显增强 |
您最近一年使用:0次
2020-10-25更新
|
794次组卷
|
5卷引用:广东省汕头市金山中学2020-2021学年高一上学期10月月考化学试题



