名校
1 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为__________________ 。写出E的最高价氧化物的水化物与D的最高价氧化物的水化物反应的离子方程式____________________________________ 。
(2)由A、B、W三种元素组成的18电子微粒的分子式为____________________ 。
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_________________________________________ 。
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是___________________________________ 。
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________ L(标准状况下)。
(1)E元素在周期表中的位置为
(2)由A、B、W三种元素组成的18电子微粒的分子式为
(3)经测定A2W2为二元弱酸,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式
(4)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成。当消耗2mol I-时,共转移3mol电子,该反应的离子方程式是
(5)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是
您最近半年使用:0次
2016-12-09更新
|
1329次组卷
|
4卷引用:山西省沁县中学2018-2019学年高一下学期第一次月考化学试题
解题方法
2 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为_________________ ,Fe3O4可写成FeO·Fe2O3的形式,如果将Pb3O4也写成相对应的形式应为:______________
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________ 。PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为______________ 。
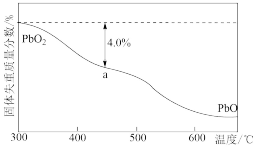
(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________ ,____________ 。
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为

(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即
 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
您最近半年使用:0次
解题方法
3 . 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是____________ 。
(2)调节pH,实验记录如下:
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是____________ 。
②推测a中白色沉淀为Ag2SO4,推测的依据是____________ 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于_________ 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是_____________ 。
②根据实验现象,分析X的性质和元素组成是____________ 。
③Ⅱ中反应的化学方程式是____________ 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是___________ 。
②白色沉淀转化为X的化学方程式是____________ 。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是
②推测a中白色沉淀为Ag2SO4,推测的依据是
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是
②根据实验现象,分析X的性质和元素组成是
③Ⅱ中反应的化学方程式是
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是
②白色沉淀转化为X的化学方程式是
您最近半年使用:0次
2016-12-09更新
|
838次组卷
|
4卷引用:【全国市级联考】山西省大同市与阳泉市2018届高三5月联合模拟考试理综化学试题



