某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是____________ 。
(2)调节pH,实验记录如下:
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是____________ 。
②推测a中白色沉淀为Ag2SO4,推测的依据是____________ 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于_________ 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是_____________ 。
②根据实验现象,分析X的性质和元素组成是____________ 。
③Ⅱ中反应的化学方程式是____________ 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是___________ 。
②白色沉淀转化为X的化学方程式是____________ 。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是
②推测a中白色沉淀为Ag2SO4,推测的依据是
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是
②根据实验现象,分析X的性质和元素组成是
③Ⅱ中反应的化学方程式是
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:

①气体Y是
②白色沉淀转化为X的化学方程式是
更新时间:2016-12-09 07:48:07
|
相似题推荐
解答题-实验探究题
|
困难
(0.15)
名校
【推荐1】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:
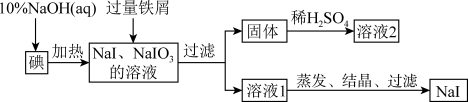
(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________ 。
(2)生产流程中加入过量铁屑的目的是___________________ ,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________ 。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________ ;试设计实验证实该金属阳离子的存在:____________________________ 。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________ ;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:________________ 。

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为
(2)生产流程中加入过量铁屑的目的是
(3)溶液2中除含有H+外,一定含有的阳离子是
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式:
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
解题方法
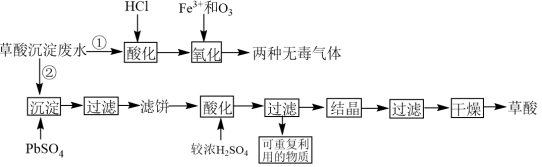
【推荐2】稀土工业生产中,草酸(H2C2O4)是稀土元素沉淀剂。工业生产中会产生稀土草酸沉淀废水,其主要成分为盐酸和草酸的混合溶液及微量的草酸稀土杂质等。此废水腐蚀性较强,直接排放会造成环境污染。工业上处理废水的方法包括“①氧化法”和“②沉淀法”。相关工业流程如图所示:
25℃时,各物质的溶度积常数如下表:
回答下列问题:
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为_______ 。
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是_______ 。为了使加入的17.5mg·L-1的Fe3+催化效果达到最佳,废水酸化时应将pH调整至小于_______ (已知lg2=0.3,1g5=0.7)。
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+ (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=_______ 。
(4)滤饼“酸化”“过滤”后可重复利用的物质为_______ (填化学式)。
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法_______ (填“①”或“②”)更好,原因是_______ 。

25℃时,各物质的溶度积常数如下表:
| Ksp[Fe(OH)3] | Ksp(PbSO4) | Ksp(PbC2O4) | Ka1(H2C2O4)] | Ka2(H2C2O4) |
| 2.5×10-39 | 2.0×10-8 | 5.0×10-10 | 6.0×10-2 | 6.25×10-5 |
(1)“①氧化法”中Fe3+是反应的催化剂,反应产生了两种无毒气体。则草酸和臭氧反应的化学方程式为
(2)“氧化”步骤中,当废水pH=1.0时,单位时间内的草酸去除率接近55%;当废水的pH上升至5.5时,单位时间内的草酸去除率只有5%,其原因是
(3)“②沉淀法”:将1.5mol PbSO4沉淀剂加到1L含有0.1mol·L-1草酸的模拟废水中。沉淀时发生的离子反应为PbSO4(s)+H2C2O4(aq)=PbC2O4(s)+2H+(aq)+
 (aq)。请计算此反应的平衡常数K=
(aq)。请计算此反应的平衡常数K=(4)滤饼“酸化”“过滤”后可重复利用的物质为
(5)比较“①氧化法”和“②沉淀法”,从原料利用率角度分析,方法
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐3】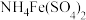 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
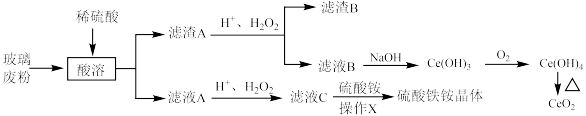
回答下列问题:
(1)“酸溶”中,若使用 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是___________ 。
(2)该生产使用 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是___________ 。
(3)滤渣A转化为滤液B的离子方程式为___________ 。
(4)某同学检验滤液C中是否含有 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论___________ (填“正确”或“错误”),用离子方程式说明:___________ 。
(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有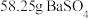 ,每次用
,每次用 的
的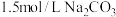 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少___________ 次(假设清洗过程中 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;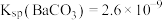 )
)
(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作 为
为___________ 。浓度均为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为___________ 。
(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率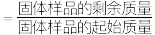
 。
。
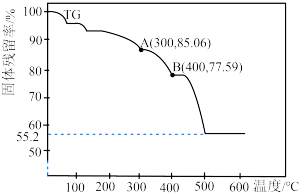
写出 的化学方程式:
的化学方程式:___________ 。
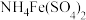 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)“酸溶”中,若使用
 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是(2)该生产使用
 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是(3)滤渣A转化为滤液B的离子方程式为
(4)某同学检验滤液C中是否含有
 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有
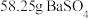 ,每次用
,每次用 的
的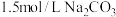 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;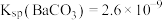 )
)(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作
 为
为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知
 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率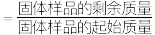
 。
。
写出
 的化学方程式:
的化学方程式:
您最近一年使用:0次
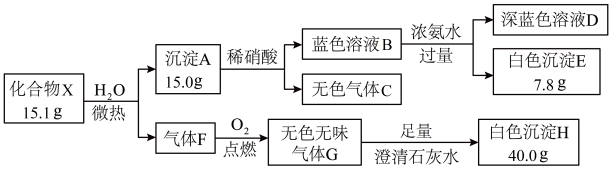
【推荐1】某化合物X由前四周期的四种元素组成,探究其组成的实验过程如图。
请回答:
(1)化合物X的化学式为______ 。气体F的电子式为______ 。
(2)深蓝色溶液D中所含的主要阳离子有(写离子符号)______ 。
(3)砖红色固体与稀硝酸反应的离子方程式为______ 。
(4)在深蓝色溶液D中滴加稀硫酸至pH为3~4,再加入过量KI固体,有白色沉淀(2种元素组成,个数比为1:1)生成,溶液由蓝色变为褐色。写出该反应过程的离子方程式:______ 。
(5)设计实验方案,鉴定蓝色溶液B中所含的阴离子成分______ 。
请回答:
(1)化合物X的化学式为
(2)深蓝色溶液D中所含的主要阳离子有(写离子符号)
(3)砖红色固体与稀硝酸反应的离子方程式为
(4)在深蓝色溶液D中滴加稀硫酸至pH为3~4,再加入过量KI固体,有白色沉淀(2种元素组成,个数比为1:1)生成,溶液由蓝色变为褐色。写出该反应过程的离子方程式:
(5)设计实验方案,鉴定蓝色溶液B中所含的阴离子成分
您最近一年使用:0次
解答题-无机推断题
|
困难
(0.15)
名校
解题方法
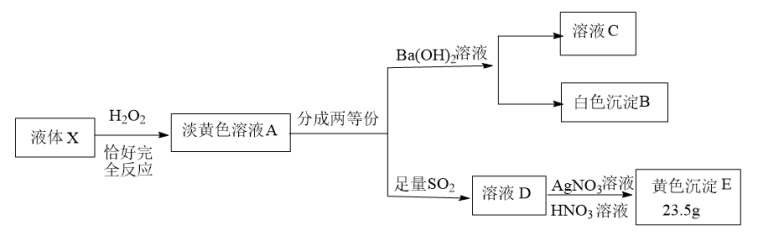
【推荐2】X由4种元素组成的化合物,按如下流程进行实验。已知:液体X被H2O2氧化的过程中转移电子数为1.8NA。当加入适量Ba(OH)2溶液时,使溶液C成中性(不考虑盐类水解的影响),产生81.55g沉淀B,继续滴加过量Ba(OH)2溶液,沉淀B增加至93.2g;溶液C焰色反应透过蓝色钴玻璃观察火焰呈紫色。
请回答:
(1)X组成元素:O和___________ (元素符号),化学式___________ ;
(2)写出X和双氧水反应的化学方程式___________ ;
(3)写出SO2和淡黄色溶液A反应的离子方程式___________ ;
(4)实验中溶液A呈淡黄色原因是含有某种物质,简述如何从溶液A中分离出该物质:___________ 。

请回答:
(1)X组成元素:O和
(2)写出X和双氧水反应的化学方程式
(3)写出SO2和淡黄色溶液A反应的离子方程式
(4)实验中溶液A呈淡黄色原因是含有某种物质,简述如何从溶液A中分离出该物质:
您最近一年使用:0次
解答题-无机推断题
|
困难
(0.15)
【推荐3】化合物A是尿路结石的主要成分,属于结晶水合物,可用X·nH2O表示。在一定条件下有如下图所示的转化关系:
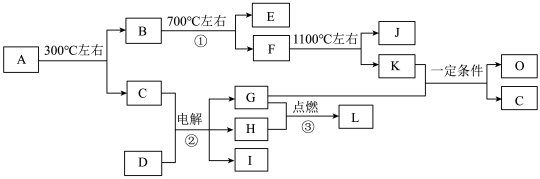
已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:
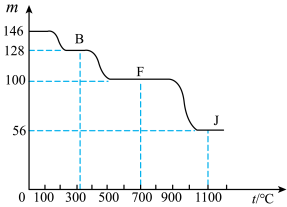
(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃

已知:
①经分析,上图中的各字母代表的物质均由常见元素(原子序数≤20)组成,其中X由三种元素组成;A、D晶体中阴、阳离子个数比都是1∶1;D中的阳离子与C分子有相同的电子数,A中的阳离子与D中的阴离子的电子层结构相同。
② G、H是常见的气体单质,E、K、L是常见的气体化合物;E被人体吸入会与血红蛋白结合而使人中毒,K的大量排放是造成地球温室效应的一个主要原因。
③反应②、③是重要的化工反应,I是一种重要的化工原料。
④上图中的部分变化经定量测定,得到如右图所示的固体产物的质量m随温度[t (℃)]的变化曲线。回答下列问题:

(1)写出A的化学式: ,D中阴离子的结构示意图为 ;
(2)反应①的化学方程式为: 。
(3)K与G在一定条件下可生成多种物质,既可获得经济效益,也减少对环境的污染。
① 若O是一种易挥发的液态燃料,有毒,误饮5-10mL会导致双目失明。则O的分子式为: 。
② 若O是K与G按1∶3的比例反应而得,则O可能是 。(填编号)
A.烷烃 B.烯烃 C.炔烃 D.芳香烃
您最近一年使用:0次
解答题-工业流程题
|
困难
(0.15)
【推荐1】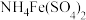 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。

回答下列问题:
(1)“酸溶”中,若使用 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是___________ 。
(2)该生产使用 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是___________ 。
(3)滤渣A转化为滤液B的离子方程式为___________ 。
(4)某同学检验滤液C中是否含有 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论___________ (填“正确”或“错误”),用离子方程式说明:___________ 。
(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有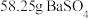 ,每次用
,每次用 的
的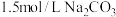 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少___________ 次(假设清洗过程中 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;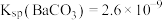 )
)
(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作 为
为___________ 。浓度均为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为___________ 。
(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率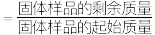
 。
。

写出 的化学方程式:
的化学方程式:___________ 。
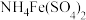 是常用的媒染剂,
是常用的媒染剂, 可用作玻璃工业添加剂。以玻璃废粉(含有
可用作玻璃工业添加剂。以玻璃废粉(含有 及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及
及铁、钡、硅的氧化物)为原料制备硫酸铁铵晶体及 的流程如图所示。
的流程如图所示。
回答下列问题:
(1)“酸溶”中,若使用
 的硫酸溶液,反应速率反而较慢,原因是
的硫酸溶液,反应速率反而较慢,原因是(2)该生产使用
 的流程中,控制温度在
的流程中,控制温度在 左右的原因是
左右的原因是(3)滤渣A转化为滤液B的离子方程式为
(4)某同学检验滤液C中是否含有
 ,采用如下操作:取适量滤液
,采用如下操作:取适量滤液 ,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有
,滴加酸性高锰酸钾溶液,红色褪去,该同学得出滤液C中含有 。该同学的结论
。该同学的结论(5)碳酸钡是制造光学玻璃、陶瓷的重要原料,滤渣B中硫酸钡可通过沉淀转化法使之转化为碳酸钡。若滤渣B中含有
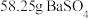 ,每次用
,每次用 的
的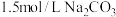 溶液处理,则
溶液处理,则 完全转化为
完全转化为 ,需要反复清洗至少
,需要反复清洗至少 不参与反应,不考虑
不参与反应,不考虑 的水解(已知:
的水解(已知: ;
;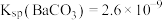 )
)(6)滤液C中加入硫酸铵溶液制备硫酸铁铵晶体所采用的操作
 为
为 的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水,
的①硫酸铵、②硫酸铁铵、③硫酸氢铵、④氨水, 由大到小的顺序为
由大到小的顺序为(7)通过热重仪分析可以得出硫酸铁铵晶体在氮气中热重曲线(TG曲线)如下图所示,已知
 时硫酸铁铵晶体恰好失去全部结晶水,固体残留率
时硫酸铁铵晶体恰好失去全部结晶水,固体残留率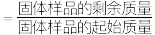
 。
。
写出
 的化学方程式:
的化学方程式:
您最近一年使用:0次
解答题-结构与性质
|
困难
(0.15)
名校
解题方法
【推荐2】聚合氯化铝(PVC)是一种高效絮凝剂,广泛用于城市给排水净化。工业上制备AlCl3的一种方法:Al2O3(s)+3C(s)+3Cl2(g) 2AlCl3(g)+3CO(g)。
2AlCl3(g)+3CO(g)。
(1)上述反应所涉及的元素中,未成对电子数相等的元素有________ ,能说明两者非金属性强弱的事实是_______ 。
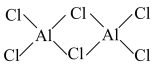
(2)AlCl3分子中心原子的杂化方式为________ 。常压、180℃时,AlCl3升华形成的二聚体(Al2Cl6)的结构如图所示,试用“→”标出其中的配位键________ 。
(3)美国科学家宣布发现了铝的“超级原子”结构——Al13、Al14。已知这类超级原子最外层电子数为40时处于相对稳定状态,下列说法正确的是________ 。
市售PAC是由Al3+水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝[AlO4Al12(OH)24(H2O)12]7+,简称Al13。Al13含量的高低直接影响PAC的净水效能。
(4)AlCl3溶液中,Al3+逐级水解能生成[Al(OH)]2+、[Al(OH)2]+等单体。生成[Al(OH)]2+的离子方程式为________ 。用AlCl3水解制备Al(OH)3胶体,其电中性的胶团组成正确的是________ 。
A.[mAl(OH)3•nAl3+•(3n-x)Cl-]x+•xCl- B.[mAl(OH)3•nCl-•xAl3+]3x+•3xCl-
C.[mAl(OH)3•nOH-•(n-x)H+]x-•xH+ D.[mAl(OH)3•nAl3+•(n-x)Cl-]x+•xCl-
(5)向AlCl3溶液中缓慢滴加一定量NaOH溶液,若只生成Al13,则理论上n(Al3+):n(OH-)=________ 。提纯Al13胶体可采取的措施是________ 。
(6)为了发挥PAC净水的最佳效能,一般要将水的pH调节在6.0~8.5。若在强酸或强碱环境下使用PAC,净水效果不佳,结合铝元素的存在形式分析原因________ 。
 2AlCl3(g)+3CO(g)。
2AlCl3(g)+3CO(g)。(1)上述反应所涉及的元素中,未成对电子数相等的元素有
(2)AlCl3分子中心原子的杂化方式为

(3)美国科学家宣布发现了铝的“超级原子”结构——Al13、Al14。已知这类超级原子最外层电子数为40时处于相对稳定状态,下列说法正确的是
| A.Al14与盐酸反应的化学方程式可表示为:Al14+2HCl=Al14Cl2+H2↑ |
| B.Al13和Al14互为同位素 |
| C.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子 |
| D.Al13超原子中Al原子间通过离子键结合 |
市售PAC是由Al3+水解产生的一系列中间产物脱水聚合而成,其中稳定存在形态为聚十三铝[AlO4Al12(OH)24(H2O)12]7+,简称Al13。Al13含量的高低直接影响PAC的净水效能。
(4)AlCl3溶液中,Al3+逐级水解能生成[Al(OH)]2+、[Al(OH)2]+等单体。生成[Al(OH)]2+的离子方程式为
A.[mAl(OH)3•nAl3+•(3n-x)Cl-]x+•xCl- B.[mAl(OH)3•nCl-•xAl3+]3x+•3xCl-
C.[mAl(OH)3•nOH-•(n-x)H+]x-•xH+ D.[mAl(OH)3•nAl3+•(n-x)Cl-]x+•xCl-
(5)向AlCl3溶液中缓慢滴加一定量NaOH溶液,若只生成Al13,则理论上n(Al3+):n(OH-)=
(6)为了发挥PAC净水的最佳效能,一般要将水的pH调节在6.0~8.5。若在强酸或强碱环境下使用PAC,净水效果不佳,结合铝元素的存在形式分析原因
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
解题方法
【推荐3】(1)“84”消毒液是一种常用的消毒剂,其有效成分是______ (填化学式)。某学生用石墨作电极电解饱和氯化钠溶液,制作了一种家用环保型消毒液发生器,如图所示。电极c处发生反应的离子方程式依次为:2H2O+2e-=H2↑+2OH-;_____ 。

(2)“84”消毒液工业品中常含有1.5%~3%的NaOH,其目的一是使平衡_____ (写出离子方程式)向逆方向移动;二是吸收空气中的_____ (填化学式)防止消毒液失效。
(3)消毒液中氯元素的存在形态与溶液pH的关系如下:
请你写出pH降低时产生氯气的离子方程式:_____ 。
(4)某同学猜测“84消毒液”(以下简称“84”)可以“漂白”米醋,进行了实验1和实验2:
实验2的目的是:①______ ;②______ 。
为进一步研究“84”与米醋的反应,该同学又进行了以下实验:
请你结合上述实验和相关资料,分析实验3与实验4现象的差异:______ 。
(5)某工厂使用次氯酸钠漂白棉布,该工厂对生产条件进行了研究,结果如图所示:
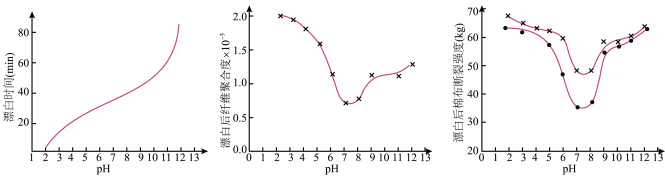
查阅资料得知:次氯酸钠对纤维素的破坏分为两个阶段进行。第一阶段:纤维素纤维的羟基与次氯酸作用生成次氯酸酯;第二阶段:生成的次氯酸酯在OH-离子作用下,失去一分子氯化氢,并转变为醛或酮,直接影响纤维素化学键的稳定性。
①当溶液pH=7时,纤维聚合度最低,纤维损伤最严重的原因是:_____ 。
②综合考虑,生产过程中pH最好选择_____ ,理由是_____ 。

(2)“84”消毒液工业品中常含有1.5%~3%的NaOH,其目的一是使平衡
(3)消毒液中氯元素的存在形态与溶液pH的关系如下:
| 溶液pH | >9 | 5~6 | 4~5 | 2~3 | <2 |
| 主要成分 | NaClO | HClO与NaClO(少量) | HClO与Cl2(少量) | HClO与Cl2 | Cl2 |
(4)某同学猜测“84消毒液”(以下简称“84”)可以“漂白”米醋,进行了实验1和实验2:
| 编号 | 实验操作 | 实验现象 |
| 实验1 |  滴加2滴米醋,5滴管“84” | 溶液无色,闻到刺激性气味 |
| 实验2 |  滴加2滴米醋,5滴管蒸馏水 | 溶液为浅棕色,无刺激性气味 |
为进一步研究“84”与米醋的反应,该同学又进行了以下实验:
| 编号 | 实验操作 | 实验现象 |
| 实验3 |  逐滴加入“84”,10滴米醋 | “84”滴入后迅速产生刺激性气味的气体;滴加至5滴时,溶液开始褪色;滴加至21滴时,褪为淡黄色;继续滴加不再出现明显褪色。 |
| 实验4 |  逐滴加入米醋,21滴“84” | 滴入米醋后立即褪色;当米醋滴加至10滴时,溶液较实验3颜色更浅;当米醋加至17滴时,与实验3中溶液最终颜色相同。 |
(5)某工厂使用次氯酸钠漂白棉布,该工厂对生产条件进行了研究,结果如图所示:

查阅资料得知:次氯酸钠对纤维素的破坏分为两个阶段进行。第一阶段:纤维素纤维的羟基与次氯酸作用生成次氯酸酯;第二阶段:生成的次氯酸酯在OH-离子作用下,失去一分子氯化氢,并转变为醛或酮,直接影响纤维素化学键的稳定性。
①当溶液pH=7时,纤维聚合度最低,纤维损伤最严重的原因是:
②综合考虑,生产过程中pH最好选择
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
名校
解题方法
【推荐1】某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6] 溶液,若产生红
褐色沉淀,证明有Cu2+。
(1)该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论是_______________ 。
(2)再次假设,黑色沉淀是铜的硫化物。实验如下:
①现象2说明黑色沉淀具有______ 性。
②能确认黑色沉淀中含有S元素的现象是_________ ,相应的离子方程式是_____________ 。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是___________________ 。
(3)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是_____________ 。
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6] 溶液,若产生红
褐色沉淀,证明有Cu2+。
(1)该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论是
(2)再次假设,黑色沉淀是铜的硫化物。实验如下:
| 实验装置 | 现象 |
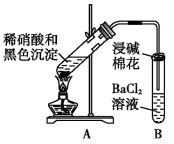 | 1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
②能确认黑色沉淀中含有S元素的现象是
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是
(3)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐2】为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,某化学小组开展如下探究性学习:
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3 2KNO2+O2↑
2KNO2+O2↑
2Cu(NO3)2 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
2AgNO3 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑
I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色;②溶液变红色。
(1)则Fe(NO3)2分解的化学方程式是___________ 。
II:【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(2)乙同学使用A装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是___________ 。
(3)丙同学取等质量Fe(NO3)2的在同样条件下热分解,用B装置收集气体产物,可收集到气体___________ mL。
III:【实验三】探究固体混合物的组成和特征
(4)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2物质的量之比可能为___________ 。
A.1∶2∶2 B.2∶1∶3 C.1∶2∶3 D.3∶8∶5
(5)取0.6mol由KNO3、Cu(NO3)2、Fe(NO3)3按等物质的量之比混合而成的粉末溶于100mL3mol/L的稀硫酸中,再向溶液中加入足量的铜粉,则最多可溶解铜粉质量为___________
【查阅资料】金属活泼性不同,其硝酸盐分解产物不同
(1)K→Na活泼金属的硝酸盐分解生成亚硝酸盐和氧气;
(2)Mg→Cu等较活泼金属的硝酸盐分解生成氧化物、NO2和O2;
(3)Hg以后不活泼金属的硝酸盐分解生成金属、NO2和O2。
2KNO3
 2KNO2+O2↑
2KNO2+O2↑2Cu(NO3)2
 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑2AgNO3
 2Ag+2NO2↑+O2↑
2Ag+2NO2↑+O2↑I:【实验一】探究Fe(NO3)2热分解固体产物中Fe元素的价态。该小组甲同学将其溶于足量的稀H2SO4得到相应两份溶液,进行以下探究实验。①向一份溶液中滴入少量KSCN溶液;②少量稀酸性KMnO4溶液中滴入另一份溶液。现象:①溶液变红色;②溶液变红色。
(1)则Fe(NO3)2分解的化学方程式是
II:【实验二】探究Fe(NO3)2热分解气体产物的性质。小组乙、丙同学进行了如下图所示的实验(收集时操作恰当,几乎没有空气)

实验步骤:①连接仪器;②检查装置气密性;③取一定质量Fe(NO3)2装于大试管,并重新连接好仪器;④加热;⑤……
(2)乙同学使用A装置收集气体,恰好收集到54mL红棕色气体,要从水槽中取出量筒,乙同学的正确操作方法是
(3)丙同学取等质量Fe(NO3)2的在同样条件下热分解,用B装置收集气体产物,可收集到气体
III:【实验三】探究固体混合物的组成和特征
(4)小组丁同学取KNO3、Cu(NO3)2、Fe(NO3)2混合粉末充分加热后用排水法未收集到任何气体,则KNO3、Cu(NO3)2、Fe(NO3)2物质的量之比可能为
A.1∶2∶2 B.2∶1∶3 C.1∶2∶3 D.3∶8∶5
(5)取0.6mol由KNO3、Cu(NO3)2、Fe(NO3)3按等物质的量之比混合而成的粉末溶于100mL3mol/L的稀硫酸中,再向溶液中加入足量的铜粉,则最多可溶解铜粉质量为
您最近一年使用:0次
解答题-实验探究题
|
困难
(0.15)
【推荐3】某化学小组设计了如图所示装置。用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略)。
(1)关闭活塞a与b,将9.6g Cu片和18mL18mol•L﹣1的浓H2SO4加入仪器B中共热至反应完全,发现烧瓶中还有Cu片剩余。该小组学生根据所学化学知识认为还有一定量的硫酸剩余。
①写出仪器B中发生反应的化学方程式____________ 。有一定量的H2SO4剩余但未能使铜片完全溶解,你认为可能的原因是_______________ 。
②请指出该套装置中的一个明显错误________________ 。
③装置C中气体收集满后,移走装置C,将装置B与装置D对接,然后打开活塞a与b,将分液漏斗中的无色无味液体滴入到装置A中淡黄色固体的表面,产生的无色气体可使装置B中剩余Cu片继续溶解,写出此时仪器B中发生反应的化学方程式__________________ 。
(2)欲测定H2SO4浓度低于多少时反应停止。该小组学生重新用足量铜与一定量的浓H2SO4共热,反应停止后冷却,再测定余酸的物质的量浓度。甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他设计了几种测定SO2的量的方案,下列方案中不可行的是_________ (填写字母编号)。

②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20ml于锥形瓶中,滴入几滴甲基橙作指示剂,用标准NaOH溶液进行滴定,通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量的浓度________ (填“能”或“否”)。理由是_______________ 。
[已知:Cu(OH)2开始沉淀的pH约为5,甲基橙变色的pH值范围为3.1﹣4.4]。
(1)关闭活塞a与b,将9.6g Cu片和18mL18mol•L﹣1的浓H2SO4加入仪器B中共热至反应完全,发现烧瓶中还有Cu片剩余。该小组学生根据所学化学知识认为还有一定量的硫酸剩余。
①写出仪器B中发生反应的化学方程式
②请指出该套装置中的一个明显错误
③装置C中气体收集满后,移走装置C,将装置B与装置D对接,然后打开活塞a与b,将分液漏斗中的无色无味液体滴入到装置A中淡黄色固体的表面,产生的无色气体可使装置B中剩余Cu片继续溶解,写出此时仪器B中发生反应的化学方程式
(2)欲测定H2SO4浓度低于多少时反应停止。该小组学生重新用足量铜与一定量的浓H2SO4共热,反应停止后冷却,再测定余酸的物质的量浓度。甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度。他设计了几种测定SO2的量的方案,下列方案中不可行的是
| A.将装置B产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量 |
| B.将装置B产生的气体缓缓通入足量酸性KMnO4溶液。再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀 |
| C.用排水法测定装置B产生气体的体积(已折算成标准状况) |
| D.用排饱和NaHSO3溶液的方法测出装置B产生气体的体积(已折算成标准状况) |

②乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20ml于锥形瓶中,滴入几滴甲基橙作指示剂,用标准NaOH溶液进行滴定,通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度。假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量的浓度
[已知:Cu(OH)2开始沉淀的pH约为5,甲基橙变色的pH值范围为3.1﹣4.4]。
您最近一年使用:0次



